И.С. Кудлинский: Больной 48 лет, пенсионер, в прошлом военнослужащий (рис. 1).
В 2001 г. отметил появление рецидивирующей геморрагической сыпи на коже голеней, которая усиливалась после физической нагрузки, переохлаждения, спонтанно регрессировала, оставляя после себя стойкую гиперпигментацию кожи. В течение последующих 6 лет наблюдался у дерматолога – проводилось местное лечение различными мазями без эффекта.
Летом 2007 г. при плановом профосмотре впервые выявлены HCVAb, при проведении ПЦР – HCVРНК, генотип 1в, высокая вирусная нагрузка (1,3 × 106 копий/мл), заподозрено вирусное поражение печени. В сентябре 2007 г. впервые госпитализирован в клинику им. Е.М. Тареева. При обследовании умеренное повышение уровня АСТ и АЛТ, высокий уровень СРБ и ревматоидного фактора, впервые выявлены криоглобулины, неопределяемый уровень комплемента, минимальная протеинурия. Диагностирован хронический гепатит С с системными проявлениями (криоглобулинемический васкулит с поражением кожи и почек). Начата комбинированная противовирусная терапия (ПВТ) пегилированным интерфероном α2b и рибавирином, через 12 недель лечения получен ранний вирусологический ответ – исчезновение HCVРНК из сыворотки. Динамика криоглобулинемии не была прослежена.
В последующем продолжена комбинированная ПВТ, но пегилированный интерферон α2b был заменен на короткоживущий реаферон по схеме 3 млн МЕ ч/д, рибавирин оставался в прежней дозе. Переносимость терапии была удовлетворительной, отмечена постепенная нормализация уровня печеночных ферментов, новые элементы сыпи не появлялись. HCVРНК в сыворотке на протяжении всего периода лечения стойко не выявлялась, лечение было завершено в августе 2008 г.
В сентябре 2008 г. больной попал в автокатастрофу, госпитализирован по месту жительства по поводу закрытой черепномозговой травмы, пневмоторакса, ушиба левой почки. Во время пребывания в стационаре отмечено умеренное повышение печеночных ферментов, вновь выявлена репликация вируса гепатита С, которая к декабрю 2008 г. составляла 2,6×106 копий/мл. ПВТ не возобновлялась.
Постепенно стали нарастать слабость, быстрая утомляемость, периодически отмечались субфебрилитет, свежие геморрагические высыпания на коже голеней, к вечеру – отеки стоп. Летом 2009 г. после переохлаждения ухудшение состояния, когда появились лихорадка до 38 °С, сухой кашель. Диагностирована двусторонняя полисегментарная пневмония, двусторонний гидроторакс. При госпитализации увеличение протеинурии до 2 г/сут, эритроцитурия. При обследовании по месту жительства выявлено повышение уровня креатинина до 1,6 мг/дл, вновь обнаружены криоглобулины. По поводу пневмонии проводилась антибактериальная терапия с положительной рентгенологической динамикой, однако сохранялись выраженная слабость, субфебрилитет, одышка, увеличились периферические отеки голеней и стоп, отмечено значительное повышение АД. Существенно усилились высыпания на коже голеней и стоп, на правой голени появились участки изъязвлений. Состояние расценено как обострение HCV-ассоциированного криоглобулинемического васкулита с поражением кожи, почек. С сентября 2009 г. назначен ПЗ в дозе 20 мг/сут, который больной принимал в течение 2 недель с некоторым положительным эффектом – нормализовалась температура тела.
Рисунок 1. График анамнеза больного В. 48 лет, строителя.
В сентябре 2009 г. госпитализирован в клинику им. Е.М. Тареева. При поступлении состояние тяжелое: одышка, выраженные кожные изменения с язвенными дефектами в области голеней, массивные отеки конечностей, АД до 200 и 120 мм рт. ст., выявлено снижение чувствительности и парестезии дистальных отделов рук и ног. При аускультации легких крепитация в нижних отделах. Отмечено нарастание протеинурии до нефротического уровня, выраженная эритроцитурия, снижение
клубочковой фильтрации и повышение уровня креатинина. Иммуносупрессивная терапия была усилена “пульс”-терапией ПЗ 1500 мг суммарно и увеличением пероральной дозы ПЗ до 60 мг/сут. В результате отмечено начало эпителизации язв, уменьшение выраженности геморрагических высыпаний. Но сохранялись массивные периферические отеки, артериальная гипертензия, нефротический и остронефритический синдромы.
При КТ легких выявлены интерстициальные изменения, симптом “матового стекла”, расцененные как признаки фиброзирующего альвеолита. Продолжали обнаруживаться криоглобулины и нулевой уровень комплемента, при электрофорезе белков сыворотки впервые выявлен М-градиент. В связи с этим больной консультирован и дообследован в ГНЦ РАМН. При исследовании трепанобиоптата костного мозга выявлена очаговая зрелоклеточная пролиферация В-лимфоцитов, клональных по κ-цепи IgM, CD19+, CD20+, CD22+. Иммунохимически в крови обнаружен парапротеин М-κ, в моче – белок Бенса–Джонса κ-типа. Эти изменения позволили предположить наличие у больного моноклональной лимфопролиферации. При контрольном исследовании костного мозга выявлен ингибитор апоптоза bcl2, диагностирована В-клеточная лимфома из клеток маргинальной зоны.
Клинический диагноз: хронический гепатит С, генотип 1b, низкой степени активности с системными проявлениями: криоглобулинемический васкулит с поражением почек (нефротический и остронефритический синдромы), легких (фиброзирующий альвеолит), кожи (язвенно-некротический ангиит), периферической нервной системы (сенсорная полиневропатия), развитием В-клеточной неходжскинской лимфомы (НХЛ) из клеток маргинальной зоны с секрецией парапротеина и парапротеинурией.
С учетом выявленной В-лимфомы из клеток маргинальной зоны, торпидного течения нефротического синдрома, а также развития инфекционных осложнений (повторные пневмонии) на фоне терапии стероидами принято решение о назначении antiCD20 моноклональных антител – ритуксимаба – после
снижения дозы ПЗ до 20 мг/сут. Проведено 2 в/в введения ритуксимаба по 500 мг с интервалом в неделю, а затем через месяц еще одно. В результате полностью эпителизировались язвенноекротические дефекты кожи, исчезли отеки, нормализовалось АД, ПУ снизилась до 3 г/сут, повысился уровень белков сыворотки.
С января 2010 г. после полной отмены ПЗ начата противовирусная терапия пегилированным интерфероном α2а 180 мкг в неделю и рибавирином 1000 мг/сут. Через 12 недель получен ранний ответ, но развилась анемия со снижением уровня гемоглобина до 63 г/л, которую связали с терапией рибавирином.
Доза рибавирина была снижена до 800, затем до 400 мг, назначен рекормон 10000 ЕД/нед с положительной динамикой со стороны показателей красной крови. В результате была вновь повышена
доза рибавирина до 800 мг/сут. При повторной трепанобиопсии признаков прогрессирования лимфомы не выявлено, кроме того, отмечено снижение уровня парапротеина, снижение и затем исчезновение криоглобулинов.
На 48-й неделе ПВТ по-прежнему констатируется авиремия, достигнутая после 12-й недели ПВТ, протеинурия составляла 0,76 г/сут, исчезла эритроцитурия, нормализовались АД, креатининемия; отмечено повышение гемолитической активности комплемента. Кроме того, отмечено снижение уровня моноклональной гаммапатии.
Таким образом, у больного хроническим гепатитом С болезнь манифестировала сосудистой пурпурой, через 6 лет после этого выявлены маркеры HCV-инфекции, высокий уровень криоглобулинемии, нулевой комплемент, клинические признаки поражения почек. Проведенная противовирусная
терапия позволила достигнуть авиремии и исчезновение клинических признаков криоглобулинемического васкулита. Новое обострение криоглобулинемического васкулита, возникшее на фоне рецидива вирусной инфекции (после автокатастрофы), характеризовалось рецидивом криоглобулинемического васкулита с развитием язвенно-некротического ангиита, полиневропатии, фиброзирующего альвеолита и тяжелым обострением гломерулонефрита (нефротическим,
остронефритическими синдромами, высокой АГ и почечной недостаточностью), а также развитием В-клеточной НХЛ. Активная терапия с применением преднизолона, ритуксимаба и последующей ПВТ (в течение 48 недель) привела к ремиссии всех проявлений криоглобулинемического васкулита на фоне
стойкой авиремии.
Н.А. Мухин: Представленное клиническое наблюдение вновь подчеркивает актуальность проблемы смешанной КГ, ассоциированной с HCV-инфекцией. Хотелось бы прежде всего обсудить механизмы развития криоглобулинемического васкулита, очертить круг связанных с ним клинических симптомов,
роль лимфотропности вируса гепатита в их генезе.
С.Ю. Милованова: Криоглобулинемия (КГ), описанная еще в начале XX в., характеризуется наличием в сыворотке крови одного или более иммуноглобулинов, обратимо преципитирующих при температуре ниже 37 ˚С.
Термин “криоглобулины” был предложен в 1948 г. Lerner и Watson, которым удалось доказать, что феномен преципитации при низкой температуре зависит от глобулинов.
Клиническое значение КГ впервые отметил M. Meltzer, описавший в 1966 г. “эссенциальную” смешанную криоглобулинемию, включившую иммуноглобулины разных изотипов, которая ассоциировалась с тремя клиническими симптомами – пурпурой, артралгиями и слабостью, впоследствии обозначенными как триада Мельтцера, к которым затем причислили гломерулонефрит.
В 1974 г. J.C. Brout и соавт. классифицировали криоглобулинемию на три типа в зависимости от компонентов криопреципитата. Согласно этой классификации, типы II и III относятся к смешанной КГ и состоят из моноклонального IgMκ (тип II) или поликлонального IgM (тип III) со свойствами ревматоидного фактора (РФ) и антигена – обычно поликлонального IgG.
В 1974 г. J.C. Brout и соавт. классифицировали криоглобулинемию на три типа в зависимости от компонентов криопреципитата. Согласно этой классификации, типы II и III относятся к смешанной КГ и состоят из моноклонального IgMκ (тип II) или поликлонального IgM (тип III) со свойствами ревматоидного фактора (РФ) и антигена – обычно поликлонального IgG.
Сразу после идентификации в 1989 г. HCV отмечена связь смешанной КГ с HCV-инфекцией, что послужило поводом для новой волны интереса к проблеме КГ и повлекло за собой кардинальные изменения в ее изучении. В настоящее время смешанную КГ II типа рассматривают как специфический
маркер хронической HCV-инфекции, о чем свидетельствует обнаружение HCV-инфекции у 80–95 % больных со смешанной КГ (главным образом II типа), выявление криоглобулинов в сыворотке крови и криопреципитатах примерно у половины больных ХГС, причем концентрация HCV RNA в криопреципитатах в десятки тысяч раз превосходит ее концентрацию в сыворотке. Доказанное участие HCV в образовании иммунных комплексов (anti HCVIgG – IgMκ-РФ) и обнаружение антигенов вируса и HCV РНК методом in situ гибридизации в поврежденных тканях [9, 13].
Нами проведено исследование частоты смешанной КГ в группе из 130 больных гепатологического отделения с установленным диагнозом хронического гепатита С (ХГС): КГ выявлена в сыворотке крови у 37 % больных [5]. Полученные нами данные практически не отличаются от приведенных в литературе: частота СКГ среди лиц, инфицированных HCV, в Европе оценивается от 34 % в Италии до 54 %во Франции [13].
В патогенезе HCV-ассоциированной КГ решающее значение имеет лимфотропность HCV с преимущественным вовлечением В-лимфоцитов. Результатом взаимодействия антигенов вируса со специфическими рецепторами на поверхности В-лимфоцитов (установлено взаимодействие E2 HCV с CD81 В-лимфоцитов), является поли/олиго/моноклональная пролиферация В-лимфоцитов с повышенной продукцией широкого спектра аутоантител и образованием иммунных комплексов, в т. ч. смешанных криоглобулинов, которые создают субстрат иммунопатологических реакций, лежащих в основе клинических проявлений КГ. У части больных длительная активация В-лимфоцитов с накоплением генетических мутаций ведет к развитию злокачественной В-клеточной пролиферации [9,
13, 21].
Клинические симптомы развиваются у 30 % больных с HCV-ассоциированной смешанной КГ в их основе лежит криоглобулинемический иммунокомплексный лейкоцитокластический васкулит с преимущественным поражением мелких сосудов. Патогенез криоглобулинемического васкулита наиболее хорошо изучен на примере кожного васкулита: иммунные комплексы в сосудах кожи формируются in situ из антигенов HCV (core, E2), IgG (anti HCV) и моноклонального IgMκ-РФ. Активация C1q комплемента ведет к специфическому связыванию мультимолекулярного комплекса с эндотелиальными клетками через рецепторы к C1q и развитие воспаления с привлечением лейкоцитов (лейкоцитокластический васкулит). Кожный васкулит (сосудистая пурпура), вовлечение суставов
(артралгии, артриты), в т. ч. в составе классической триады Мельтцера (пурпура, артралгии и слабость), – наиболее частые проявления КГ-васкулита; кроме того, наблюдается поражение
слюнных желез, периферической нервной системы (сенсорная или сенсорно-моторная полиневропатия), почек (криоглобулинемический мезангиокапиллярный гломерулонефрит). Реже
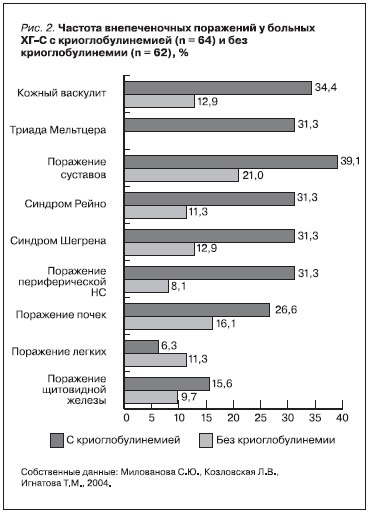
развивается легочный васкулит (или, как у наблюдаемого нами больного, фиброзирующий альвеолит), вовлекаются сосуды желудочно-кишечного тракта, головного мозга, коронарные сосуды [1, 3, 7, 13, 24] (рис. 2).
Системные проявления, ассоциированные со смешанной КГ и HCV-инфекцией могут приобретать ведущее значение в клинической картине болезни и, индуцируя ревматологические, гематологические, дерматологические и другие маски, быть причиной ее позднего распознавания. У обсуждаемого нами больного заболевание дебютировало кожной пурпурой, по поводу которой он длительно наблюдался у дерматолога, связь с вирусом гепатита С была установлена лишь через 6
лет. Пурпура имела рецидивирующий характер, ее обострения совпадали с рецидивом HCV-инфекции. Последнее обострение характеризовалось тяжелым язвенно-некротическим поражением кожи – обширными язвенными дефектами на обеих конечностях. После “пульс”-терапии преднизолоном
отмечено начало эпителизации язв, но быстрая и окончательная эпителизация произошла после присоединения ритуксимаба.
У больных с HCV-инфекцией без КГ также возможно развитие системных проявлений, однако спетр и частота этих проявлений значительно выше у больных с КГ, чем без КГ (рис.2). Больные с КГ характеризуются и значимо более высокой частотой иммунных нарушений – высокой активностью РФ (у 84,4 против 24,2 %), снижением гемолитической активности комплемента (у 92,2 против 29 %), повышением уровня иммуноглобулинов М (у 68,8 против 20,9 %). Следует отметить, что тяжелые системные проявления КГ, ассоциированной с HCV-инфекции (криоглобулинемический мезангиокапиллярный гломерулонефрит, развитие В-НХЛ), могут определять прогноз, что обосновывает применение противовирусной терапии на более ранних стадиях, в т. ч. еще до развития клинических проявлений васкулита.
Н.А. Мухин: Наиболее прогностически серьезным клиническим проявлением криоглобулинемического васкулита и HCV-инфекции является, как известно, поражение почек, в первую очередь криоглобулинемический МКГН. Какие еще гистологические типы ГН описаны в ассоциации с HCV-инфекцией и КГ и чем характеризуется течение криоглобулинемического HCV-ассоциированного мезангиокапиллярного ГН?
Н.Б. Гордовская: Действительно среди широкого спектра системных проявлений хронической HCV-инфекции поражение почек нередко определяет прогноз [2, 4, 5, 13, 24].
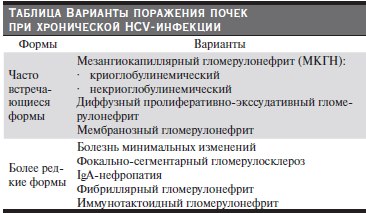
В ассоциации с инфекцией вируса гепатита С описано несколько гистологических типов ГН (см. таблицу): криоглобулинемический и некриоглобулинемический мезангиокапиллярный ГН (МКГН) или, по зарубежной терминологии, мембранопролиферативный ГН, диффузный пролиферативно- экссудативный ГН, мембранозный ГН (МГН). Имеются отдельные наблюдения за лицами, инфицированными вирусом гепатита С, нефрита с минимальными изменениями, фокально-сегментарного гломерусклероза (ФСГС), IgA-нефропатии и более редких типов (фибриллярного ГН, иммунотактоидного ГН), однако причинная связь этих типов ГН с HCV-инфекцией окончательно не доказана.
По данным Итальянского регистра почечных биопсий за 1996 г. HCV-инфекция выявлена у 88,4 % больных с криоглобулинемическим МКГН, существенно реже у больных с МКГН без СКГ (17,8 %).
По нашим данным, поражение почек диагностировано у 17,5 % больных КГ (10 из 57), выявленной среди 180 больных гематологического отделения с установленным диагнозом HCV за 2-летний период [5].
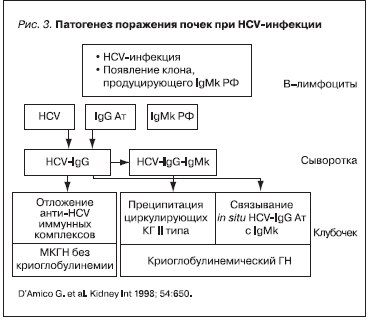
По мнению большинства исследователей ГН, развивающийся у больных с HCV-инфекцией, имеет преимущественно криоглобулинемическую природу, хотя некоторые авторы, R.G. Johnson, G.D’Amico, допускают возможность некриоглобулинемического поражения почек в рамках HCV- инфекции
[10, 17] (рис. 3). Предполагают, что в генезе криоглобулинемического ГН основная роль принадлежит моноклональному компоненту смешанной КГ II типа благодаря наличию в его антигенсвязывающей части WA-кросс-идиотипа, обладающего уникальной способностью перекрестно связываться с
тканевыми структурами почки, в частности с фибронектином мезангиального матрикса. Этим объясняют высокую частоту развития ГН при ассоциированной с HCV КГ II типа (в 3 раза чаще по сравнению с III типом).
К развитию МКГН приводит отложение иммунных комплексов, состоящих из IgMκ-РФ и анти-HCV класса IgG в субэндотелиальном пространстве и мезангии клубочков почек.
С.В. Тэгай: Мы оценили длительность периода инфицирования HCV до появления у больных признаков поражения почек и установили, что она составила в среднем около 197 месяцев [5]. Считают, что длительная персистенция HCV – необходимое условие для эволюции III типа СКГ, содержащего два поликлональных компонента иммуноглобулинов, во II тип, содержащий моноклональный IgMκ, которому придают основную роль в развитии клинических проявлений криоглобулинемического васкулита, включая ГН.
По данным литературы, персистенция HCV до появления смешанной КГ III типа составляет 7,6 ± 7,7 года, до развития смешанной КГ II типа (наиболее нефритогенного типа) – 14,2 ± 13,7 года, а возникновение ГН от первых проявлений криоглобулинемии – около 4 лет (от 0 до 492 месяцев) [7, 13,
24]. Однако в нашем наблюдении у отдельных (14 %) больных клинические признаки поражения почек возникали одновременно с другими системными проявлениями СКГ (кожная пурпура, триада Мельтцера, нейропатия, синдромы Рейно и Шегрена, поражение желудочно-кишечного тракта, легких) и даже предшествовали им (“нефритические маски” КГ). У обсуждаемого нами больного кроме поражения почек отмечены и другие системные проявления криоглобулинемического васкулита – кожная пурпура с развитием язвенно-некротических дефектов, полинейропатия, а также триада Мельтцера.
Криоглобулинемический МКГН (МКГН II типа) считают основным типом поражения почек при HCV-инфекции. По нашим данным, среди больных с HCV-инфекцией и поражением почек морфологическая картина криоглобулинемического МКГН выявлена у 75 %, значительно реже отмечались криоглобулинемический и некриоглобулинемический МПГН [5].
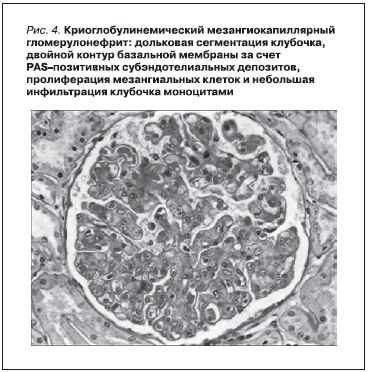
Морфологические изменения в почках при криоглобулинемическом МКГН (рис. 4) имеют некоторые особенности, позволяющие отличать его от идиопатического МКГН 1-го типа. Этими особенностями являются: 1) внутрикапиллярные (“внутрипросветные”) тромбы, состоящие из преципитатов криоглобулинов и при электронной микроскопии имеющие вид фибриллярных или кристаллоидных структур; 2) гиперклеточность клубочков из-за массивной инфильтрации лейкоцитами, главным образом моноцитами (число инфильтрирующих моноцитов в острую стадию заболевания может
достигать 80 клеток в одном клубочке, что в среднем в 4 раза больше у больных, например, активным пролиферативным волчаночным нефритом); 3) выраженное удвоение и утолщение базальной мембраны клубочков почек (в большей степени за счет расположения по периферии моноцитов, а не в связи с интерпозицией мезангиального матрикса и мезангиальных клеток); 4) васкулит артерий мелкого и среднего калибра с участками фибриноидного некроза и моноцитарной инфильтрацией стенки. Склеротические изменения чаще выражены умеренно и выявляются непостоянно. Однако примерно в 10 % случаев обнаруживается картина МКГН с зонами центролобулярного склероза. Морфологическая и иммунологическая картина напоминает идиопатический лобулярный МКГН 1-го
типа, за исключением выраженной моноцитарной инфильтрации [7, 13, 24].
У части (25 %) больных, обычно с умеренно выраженным мочевым синдромом, в т. ч. после интенсивной терапии, при гистологическом исследовании биопсийного материала отмечена картина мезангиопролиферативного ГН.
Н.Б. Гордовская: Проведенное нами сравнение основных нефрологических синдромов у 25 больных с HCV-ассоциированным поражением почек показало, что у 64 % (16 больных) ГН протекал латентно с умеренным мочевым синдромом: небольшой ПУ, у большинства (14 человек) больных в сочетании с эритроцитурией, в т. ч. выраженной (более 100 в п/зр) – у 6. У меньшей части – 16 % (4 человека)
больных наблюдались нефротический синдром (НС): отеки до степени анасарки, высокая протеинурия (более 3,5 г/сут), гипопротеинемия, гиперлипидемия. У двух больных (у одного с умеренным мочевым синдромом и у одного с НС) отмечена умеренная преходящая креатининемия (соответственно 1,5 и 2,8 мг/дл), у остальных функция почек осталась сохранной. Артериальная гипертензия наблюдалась
у большинства больных с умеренным мочевым синдромом (у 9 среди 16) и у всех (4) больных с НС. У 20 % (5 из 20) больных констатирован остронефритический синдром – выраженные ПУ с гипопротеинемией, эритроцитурия, высокая артериальная гипертензия; у всех этих больных
выявлена гиперкреатининемия [5].
Тяжесть поражения почек зависит от типа и степени смешанной КГ. Так, в нашем более раннем наблюдении [2, 4] среди 50 больных, у которых были типированы криоглобулины, все тяжелые формы ГН, проявляющиеся нефротическим или остронефритическим синдромами, у части – с олигурической
острой почечной недостаточностью, относились ко II типу с высоким уровнем смешанной КГ (более 800 мкг/мл, криокрит – более 5 %).
К клиническим критериям неблагоприятного прогноза криоглобулинемического ГН в рамках HCV-инфекции относят старший (более 50 лет) возраст, рецидивирующую кожную пурпуру, повышение в дебюте заболевания уровня креатинина сыворотки (более 1,5 мг/дл), низкий уровень С3 (менее 54 мг/дл), высокий уровень криокрита – более 10 % [2, 4, 5].
Морфологическими критериям неблагоприятного прогноза служат наличие массивных внутрикапиллярных (внутрипросветных) тромбов, острый васкулит почечных артерий с полями
фибриноидного некроза и моноцитарной инфильтрацией стенки.
У обсуждаемого больного, несмотря на отсутствие морфологических данных (биопсию почек не удалось провести из-за выраженной тяжести состояния), можно предполагать криоглобулинемический МКГН на основании клинической картины – наличие остронефритического синдрома с тяжелой
артериальной гипертензией, гиперкреатининемией, протеинурией нефротического уровня, гипопротеинемией в сочетании с признаками активного криоглобулинемического васкулита – высоким уровнем криокрита (5 %) ревматоидного фактора (11N), нулевым уровнем комплемента. Таким образом, у больного имелись клинические критерии, позволившие рассматривать почечный прогноз как очень серьезный, требующий активных методов лечения. Назначение моноклональных антител к CD 20 (ритуксимаба) с последующей противовирусной терапией позволило добиться клинико-лабораторной ремиссии с нормализацией функции почек.
Н.А. Мухин: В настоящее время установлена связь некоторых форм В-клеточных НХЛ с вирусом гепатита С и криоглобулинемией. Как объясняется сегодня эта связь?
Л.В. Козловская: Обобщение большого числа эпидемиологических исследований показало, что частота HCV-инфекции среди больных В-клеточной НХЛ (в среднем около 10 %) существенно превышает частоту HCV-инфекции в общей популяции (около 1,5 %) и среди больных другими формами лимфопролиферативных заболеваний (около 3 %) [12, 16, 19]. Считают, что риск В-клеточной лимфомы выше у больных смешанной КГ, развивающейся при длительном течении HCV-инфекции. Время от начала HCV-инфекции до диагноза В-клеточной НХЛ составляет в среднем 15 лет, от диагноза смешанной КГ – 6,26 года (0,81–24 года). Большая частота В-клеточных НХЛ отмечается в районах с высокой распространенностью HCV-инфекции (В Южной Европе выше, чем в Северной Европе и Северной Америке). Трансформация ассоциированной с HCV доброкачественной реактивной В-клеточной пролиферации в злокачественную опухоль происходит, повидимому, в результате последовательных повторных мутаций с отбором автономного опухолевого клона.
Особенностью В-клеточных лимфом, ассоциированных с HCV-инфекцией, являются старший возраст заболевших, часто экстранодальная локализация (печень, селезенка, слюнные железы), развитие через длительный период (более 15 лет) от момента инфицирования, отсутствие четкой связи
с определенным генотипом HCV (есть указания на большую частоту у больных с генотипом вируса 2а/с; в последнее время это ставится под сомнение), наличие сухого синдрома [14,25]. Показано, что HCV(+) НХЛ содержит В-лимфоциты, способные спонтанно продуцировать РФ с WA-кроссидиотипом, характерным для больных с КГ. РФ с WА-кроссидиотипом при HCV-ассоциированной КГ кодируется VH1-69/JH4-геном иммуноглобулинов, который также экспрессируется у больных c HCV-ассоциированной В-клеточной НХЛ.Полиморфизм VH1-69/JH4-гена может предрасполагать
индивидуума к появлению криоглобулинемии и, возможно, НХЛ [9, 15, 26].
В патогенезе В-клеточных лимфом, ассоциированных с HCV, в последнее время придают большое значение BAFF-фактору, активирующему В-клетки из семейства ФНО (обнаруживается в печени, коже и в крови у больных смешанной КГ), который ингибирует апоптоз и способствует выживаемости аутореактивных В-клеток, при этом HCV-инфекция играет роль триггера образования BAFF [9].
Предполагают, что BAFF соединяется с клеточными рецепторами В-лимфоцитов (BCR) и вызывает сигнал выживаемости с усилением В-клеточной пролиферации. Повышенная В-клеточная выживаемость способствует накоплению генетических мутаций, ведя к опухолевой трансформации.
Важной патогенетической ступенью, связанной с лимфопролиферацией у пациентов с HCV+ КГ, считают хромосомную транслокацию t (14, 18) с увеличением экспрессии bcl2 протеина, ведущей к ингибиции апоптоза и анормальной В-клеточной выживаемости. Однако в последнее время показано, что транслокация t (14,18) не более частая среди пациентов HCV+НХЛ, чем среди HCV- НХЛ. Преимущественно выявляемыми фенотипами HCV+ НХЛ являются лимфома из клеток маргинальной зоны (MCL), MALT (мукозоассоциированнной лимфоидной ткани) – лимфома, лимфоплазмоцитарная
лимфома/иммуноцитома (Ic), диффузная крупноклеточная В-лимфома (DLBCL).
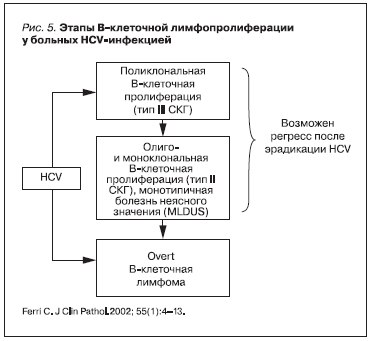
В-клеточные клональные лимфоцитарные инфильтраты, напоминающие В-клеточную лимофоцитарную лейкемию (CLL), иммуноцитому (Ic), могут обнаруживаться у больных с хронической HCV-инфекцией и КГ в печени, костном мозге, селезенке задолго до определенной (overt) злокачественной лимфомы и обозначаются как монотипичная лимфопролиферативная болезнь неопределенного значения (MLDUS) [9, 13] (рис. 6).
MLDUS остается длительное время немодифицируемой и только в 8–10 % переходит в overt НХЛ. Важно отметить, что на стадии MLDUS возможен регресс опухоли после эрадикации HCV, что определяет необходимость мониторирования лимфопролиферации у всех больных хронической HCV-
инфекцией, ранней диагностики и своевременной активной противовирусной терапии этих больных (рис. 5).
У обсуждаемого больного можно проследить все этапы развития HCV-ассоциированной лимфопролиферации – криоглобулинемии через моноклональную гаммапатию к overt В-клеточной лимфоме. Первым симптомом, позволившим предположить моноклональную лимфопролиферацию (т. н.
монотипичную лимфопролиферативную болезнь неясного значения – MLDUS), было появление парапротеина IgMκ в сыворотке крови и белка Бенса–Джонса κ-типа в моче. При исследовании костного мозга с применением иммунофенотипирования в трепанобиоптате были обнаружены изменения, позволившие с определенной долей вероятности подтвердить это предположение. При трепанобиопсии через 6 месяцев в лимфоцитарных пролифератах костного мозга обнаружен
ингибитор апоптоза bcl2 и диагностирована В-клеточная лимфома из клеток маргинальной зоны.
Несмотря на то что лечение ритуксимабом и противовирусная терапия, показанные в этой ситуации, были начаты на стадии не MLDUS, а точной лимфомы, можно надеяться на замедление (приостановление) дальнейшего прогрессирования В-клеточной лимфомы, о чем свидетельствует уменьшение величины парапротеина сыворотки и исчезновение белка Бенса–Джонса в моче. Однако с большим основанием на данный вопрос можно ответить после проведения контрольного исследования костного мозга после завершения противовирусной терапии.
Н.А. Мухин: Установление роли вируса гепатита С в качестве основного этиологического фактора криоглобулинемического васкулита радикально повлияло на терапевтическую тактику его лечения. Постоянно совершенствующаяся этиотропная терапия рассматривается в настоящее время в качестве основного вида лечения, которое применяется изолированно или в сочетании с патогенетическими средствами. Можно ли сегодня изменить ранее в основном неблагоприятный прогноз HCV-криоглобулинемического васкулита?
Т.М. Игнатова. Лечение HCV-криоглобулинемического синдрома представляет собой сложную задачу и включает средства разнопланового действия. Это прежде всего этиотропное противовирусное лечение с включением интерферона-альфа, обладающего как противовирусным, так и антипролиферативным действием. Это и традиционные иммуносупрессивные препараты, направленные на подавление иммунного воспаления, продукцию аутоантител и образование иммунных комплексов, а также повторных сеансов плазмафереза для быстрого удаления иммунных комплексов и медиаторов воспаления. В последнее время все более широко используются средства, направленные на устранение олиго- и моноклональной пролиферации В-лимфоцитов (ритуксимаб).
Противовирусная терапия (ПВТ) является терапией выбора, поскольку устранение этиологического фактора способно привести к стойкой ремиссии васкулита. Обобщение мирового опыта применения пегилированного интерферона-альфа и рибавирина у больных HCV-криоглобулинемическим васкули-
том показало, что частота стойкого вирусологического ответа (СВО), т. е. сохранения авиремии через 6 месяцев после лечения, достигает 60 %, и это сопоставимо с результативностью такой
терапии у больных ХГС в целом [8, 22].
Вирусологический ответ сопровождается достижением ремиссии васкулита, а также регрессом некоторых форм В-НХЛ (главным образом лимфомы маргинальной зоны с низкой степенью злокачественности). Установлено, что клинический эффект выражен, как правило, в отношении
нетяжелых начальных проявлений васкулита (сосудистая пурпура, артралгии, слабость). Наиболее резистентными к противовирусному лечению оказались поражение почек, тяжелые формы невропатии и язвенно-некротический кожный васкулит. У больных с HCV-криоглобулинемическим васкулитом
требуются, как правило, более длительные (по сравнению со стандартными) курсы терапии, нередко повторное лечение в связи с высокой частотой развития рецидивов HCV-инфекции
и васкулита [8, 22].
Увеличение длительности наблюдения за больными после ПВТ показало, что у части больных, несмотря на достижение СВО, сохраняются иммунологические маркеры лимфопролиферации (выявление КГ, повышение активности РФ, снижение комплемента) и наблюдаются поздние (в сроки свыше 6 месяцев после ПВТ) рецидивы васкулита, даже развитие В-лимфомы при сохранении авиремии [18]. Причиной
таких рецидивов может служить персистенция HCV в лимфоцитах – т. н. латентная HCV-инфекция. В пользу значения “латентной” HCV-инфекции свидетельствует показанная корреляция между обнаружением РНК HCV в В-лимфоцитах и иммунологическими маркерами – выявлением КГ, активностью РФ, снижением комплемента [15]. Однако РНК HCV не всегда обнаруживается в В-лимфоцитах, в связи с чем не исключается возможность продолжающейся не зависимой от вируса лимфопролиферации после его полной элиминации, по крайней мере у части больных. При этом обсуждается особая роль генетических факторов, а также сохранения и после элиминации вируса высокой продукции стимулятора В-лимфоцитов (B-lymphocyte stimulator – BlyS, известный как BAFF). Возможность сохранения не зависимой от вируса лимфопролиферации обусловливает целесообразность применения ритуксимаба.
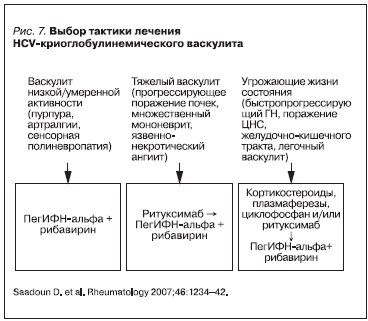
Выбор тактики лечения больных HCV-криоглобулинемическим васкулитом основывается на тщательной оценке проявлений и активности васкулита. Изолированное применение ПВТ рекомендуется при низкой активности васкулита, его начальных проявлениях. Современный подход к лечению
тяжелых форм HCV-криоглобулинемического васкулита представляет собой применение активной патогенетической терапии с последующим курсом ПВТ (рис. 7) [21].
Среди средств патогенетической терапии предпочтение отдают новому подходу – применению СD20 моноклональных антител (ритуксимаба), вызывающих лизис и апоптоз лимфоцитов и таким образом устраняющих основное патогенетическое звено – олиго- и моноклональную лимфопролиферацию. Накопленный к настоящему времени опыт применения ритуксимаба у больных тяжелыми формами
HCV-криоглобулинемического васкулита, резистентными к предшествующей иммуносупрессивной и/или ПВТ, показал его высокую эффективность – достижение клинического улучшения у 80–90 %, ремиссии – почти у половины больных. Недостатком этого лечения является нестойкость эффекта с развитием обострения васкулита через несколько месяцев после лечения, а также установленная возможность активации вирусной репликации после лечения. Это послужило основанием для рекомендации применения ПВТ после терапии ритуксимабом [6, 22].
В последние годы проведены исследования эффективности сочетанной терапии ритуксимабом и противовирусными препаратами в сравнении с изолированным применением ПВТ у больных HCV-криоглобулинемическим васкулитом (включая наблюдения В-лимфомы) [7, 8]. В одном из этих
исследований, в которое включались больные, резистентные к предшествующей терапии, установлено, что в группе сочетанной терапии (ритуксимаб и ПВТ) наблюдается более быстрое наступление клинической ремиссии, более частое достижение ремиссии поражения почек и В-лимфомы,
иммунологического ответа (исчезновение КГ), чем в группе больных, получавших ПВТ. Однако частота стойкой клинической ремиссии через 4 года после лечения была одинаковой в обеих группах и составила 56 % [23]. В другом исследовании, включившем больных тяжелым HCV-криоглобулинемическим васкулитом, ранее не получавших никакой терапии, анализируется частота стойкого полного ответа (включившего вирусологический, клинический, иммунологический ответы и ответ на молекулярном уровне – исчезновение олиго- и моноклональной пролиферации
В-лимфоцитов) через 3 года после лечения, который в группе больных с сочетанной терапией был значимо выше (45,5 %), чем в группе изолированной ПВТ (13 %) [11]. Обсуждается синергизм действия противовирусных препаратов и ритуксимаба в отношении подавления олиго- и моноклональной лимфопролиферации. Таким образом, современная сочетанная терапия позволяет радикально улучшать прогноз примерно у 50 % больных с HCV-ассоциированным криоглобулинемическим синдромом.
В представленном в данном разборе наблюдении рецидив HCV-криоглобулинемического васкулита и развитие В-НХЛ связаны с рецидивом HCV-инфекции, которую не удалось полностью устранить с помощью первого курса ПВТ. Применение современной сочетанной терапии ритуксимабом
и противовирусными препаратами (с включением ПегИФН-альфа), а также увеличение длительности ПВТ позволяют рассчитывать на достижение элиминации вируса и ремиссии заболевания.
Н.А. Мухин: Разработаны ли оптимальные схемы использования сочетания ритуксимаба с ПВТ, каков профиль безопасности такой терапии и каковы перспективы повышения эффективности лечения данной категории больных?
Т.М. Игнатова: Оптимальные схемы сочетанной терапии до настоящего времени не разработаны. Исследователи Франции применяли введение ритуксимаба 375 мг/м2 1 раз в неделю на протяжении 4 недель или дважды по 1000 мг 1 раз в 2 недели (40 мг преднизолона перед каждой инфузией
ритуксимаба) с последующим (через месяц) началом ПВТ [24]. В исследовании, проведенном в Италии, применялось одновременное начало ПВТ и введение ритуксимаба 375 мг/м2 1 раз в неделю на протяжении первых 4 недель и еще 2 введения 1 раз в 5 месяцев (20 мг преднизолона перед каждым
введением ритуксимаба) [11]. Отмечена удовлетворительная переносимость лечения. В первом исследовании прекращение ПВТ из-за нежелательных явлений потребовалось у 10 % больных, во втором – все больные завершили лечение, но у 18 % больных уменьшалась доза ПегИФН-α. Отмечено более частое развитие синдрома сывороточной болезни при введении высоких доз (1000 мг) ритуксимаба. Кроме того, описано одно наблюдение выраженного обострения криоглобулинемического васкулита после введения 1000 мг ритуксимаба больному с высоким уровнем криокрита. В качестве причины обострения васкулита обсуждается способность CD20 моноклональных антител образовывать комплексы с IgMκ-КГ. В связи с этим предпочтение отдают схеме введения ритуксимаба по 375 мг/м2 1 раз в неделю, а у больных с высоким уровнем криокрита рекомендуют проводить сеансы плазмафереза перед началом лечения [23].
Представляет интерес недавно опубликованный опыт применения ритуксимаба у больных HCV-криоглобулинемическим васкулитом, имеющих противопоказания к ПВТ, в т. ч. у больных с декомпенсированным циррозом печени. Показаны безопасность такого лечения и эффективность в отношении не только проявлений васкулита, но и поражения печени (улучшение белковоинтетической функции, уменьшение асцита), несмотря на возможность транзиторного повышения уровня виремии [20].
Появление в ближайшие годы новых противовирусных, а также генно-инженерных биологических препаратов (моноклональных антител к BlyS и его рецепторам) позволяет рассчитывать на дальнейшее повышение эффективности лечения HCV-криоглобулинемического синдрома.
Н.А. Мухин: Таким образом, установление этиологической связи СКГ II типа с HCV-инфекцией, с одной стороны, способствует пониманию механизмов взаимодействия иммунной системы с вирусной инфекцией, с другой стороны, открывает путь к правильной трактовке клинических симптомов, возникающих в рамках HCV-ассоциированной КГ, позволяет применять современную тактику лечения
этой категории больных и определять методы профилактики. Сегодня препаратом выбора при лечении больных с HCV являются пегилированные формы интерферона-α, оказывающего противовирусное и антипролиферативное действие. Важным направлением в лечении являются
завоевывающие позиции средства, устраняющие олиго- и моноклональную пролиферацию В-лимфоцитов, ответственную за развитие криоглобулинемии и моноклональной гаммапатии.



