В мире непрерывно увеличивается средняя продолжительность жизни, что связано как с уменьшением смертности в детском и среднем возрасте, так и с увеличением продолжительности жизни пожилых.
Так, в России средняя продолжительность жизни за сто лет выросла более чем в 2 раза – с 32 лет в 1892–1897 гг. до 70–71 года в 1970 г.
Встречаемость хронической почечной патологии повсеместно растет. В 1990 г. хроническая болезнь почек (ХБП) занимала 27-е место среди основных групп заболеваний, а в 2010 г. переместилась на 18-е место. Хотя, возможно, темпы снижения скорости клубочковой фильтрации (СКФ) для молодых и пожилых одинаковы [1], увеличивается число пожилых пациентов со снижающейся СКФ [2]. Не знают о своей патологии 4 из 5 больных с ХБП 2–3-й ст. Во Франции у каждого третьего после 70 лет можно диагностировать ХБП. С 1993 по 2003 г. доля больных 75–89 лет, получающих заместительную почечную терапию (ЗПТ), увеличилась на 57% [3].
Факторы риска ХБП у пожилых разнообразны: диабет и преддиабет – в мире 170 млн больных диабетом и их число может увеличиться в 2 раза через 20 лет: артериальная гипертония и атеросклероз, нарушение жирового обмена, снижение физической активности, наличие аритмий [4, 5].
Риск смерти у пожилых людей повышается при наличии и прогрессировании ХБП. В программе исследования здоровья пожилых (EHEP-Тайвань) в 2002–2004 гг. участвовали – 35 529 лиц; средний возраст – 75,7 года. Распространенность ХБП 3–5-й ст. – 39,4%. 1840 участников (5,18%) умерли в течение 2 лет наблюдения. По сравнению с лицами, имеющими СКФ>60 мл/мин, риск смерти возрастал по мере прогрессирования ХБП: в 1,5 раза – при СКФ 30–44 мл/мин; в 2,1 раза – при СКФ 15–39 мл/мин; в 2,6 раза – при СКФ<15 мл/мин.
Почти треть больных старше 65 лет, которым была начата ЗПТ, погибают в течение первого года лечения от сердечно-сосудистых заболеваний. Подобный исход связан с высокой коморбидностью в пожилом возрасте. Как свидетельствуют статистики различных регионов мира, пациенты, выжившие после 1-го года ЗПТ, могут жить неограниченнодолго.
Трансплантация почки (ТП) является наиболее эффективным методом лечения терминальной хронической почечной недостаточности (ТХПН) в плане как медицинской, так и социальной реабилитации пациентов. Однако иммуносупрессивная терапия способствует развитию ряда осложнений, прежде всего сердечно-сосудистых, а также инфекционных и онкологических, поэтому в XX в. к ТП у пожилых людей относились с большой осторожностью.
Возрастные рамки для ТП постепенно расширяются. Как свидетельствует регистр США (2008), с 1988 г. число реципиентов ренального трансплантата пожилого возраста (старше 60 лет) возросло в 3 раза и в 2008 г. составило 4492. Еще на рубеже XX и XI вв. C. Ponticelli писал о мифах, связанных с преимуществами и недостатками ЗПТ у пожилых. Он выражал сомнение в таких положениях: диализ надежнее трансплантации и выживаемость трансплантатов у пожилых хуже. Уже тогда было отмечено, что с возрастом снижается активность иммунного и воспалительного ответа – снижение уровня IL-2 (интерлейкина-2) и рецептора IL-2, клеточной реакции и экспрессии HLA-DR. Кроме того, пожилым свойственна высокая приверженность лечению [6].

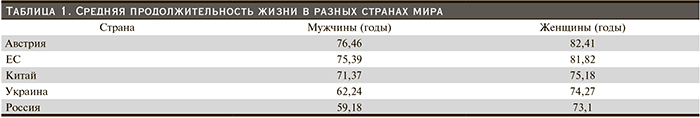
Средняя продолжительность жизни в разных странах мира, по данным ВОЗ, на начало XI в. представлена в табл. 1.
В России по сравнению со странами Западной Европы продолжительность жизни женщин отстает на 7–10 и мужчин на 14–17 лет. Это позволяет нам условно считать пожилыми больных старше 55 лет.
Проведен анализ результатов ТП, выполненных в 2009–2013 гг. в двух возрастных группах: 1-я – от 18 до 55 лет включительно и 2-я – старше 55 лет. Группу «молодых» реципиентов составили 213 больных. В старшей возрастной группе было 38 больных (11,1%). Средний возраст в «молодой» группе равнялся 38,5±5 лет, в «пожилой» 63±3 года. Соотношение мужчин и женщин: 128/85 и 21/17 соответственно.
Структура ХБП в разных возрастных группах представлена в табл. 2. Среди «пожилых» преобладали пациенты с т.н гломерулонефритом (ГН). Гломерулонефритом наряду с анамнестически и гистологически доказанным ГН часто считают артериальную гипертонию (АГ) с умеренным мочевым синдромом и быстрым развитием ТХПН, когда можно думать о гипертоническом нефроангиосклерозе или ишемической болезни почек.
Все больные до ТП получали ЗПТ: 70% – гемодиализ и 30% – амбулаторный перитонеальный диализ. Средняя продолжительность ЗПТ – 13 месяцев (одинакова в обеих группах).
Донорами были лица с черепно-мозговой травмой или инсультом в возрасте от 18 до 70 лет. Изъятие органов осуществлялось по констатации биологической смерти в 60% случаев, а у остальных – по смерти мозга. Время консервации не превышало 18 часов.

Индукционная иммуносупрессия, включавшая циклоспорин А (CyА) 5 мг/кг или такролимус (Tac) 0,15–0,20 мг/кг+микофенолаты-2 1 г в сутки, преднизолон 0,5 мг/кг, симулект 20 мг на операционном столе 1-я доза и 2-я – на 4-й день после трансплантации, метилпреднизолон 0,5 г во время операции и 0,25 г на 2-е и 4-е сутки после трансплантации, была одинаковой в обеих группах. В дальнейшем 95% пациентов получали такролимус (целевая минимальная концентрация такролимуса – Со 8–10 нг/мг)+микофенолаты 720 мг 1 г+преднизолон 10–5 мг в день; 5% реципиентов назначали циклоспорин А. Целевые концентрации: минимальная – Со 150, и максимальная – С2 1400 нг/мл+микофенолаты 1,44 – 2 г+преднизолон 10–15 мг в сутки.
Наблюдение над 41 953 пациентами с функционирующим трансплантатом (1995–2000) показало, что основной причиной летальности являются сердечно-сосудистые осложнения (ССО) – инсульт и инфаркт миокарда. Отказ от кортикостероидов ведет к достоверному снижению их встречаемости [7]. К наиболее частым несердечно-сосудистым осложнениям относят костную патологию и посттрансплантационный сахарный диабет (ПТСД). В сроки от 3 до 15 месяцев гипергликемия приводит к дисфункции мелких артерий [8]. Костные изменения отслежены у 69 740 реципиентов (1997–2010). Наиболее тяжелые (переломы шейки бедра) имели место в 597 случаях на 155 342 пациенто-года [9].
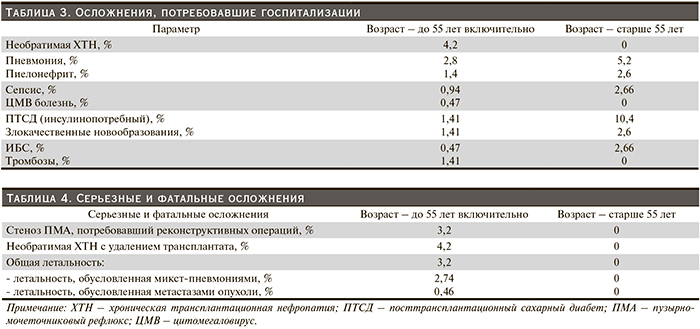
На протяжении данного наблюдения имел место ряд серьезный осложнений, потребовавших госпитализации (табл. 3). К этим осложнениям относились внепочечная патология и патология трансплантата – различные инфекции (пиелонефрит, пневмония, сепсис, ЦМВ-болезнь), посттрансплантационный сахарный диабет, ишемическая болезнь сердца, тромбоз ветвей легочной артерии, гидронефроз трансплантата, обусловленный стенозом пузырно-мочеточникового соустья, хроническая трансплантационная нефропатия (нефротоксичность ингибиторов кальциневрина, реакция отторжения, возвратный гломерулонефрит, хронический АФС).
В течение 5 лет утрата почечных трансплантатов в группе больных 18–55 лет составила 6,1% (табл. 4, рис. 1). Причинами потери трансплантата в 9 случаях была необратимая хроническая трансплантационная нефропатия – удаление трансплантата и возобновление лечения гемодиализом стало следствием тяжелой хронической дисфункции трансплантата (острое отторжение на фоне хронического, антифосфолипидный синдром – АФС, возвратный гломерулонефрит). Умерли 7 пациентов (рис. 2). У 6 из них причиной смерти была микст-пневмония (сочетание вирусной и бактериальной инфекции) на фоне умеренной почечной дисфункции. Через год 1 пациент умер после экстирпации желудка по поводу рака на фоне распространенного метастазирования.
Все пациенты старше 55 лет живы, и функция трансплантатов у них стабильно удовлетворительная. Хотя осложнения, требовавшие госпитализации, встречались примерно с одинаковой частотой, а ПТСД даже чаще в старшей возрастной группе обращает внимание на различие в исходах ТП у наших больных.
В группе до 55 лет зарегистрировано 7 смертей у больных с функционирующим трансплантатом и выполнено 9 трансплантатэктомий. Необратимое снижение функции трансплантата наиболее часто (7 случаев) было связано с хроническим активным отторжением, в 1 – с АФС и еще в 1 – с рецидивом ФСГС.
В группе после 55 лет к моменту обработки материала все больные живы, сохраняют стабильную удовлетворительную функцию трансплантата (СКФ 40–60 мл/мин) и удовлетворительное общее состояние.
Следует подчеркнуть большую по сравнению с молодыми реципиентами приверженность терапии среди больных старшего возраста, что сводит к нулю потери трансплантата, связанные с нарушением порядка амбулаторного наблюдения и тем более с отказом от приема иммуносупрессивных препаратов.
Проблемы трансплантации для больных пожилого возраста вызваны в первую очередь недостатком органов и дефицитом живых доноров, что ведет к тому, что по этическим моментам для операции предпочитают отбирать более молодых реципиентов [10].
Обследование пожилых для листа ожидания требует использования ряда дополнительных методов в связи с риском коморбидности (коронарография, исключение онкологии и т.д.) Лица старше 65 лет нуждаются в более детальном обследовании и жестких принципах включения. Следует учитывать уровень белка крови, наличие сахарного диабета, ИБС и атеросклероза периферических сосудов [11]. Возможными способами решения данной проблемы могут служить пересадка органов от пожилых доноров пожилым пациентам, расширение критериев донорства – возраст от 60 или от 50 лет при наличии 2 из 3 критериев (АГ в анамнезе, креатинин более 1,5 мг%, смерть от инсульта), пересадка 2 почек одному реципиенту, если донор маргинален и совершенствование иммуносупрессии с отменой стероидов [6, 10].
Предлагаются различные критерии сердечно-сосудистой выживаемости после трансплантации почки: функция трансплантата, уровень Нв, уровень гомоцистеина, содержание С реактивного белка, кардиотропина Т [12]. Появление новых иммуносупрессивных препаратов (блокаторы пролиферативного сигнала, новые препараты для индукции иммуносупрессии – анти-CD25-антитела и др.), уменьшение дозы стероидов [13], совершенствование профилактики инфекционных и онкологических осложнений позволит и далее увеличивать группу реципиентов почечного трансплантата старшего возраста и улучшать выживаемость трансплантатов, а также качество жизни пациентов.



