Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является наиболее распространенным заболеваний среди мужчин пожилого и старческого возраста. На его долю приходится более 40% от числа всех болезней мужчин старше 50 лет [1–4]. Гистологические признаки ДГПЖ при аутопсии обнаруживаются у 40% мужчин в возрасте 50 лет и у 90% старше 80 лет. К старости данная патология развивается у 95% мужчин [5, 6]. Установлено, что клинические проявления ДГПЖ имеются у 34% мужчин в возрасте 40–49 лет, у 67% 50–59 лет, у 77% 60–69 лет и у 83% в возрасте старше 70 лет [7–9].
 Оперативному лечению подвергаются свыше 40% мужчин старше 50 лет, и доля таких пациентов растет в связи с общемировыми тенденциями старения населения. В настоящее время в России открытая аденомэктомия составляет 27,2% операций, трансуретральная резекция простаты – 27,8% [10–13]. Несмотря на совершенствование техники оперативных вмешательств в современной урологии, частота осложнений продолжает расти.
Оперативному лечению подвергаются свыше 40% мужчин старше 50 лет, и доля таких пациентов растет в связи с общемировыми тенденциями старения населения. В настоящее время в России открытая аденомэктомия составляет 27,2% операций, трансуретральная резекция простаты – 27,8% [10–13]. Несмотря на совершенствование техники оперативных вмешательств в современной урологии, частота осложнений продолжает расти.
По сравнению со странами Западной Европы и США частота осложнений оперативного лечения больных ДГПЖ в нашей стране значительно выше [14]. Одной из причин смерти больных после аденомэктомии служат тромботические осложнения, которые развиваются до 50% больных или во время операции, или в первые сутки после нее и являются причиной неудовлетворительных результатов лечения, приводят к удлинению послеоперационного периода и часто к летальному исходу. Их профилактика должна начинаться в предоперационном периоде [15, 16].
Существующие на сегодняшний день методы исследования позволяют изучить почти каждый этап участия тромбоцитов в процессе тромбообразования. Среди методов морфофункциональной оценки тромбоцитов можно назвать такие, как агрегометрия, проточная цитометрия, интерференционная микроскопия др. К наиболее близким к решению проблемам морфофункционального анализа нефиксированных тромбоцитов относится метод морфометрического прижизненного исследования тромбоцитов с помощью фазово-интерференционной микроскопии.
 Внедрение в клиническую практику новых методов эфферентной терапии, таких как внутрисосудистое лазерное облучение крови, открыли значительные перспективы и возможности лечения урологических заболеваний. В последнее время резко выросло число исследований и публикаций в зарубежных научных журналах статей, посвященных изучению НИЛИ. К 2011 г. их насчитывалось более 400, а это почти 20-кратное увеличение за 10 лет [17, 18]. Методика ВЛОК была разработана в начале 1980-х гг. и оказалась эффективной в отношении ряда заболеваний и до сих пор применяется в урологии как самостоятельно, так и в сочетании с другими методами физиолечения, а также в комплексе с фармакотерапией [19, 20].
Внедрение в клиническую практику новых методов эфферентной терапии, таких как внутрисосудистое лазерное облучение крови, открыли значительные перспективы и возможности лечения урологических заболеваний. В последнее время резко выросло число исследований и публикаций в зарубежных научных журналах статей, посвященных изучению НИЛИ. К 2011 г. их насчитывалось более 400, а это почти 20-кратное увеличение за 10 лет [17, 18]. Методика ВЛОК была разработана в начале 1980-х гг. и оказалась эффективной в отношении ряда заболеваний и до сих пор применяется в урологии как самостоятельно, так и в сочетании с другими методами физиолечения, а также в комплексе с фармакотерапией [19, 20].
Универсальность биологического действия внутривенного лазерного облучения крови обусловлена влиянием на клеточный и субклеточный уровни регулирования и поддержания гомеостаза, а при возникающих нарушениях этих механизмов воздействие НИЛИ корректирует физиологическую реакцию более высокого уровня организации живого. Всю совокупность изменений в крови, наблюдаемых при ВЛОК, необходимо рассматривать как отклик системы регулирования гомеостаза на патологические процессы в отдельных органах и тканях.
Цель исследования: изучить особенности морфологической структуры, функциональной активности и популяционного состава циркулирующих тромбоцитов периферической крови у больных ДГПЖ. Оценить влияние внутривенного лазерного облучения крови на морфофункциональное состояние тромбоцитов методом rеal-timе визуализации.
Материал и методы
В основу работы положены результаты обследования 169 больных ДГПЖ, которым проведено лечение в клинике урологии РУДН на базе городской клинической больницы № 29 им. H.Э. Бaумaнa в период с 2011 по 2014 г. Из 169 (100%) больных ДГПЖ, включенных в исследование, основную группу составили 86 (50,89%) пациентов, контрольную группу – 83 (49,11%). Проведенный анализ показал, что медиана возраста больных составила 69,8 (7,2) года. Нами проведена оценка морфофункционального состояния тромбоцитов с использованием аппаратно-программного комплекса БИОНИ (АПК БИОНИ) методами компьютерной цитоморфометрии (рис. 1). Исследования проводили совместно с лабораторией медицинской цитологии НИЦ ГБОУ ДПО РМАПО Минздрава России на базе ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (руководитель – профессор И.А. Василенко). Количественный анализ данных произведен отдельно с помощью программных средств, разработанных в среде MATLAB. Для каждой клеточной популяции оценивали морфометрические параметры: средние значения диаметра, периметра, высоты, площади и объема клеток. Результаты расчетов представлены в виде таблицы параметров каждого объекта и серии графиков.
После обследования пациентам основной группы выполнено внутривенное лазерное облучение крови с помощью полупроводникового аппарата «AЗОР» и свeтоводных насадок с мощностью излучения 2 мВт длиной волны 0,63 мкм. Время экспозиции составило 45 минут однократно в течение 7 суток.

Статистический анализ проводился в пакете программ STАTISTIСА 10. При обработке результатов использовались как параметрические, так и непараметрические методы. Если закон распределения соответствовал нормальному закону, применяли параметрические методы, в противном случае использовались непараметрические методы. Зависимость между двумя количественными переменными исследовалась с помощью корреляционного анализа с определением коэффициента корреляции Пирсонa. Анализ двух независимых и зависимых (парных) выборок проведен на основании t-критерия Стьюдента. Для каждой группы наблюдений вычислялись центральная тенденция (медиана, среднее) и вариационные статистики или статистики диапазона (квартили, стандартные ошибки, стандартные отклонения). Результаты считались статистически значимыми при p<0,05.
 Результаты
Результаты
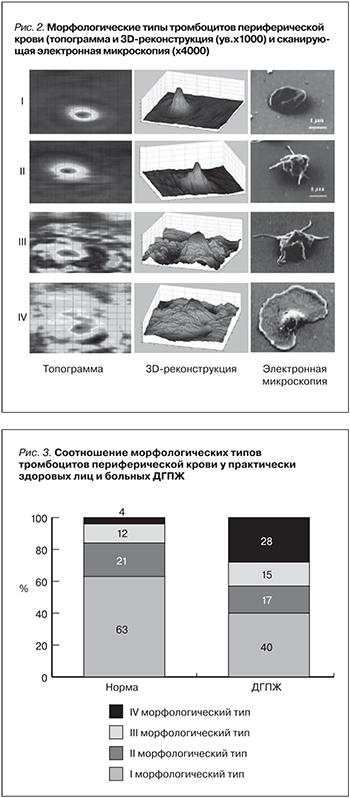
При исследовании тромбоцитов методом витальной компьютерной морфометрии нами были выделены 4 основных морфологических типа, характеризующих ту или иную степень их активации. Основой для дискриминации структурно измененных клеток служили различные варианты их формы, характера рельефа поверхности, наличие псевдоподий, их количество и величина, что представлено на рис. 2. Плоские округлые клетки с гладкой или складчатой поверхностью – «гладкие» и «рифленые» дискоциты, соответствовали I типу. Ко II морфологическому типу тромбоцитов были отнесены клетки округлой или неправильной формы с гладкой или складчатой поверхностью и 1–3 короткими (меньше диаметра клетки) отростками-псевдоподиями, являющимися выростами поверхностной мембраны. Клетки, имеющие около 2–5 длинных (больше диаметра клетки) отростков, представляли III тип и отличались большим многообразием форм: от плоских дисков до клеток неправильной формы. Тромбоциты неправильной формы с неровной бугристой поверхностью, большим количеством отростков различной длины и многочисленными вакуолями были отнесены к IV морфологическому типу – дегенеративно-измененным клеткам (рис. 2).
Гладкие и рифленые дискоциты – это т.н. формы «покоя». Тромбоциты II–III типов, отличающиеся появлением отрост-ков различного числа и длины, а также изменением их формы, связанной с перестройкой цитоскелета и структуры грануломера, проявляют внешние признаки функциональной активности. Клетки IV типа – тромбоциты, исчерпавшие свой функциональный потенциал (рис. 3).
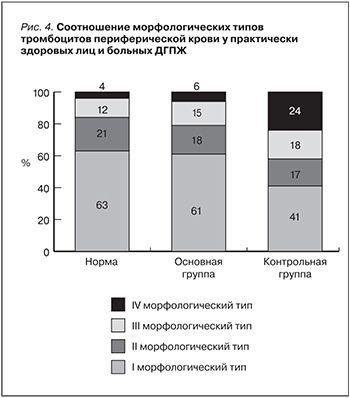
Установлено, что в условиях физиологической нормы 63% тромбоцитов представлены клетками «покоя», 21% – с низким уровнем активации (II тип). Количество высокоактивированных клеток с длинными отростками-«антеннами» составляет 12% (III тип), а дегенеративно-измененных (IV тип) – 4% (рис. 3).
В группе больных ДГПЖ соотношение морфологических типов тромбоцитов составило: 40% – формы «покоя», 17% – тромбоцитов с низким уровнем активации, 15% – высокоактивированных клеток и 28% – дегенеративных тромбоцитов.
Анализ витальных размерных параметров фазовых портретов тромбоцитов (см. таблицу) продемонстрировал, что при поступлении у всех пациентов средние в популяции диаметр, периметр, площадь и объем циркулирующих клеток превышали нормальные значения на 20, 18, 30 и 2% соответственно. Диаметр при поступлении больных ДГПЖ обеих групп составил 3,20±0,81 мкм, периметр – 9,94±3,01 мкм, площадь 6,56±3,77 мкм2, объем – 1,71±0,98 мкм3. Фазовая высота тромбоцитов, отражающая состояние тромбоцитарного грануломера, была достоверно снижена на 42% и составила 0,71±0,31 мкм. Важно отметить, что фазовая высота позволяет оценивать полноценность гранулярного аппарата (реакция выброса активированного тромбоциты отражается снижением фазовой высоты клетки).
При оценке тромбоцитов после ВЛОК нами установлено, что у пациентов основной группы нами зарегистрировано снижение количества активных тромбоцитов в циркулирующей популяции и повышение тромбоцитов I типа (клеток «покоя»). Это свидетельствует о подавлении агрегационной и адгезивной способности в тромбоцитарном звене гемостаза (рис. 4).
Анализ витальных размерных параметров фазовых портретов тромбоцитов продемонстрировал, что у пациентов основной группы, которым проведено внутривенное лазерное облучение крови, средние в популяции диаметр, периметр, объем и площадь циркулирующих клеток снизились на 12, 14, 9 и 22% соответственно. Фазовая высота повысилась на 10%.
Обсуждение
Использование современных компьютерных технологий в клинической практике позволили объективизировать результаты лечения, повысить точность измерений и гарантировать комплексный подход к решению поставленных дифференциально-диагностических задач. Морфометрические показатели циркулирующих тромбоцитов, определяемые экспресс-методом в режиме реального времени, служат объективным и информативным критерием оценки состояния клеточного звена гемостаза.
Применение низкоинтенсивного лазерного излучения позволило создать высокоэффективные методики лечения и профилактики рецидивов многих заболеваний в различных областях медицины. Однако использованию в урологической практике данного метода посвящены единичные исследования. Несмотря на то что в литературе встречаются отдельные сообщения о применении внутривенного лазерного облучения крови у урологических больных [21–23], мы не встретили информации об использовании этого метода у больных ДГПЖ.
Морфологический состав циркулирующей популяции тромбоцитов у пациентов с ДГПЖ по сравнению со здоровыми лицами характеризуется повышением количества высокоактивированных клеток до 15% и дегенеративных тромбоцитов до 28%. Морфометрические параметры тромбоцитов отличаются увеличением геометрических параметров клеток (диаметр, периметр и площадь) на 20, 18, 30% и снижением оптических параметров (высоты) на 42%, что свидетельствует о появлении в циркуляции более высокого процента молодых форм тромбоцитов.
Проведение курса ВЛОК способствует увеличению числа тромбоцитов покоя до 61%, снижению числа дегенеративных тромбоцитов до 6%, улучшению показателей витальных размерных параметров фазовых портретов тромбоцитов, что приводит к подавлению адгезивной и агрегационной способности тромбоцитов. Данные показали, что использование внутривенного лазерного облучения крови приводит к более ранней ликвидации претромботического процесса и улучшение гемостаза.



