Цель исследования. Изучить частоту и выраженность ГЭРБ, возможную взаимосвязь с поражением легких при системной склеродермии.
Материал и методы. 56 пациентов (средний возраст – 46±14 лет) с диффузной и лимитированной формами системной склеродермии разделены на группы в зависимости от наличия и отсутствия гастроэзофагальнорефлюксной болезни (классификация Монреальского консенсуса). Проведено стандартное клинико-инструментальное обследование всех пациентов, включившее гастродуоденоскопию, рентгеноконтрастное исследование пищевода, компьютерную томографию легких в режиме высокого разрешения для оценки наличия и тяжести легочного поражения.
Результаты. ГЭРБ выявлено у 27 из 56 (48,2%) обследованных пациентов (24 из которых получали регулярную терапию ингибиторами протонной помпы на регулярной основе и 3 при обострении симптомов). По данным эзофагогастродуоденоскопии у 1 из 23 пациентов, которым было выполнено ЭГДС, выялен эрозивный ГЭРБ, у 11 пациентов – неэрозивный ГЭРБ (гиперемия слизистой пищевода) и у 11 – функциональные изменения пищевода (ЭГДС-негативная стадия). У всех обследованных пациентов отмечено умеренное поражение пищевода. Согласно классификации Савари–Миллер тяжести рефлюкс-эзофагита, у 1 выявлена I стадия рефлюкс-эзофагита, II, III и IV стадий рефлюкс-эзофагита выявлено не было. Почти у всех пациентов (26 из 27) с ГЭРБ имело место наличие дисфагии и только у 11 пациентов без ГЭРБ. Нарушение моторики пищевода вывлено по данным рентгеноконтрастного исследования у 20 из 25 (80%) пациентов с ГЭРБ по сравнению с 5 из 24 (20,8%) без ГЭРБ. Клинически значимая одышка (NYHA≥II) выявлялась в 2 раза чаще у пациентов с наличием ГЭРБ по сравнению с пациентами с отсут-
ствием ГЭРБ (у 92,6% по сравнению с 44,8% соответственно, p=0,0002). Выраженная одышка (NYHA III) выявлена в 4 раза чаще у пациентов с наличием ГЭРБ по сравнению с пациентами с отсутствием ГЭРБ (44,4% по сравнению с 10,3% соответственно, p=0,006). Выраженное поражение легких по классификации Goh и др. (более 20%) встречалось достоверно чаще у пациентов с ГЭРБ, чем в ее отсутствие (74,1 по сравнению с 37,5%, p=0,018).
Заключение. ГЭРБ является частым поражением при системной склеродермии. Выявлено сочетание более тяжелого поражения легких с наличием ГЭРБ; это свидетельствует о возможном вкладе ГЭРБ в развитие и прогрессирование легочного фиброза у пациентов с системной склеродермией.
Системная склеродермия (ССД; прогрессирующий системный склероз) – системное аутоиммунное заболевание соединительной ткани с разнообразными клиническими проявлениями, высоким риском развития осложнений и с высокой смертностью [1, 2]. Наиболее частым поражением легких при системной склеродермии является интерстициальная болезнь легких (ИБЛ – ССД), выявляемая, по данным разных авторов, в 25–70% случаев заболевания [9, 19]. К основным клиническим симптомам поражения легких при системной склеродермии относятся одышка, сухой кашель, крепитация.
Поражение желудочно-кишечного тракта с системным склерозом, по данным литературы, отмечается у 90% пациентов. Встречается поражение всех отделов пищеварительного тракта, но наиболее характерно поражение пищевода с нарушением моторики и развитием дисфункции пищевода [9]. К наиболее частым последствиям дисфункции пищевода при системной склеродермии относят развитие гастроэзофагеальной рефлюксной болезни (ГЭРБ). Вовлечение пищевода служит ранним и часто бессимптомно протекающим проявлением системной склеродермии. В связи с этим необходимо максимально раннее выявление признаков поражения пищевода у пациентов с системной склеродермией. В настоящее время существует ряд методов, использующихся для выявления поражения пищевода, включая КТ высокого разрешения.
По данным ряда авторов, у пациентов с системной склеродермией с наличием ГЭРБ отмечается более выраженное поражение легких [12, 34, 44]. В связи с этим представляет интерес изучение возможности предотвращения риска прогрессирования легочного фиброза у пациентов с системной склеродермией путем своевременной диагностики и раннего начала адекватной терапии ГЭРБ, что позволит снизить заболеваемость и смертность при поражении легких у пациентов с системной склеродермией.
Материал и методы
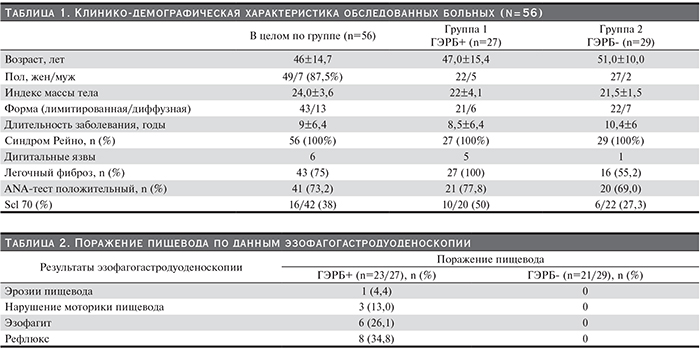
Для проведения основного анализа все больные были разделены на 2 группы: 1-ю группу составили 27 пациентов с наличием ГЭРБ, 2-ю – 29 пациентов с отсутствием ГЭРБ (табл. 1).
 Все пациенты с ГЭРБ получали терапию блокаторами протонной помпы (омепразол, омез, ультоп, нольпаза). Из них 24 принимали препарат на постоянной основе (средняя продолжительность лечения составила 2 года), 3 – курсами длительностью от 2 месяцев. На момент обследования жалобы на изжогу, несмотря на терапию блокаторами протонной помпы, предъявляли 17 из 27 пациентов (63%). Почти у всех пациентов (26 из 27) присутствовало наличие дисфагии, у всех пациентов с наличием ГЭРБ и у 11 пациентов без ГЭРБ.
Все пациенты с ГЭРБ получали терапию блокаторами протонной помпы (омепразол, омез, ультоп, нольпаза). Из них 24 принимали препарат на постоянной основе (средняя продолжительность лечения составила 2 года), 3 – курсами длительностью от 2 месяцев. На момент обследования жалобы на изжогу, несмотря на терапию блокаторами протонной помпы, предъявляли 17 из 27 пациентов (63%). Почти у всех пациентов (26 из 27) присутствовало наличие дисфагии, у всех пациентов с наличием ГЭРБ и у 11 пациентов без ГЭРБ.
Результаты и обсуждение
По данным эзофагогастродуоденоскопии у 1 из 23 пациентов, которым было выполнено ЭГДС, выялен эрозивный ГЭРБ, у 11 пациентов – неэрозивный ГЭРБ и у 11 функциональные изменения пищевода (ЭГДС-негативная стадия).
У всех обследованных пациентов отмечено умеренное поражение пищевода. Согласно классификации Савари–Миллер тяжести рефлюкс-эзофагита, у 1 выявлена I стадия рефлюкс-эзофагита, II, III и IV стадий рефлюкс-эзофагита выявлено не было, что может свидетельствовать об эффективности массивной терапии ГЭРБ высокими дозами ингибиторов протонной помпы (табл. 2).
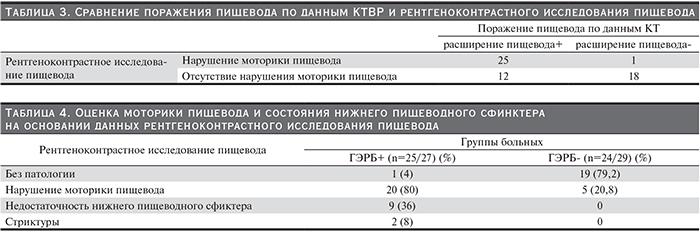
По данным рентгеноконтрастного исследования пищевода, из 27 пациентов с наличием ГЭРБ у 20 (74%) пациентов выявлено нарушение моторики пищевода, у 9 (33%) пациентов – недостаточность нижнего сфинктера пищевода и у 2 (7,4%) пациентов – стриктуры пищевода (табл. 3, 4).
При обследовании пациентов в данном исследовании всем пациентам выполнена компьютерная томография легких для оценки поражения легких, что позволило оценить состояние пищевода, по данным КТВР. Расширение пищевода, по данным КТ, выявлено у 37 из 56 (66%) пациентов, у 26 из 27 (96%) – с наличием ГЭРБ и у 11 из 29 (38%) – с системной склеродермии без ГЭРБ, что свидетельствует о нарушении моторики пищевода у большинства пациентов с системной склеродермией (табл. 3). К признакам поражения пищевода при КТ высокого разрешения (КТВР) относят расширение пищевода с заполнением газом, жидкостью, остатками пищи. Наличие данных изменений служит важным дифференциально диагностическим признаком, позволяющим также отличать интерстициальное поражение легких, ассоциированное с заболеваниями соединительной ткани от поражения легких другой этиологии. Имеются данные, согласно которым бессимптомное расширение пищевода и нарушение моторики отмечается у 80% с системной склеродермией [32].
Особенностью поражения верхних отделов желудно-кишечного тракта при системной склеродермии является сочетание ГЭРБ с нарушением моторики пищевода и недостаточностью нижнего пищеводного сфинктера, что создает предпосылки для более тяжелого поражения легких в связи с высоким риском микроаспирации, а следовательно, развития воспаления и фиброза.
В нашем исследовании наличие сочетания ГЭРБ с более выраженным поражением легких подтверждается как клиническими, так и инструментальными данными.
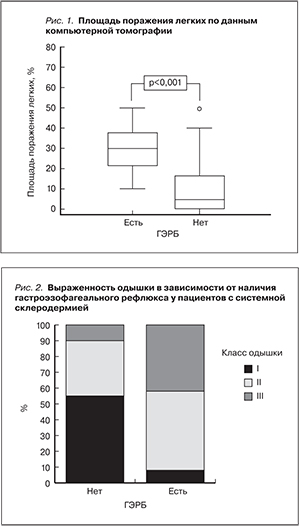
В частности, клинически значимая одышка (NYHA≥II) выявлялась в 2 раза чаще у пациентов с наличием ГЭРБ по сравнению с пациентами с отсутствием ГЭРБ (у 92,6% [у 25 из 27 пациентов] по сравнению с 44,8% [у 13 из 29 пациентов] соответственно, p=0,0002, RR [относительный риск] – 2,1 [1,4–2,5], доверительный интервал 95%). Выраженная одышка (NYHA III) выявлялась в 4 раза чаще у пациентов с наличием ГЭРБ по сравнению с пациентами с отсутствием ГЭРБ (44,4% [у 12 из 27 пациентов] по сравнению с 10,3% [у 3 из 29 пациентов] соответственно, p=0,006, RR – 4,2 [1,3–18,5], доверительный интервал 95%) (рис. 1).
О выраженности поражения легких при наличии ГЭРБ также свидетельствуют данные, согласно которым у обследованных пациентов с системной склеродермией с наличием гастроэзофагеального рефлюкса объем поражения легких более 20% (что является выраженным поражением легких по классификации Goh и соавт. [19]) встречается достоверно чаще, чем в отсутствие ГЭРБ (74,1 по сравнению с 37,5%, p=0,018) (рис. 2).
Полученные нами данные о наличии взаимосвязи ГЭРБ с более выраженным поражением легких при системной склеродермии подтверждаются также данными международных исследований [12, 34, 44].
В частности, в исследовании Marie и соавт. оценивалась взаимосвязь нарушения моторики пищевода и интерстициальной болезни легких у пациентов с системным склерозом на основании данных функциональных легочных тестов и КТВР в течение 2 лет [34] и было выявлено, что у пациентов с выраженным нарушением моторики пищевода по сравнению с группой пациентов с умеренным и без нарушения моторики пищевода значительно снижена медиана диффузионной способности легких по монооксиду углерода (Dlco) (68%, 94 и 104 % соответственно) и чаще признаки ИБЛ–ССД по КТВР (57%, 27 и 18%). Интересные данные о взаимосвязи поражения пищевода и легких при ССД были получены в исследовании Savarino и соавт. У 18 (45%) пациентов с системным склерозом был выявлен легочный фиброз (индекс по КТВР ≥7). У пациентов с системным склерозом и интерстициальным поражением легких чаще (р<0,01) заброс кислоты в пищевод, чаще (р<0,01) эпизоды кислотных и выше частота возникновения рефлюксов в проксимальный отдел пищевода (p<0,01) по сравнению с пациентами с системным склерозом без отклонений по КТВР. Отмечена корреляция между легочным фиброзом по HRCT score и частотой эпизодов рефлюксов в дистальный (r[2]=0,637) и проксимальный (r[2]=0,644) отделы пищевода. На основании полученных данных авторы делают cледующее заключение: у пациентов с системным склерозом с интерстициальным поражением легких ГЭРБ протекает тяжелее, у таких пациентов чаще возникают эпизоды рефлюксов и больше частота высоких рефлюксов, достигающих проксимального отдела пищевода [44].
Несмотря на данный ряда исследований, патогенетическая взаимосвязь поражения легких и пищевода и вклад ГЕРБ в развитие легочного фиброза и его влияние на дальнейший прогноз заболевания изучен недостаточно и требуется проведение дальнейших исследований на большей выборке пациентов с гистологическим исследовием биоптата легких.
Заключение
На основании данных обследования у большинства наших пациентов отмечено легкое и умеренно выраженное поражение пищевода: жалобы на изжогу и затруднение глотания пищи соответствовали измененениям пищевода по результатам эзофагогастродуоденоскопии, рентгено-контрастного исследования пищевода и компьютерной томографии высокого разрешения.
Кроме того, со стороны всех пациентов с ГЭРБ отмечены жалобы на затруднение проглатывания пищи, что в сочетании с наличием рефлюкса создает предпосылки к микроаспирации содержимого желудка в легкие и развитию воспалительных реакций с последующим фиброзом.
У пациентов при сочетании ССД и ГЭРБ отмечается более тяжелое поражение легких, что подтвердилось в нашем исследовании как клиническими, так и инструментальными данными.
В связи с этим у пациентов с системной склеродермией необходима ранняя диагностика и начало лечения ГЭРБ, поскольку данное поражение в сочетании с нарушением моторики пищевода в рамках ССД может приводить к более тяжелому легочному поражению.
2. Коган Е.А., Коренев Б.М., Попова Е.Н., Фомин В.В и др. Интерстициальные болезни легких. М., Литтерра. 2007. 416 с.
3. Ананьева Л.П., Теплова Л.В., Лесняк В.Н., Конева О.А., Овсянникова О.Б., Старовойтова М.Н., Десинова О.В. Клиническая оценка проявлений интерстициального поражения легких при системной склеродермии по данным компьютерной томографии высокого разрешения. Научно-практическая ревматология. 2011;2:30–39.
4. Гусева Н.Г. Системная склеродермия: клиника, диагностика, лечение. Российский журнал кожных и венерических болезней. 2002;4:5–15.
5. Каратеев А.Е., Мовсисян М.М., Ананьева Л.П., Раденска-лоповок С.Г. Патология пищевода при системной склеродермии: данные клинико-эндоскопического обследования. Научно-практическая ревматология. 2012;1:54–59.
6. Чучалин А.Г. Клинические рекомендации. Пульмонология. М., ГЭОТАР-Медиа. 2007. 37 с.
7. Гриппи М.А. Патофизиология легких. М., Бином. 2005.
8. Bassotti G., Battaglia E., Debernardi V., Germani U., Quiriconi F., Dughera L., Buonafede G., Puiatti P., Morelli A., Spinozzi F., Mioli P.R., Emanuelli G. Esophageal dysfunction in scleroderma: relationship with disease subsets. Arthritis Rheum. 1997;40:2252–2259.
9. Bouros D., Wells A.U., Nicholson A.G., Colby T.V., Polychronopoulos V., Pantelidis P., Haslam P.L., Vassilakis D.A., Black C.M., du Bois R.M. Histopathologic subsets of fibrosing alveolitis in patients with systemic sclerosis and their relationship to outcome. Am. J. Respir. Crit. Care Med. 2002;165(12):1581–1586.
10. Christmann R.B., Wells A.U., Capelozzi V.L., Silver R.M. Gastroesophageal reflux incites interstitial lung disease in systemic sclerosis: clinical, radiologic, histopathologic, and treatment evidence. Semin. Arthritis Rheum. 2010;40(3):241–249.
11. Clements P., Goldin J., Kleerup E., Furst D.E., Elashoff R.M., Tashkin D.P., Roth M.D. Regional differences in bronchoalveolar lavage and thoracic high-resolution computed tomography results in dyspno patients with systemic sclerosis. Arthr. Rheum. 2004;50:1909–1917.
12. de Souza R.B., Borges C.T., Capelozzi V.L., Parra E.R., Jatene F.B., Kavakama J., Kairalla R.A., Bonfá E. Centrilobular fibrosis: an underrecognized pattern in systemic sclerosis. Respiration. 2009;77(4):389–397.
13. Desai S.R., Veeraraghavan S., Hansell D.M., Nikolakopolou A., Goh N.S., Nicholson A.G., Colby T.V., Denton C.P., Black C.M., du Bois R.M., Wells A.U. CT features of lung disease in patients with systemic sclerosis: comparison with idiopathic pulmonary fibrosis and nonspecific interstitial pneumonia. Radiology. 2004;232(2):560–567.
14. Downing T.E., Sporn T.A., Bollinger R.R., Davis R.D., Parker W., Lin S.S. Pulmonary histopathology in an experimental model of chronic aspiration is independent of acidity. Exp. Biol. Med. (Maywood). 2008;14:1202–1212.
15. Ebert E.C. Esophageal disease in scleroderma. J. Clin. Gastroenterol. 2006;40:769–775.
16. Ebert E.C. Gastric and enteric involvement in progressive systemic sclerosis. J. Clin. Gastroenterol. 2008;42:5–12.
17. Geirsson A.J., Wollheim F.A., Akesson A. Disease severity of 100 patients with systemic sclerosis over a period of 14 years: using a modified Medsger scale. Ann. Rheum. Dis. 2001;60(12):1117–1122.
18. Gilson M., Zerkak D., Wipff J., Dusser D., Dinh-Xuan A.T., Abitbol V., Chaussade S., Legmann P., Kahan A., Allanore Y. Prognostic factors for lung function in systemic sclerosis: prospective study of 105 cases. Eur. Respir J. 2010;35(1):112–117.
19. Goh N.S., Desai S.R., Veeraraghavan S., Hansell D.M., Copley S.J., Maher T.M., Corte T.J., Sander C.R., Ratoff J., Devaraj A., Bozovic G., Denton C.P., Black C.M., du Bois R.M., Wells A.U. Interstitial lung disease in systemic sclerosis: a simple staging system. Am. J. Respir. Crit. Care Med. 2008;177(11):1248–1254.
20. Goldin J.G., Lynch D.A., Strollo D.C., Suh R.D., Schraufnagel D.E., Clements P.J., Elashoff R.M., Furst D.E., Vasunilashorn S., McNitt-Gray M.F., Brown M.S., Roth M.D., Tashkin D.P.; Scleroderma Lung Study Research Group. High-resolution CT scan findings in patients with symptomatic scleroderma-related interstitial lung disease. Chest. 2008;134(2):358–367.
21. Greenwald G.I., Tashkin D.P., Gong H., Simmons M., Duann S., Furst D.E., Clements P. Longitudinal changes in lung function and respiratory symptoms in progressive systemic sclerosis. Prospective study. Am. J. Med. 1987;83(1):83–92.
22. Guttadauria M., Ellman H., Emmanuel G., Kaplan D., Diamond H. Pulmonary function in scleroderma. Arthritis Rheum. 1977;20:1071–1079.
23. Harrison N.K., Myers A.R., Corrin B. et al. Structural features of interstitial lung disease in systemic sclerosis // Am. Rev. Respir. Dis. 1991. 144(3 Pt 1). P. 706–713.
24. Highland K.B., Silver R.M. Clinical aspects of lung involvement: lessons from idiopathic pulmonary fibrosis and the scleroderma lung study. Curr. Rheumatol. 2005;7(2):135–141.
25. Ioannidis J.P., Vlachoyiannopoulos P.G., Haidich A.B., Medsger T.A. Jr, Lucas M., Michet C.J., Kuwana M., Yasuoka H., van den Hoogen F., Te Boome L., van Laar J.M., Verbeet N.L., Matucci-Cerinic M., Georgountzos A., Moutsopoulos H.M. Mortality in systemic sclerosis: an international meta-analysis of individual patient data. Am. J. Med. 2005;118:2–10.
26. Jaffin B.W., Chang P., Spiera H. Fecal incontinence inscleroderma. Clinical features, anorectal manometric findings, and their therapeutic implications. J. Clin. Gastroenterol. 1997;25:513–517.
27. Kaloudi О., Miniati I., Alari S. Interstitial lung disease in systemic sclerosis. Intern. Emerg. Med. 2007;2(4):250–255.
28. Kay L., Jorgensen T., Jensen K.H. The epidemiology ofirritable bowel syndrome in a random population: prevalence, incidence, natural history and risk factors. J. Intern. Med. 1994;236:23–30.
29. Khanna D., Clements P.J., Furst D.E., Tashkin D.P. Current concepts in disease-modifying therapy for systemic sclerosis-associated interstitial lung disease: lessons from clinical trials. Curr. Rheumatol. Rep. 2009;11:111–119.
30. Khanna D., Hays R.D., Park G.S., Braun-Moscovici Y., Mayes M.D., McNearney T.A., Hsu V., Clements P.J., Furst D.E. Development of a preliminary scleroderma gastrointestinal tract 1.0 Quality of Life Instrument. Arthritis Rheum. 2007;57:1280–1286.
31. Kim D.S., Yoo В., Lee J.S., Kim E.K., Lim C.M., Lee S.D., Koh Y., Kim W.S., Kim W.D., Colby T.V., Kitiaichi M. The major histopathologic pattern of pulmonary fibrosis in scleroderma is nonspecific interstitial pneumonia. Sarcoidosis Vasc. Diffuse Lung Dis. 2002;19(2):121–127.
32. Lahcene M., Oumnia N., Matougui N., Boudjella M., Tebaibia A., Touchene B. Esophageal dysmotility is scleroderma: a prospective study of 183 cases. Gastroenterol Clin. Biol. 2009;33:466–469.
33. Marcisz C., Kucharz E.J., Brzezinska-Wcislo L., Kotulska A., Jonderko G. Pulmonary functional abnormalities in asymptomatic patients with systemic sclerosis. Eur. J. Intern. Med. 2003;14(3):162–165.
34. Marie I., Dominique S., Levesque H., Ducrotté P., Denis P., Hellot M.F., Courtois H. Esophageal involvement and pulmonary manifestations in systemic sclerosis. Arthritis Rheum. 2001;45:346–354.
35. McNearney T.A., Reveille J.D., Fischbach M., Friedman A.W., Lisse J.R., Goel N., Tan F.K., Zhou X., Ahn C., Feghali-Bostwick C.A., Fritzler M., Arnett F.C., Mayes M.D. Pulmonary involvement in systemic sclerosis: associations with genetic,serologic, sociodemographic, and behavioral factors. Arthr. Rheum. 2007;57(2):318–326.
36. Morgan С., Knight С., Lunt M., Black C.M., Silman A.J. Predictors of end stage lung disease in a cohort of patients with scleroderma. Ann. Rheum. Dis. 2003;62(2):146–150.
37. Nishimagi E., Tochimoto A., Kawaguchi Y., Satoh T., Kuwana M., Takagi K., Ichida H., Kanno T., Soejima M., Baba S., Kamatani N., Hara M. Characteristics of patients with early systemic sclerosis and severe gastrointestinal tract involvement. J. Rheumatol. 2007;34:2050–2055.
38. Thoua N.M., Bunce C., Brough G., Forbes A., Emmanuel A.V., Denton C.P. Assessment of gastrointestinal symptoms in patients with systemic sclerosis in a UK tertiary referral centre. Rheumatology (Oxford). 2010;49(9):1770–1775.
39. Parra E.R., Otani L.H., de Carvalho E.F., Ab'Saber A., Capelozzi V.L. Systemic sclerosis and idiopathic interstitial pneumonia: histomorphometric differences in lung biopsies. J. Bras. Pneumol. 2009;35(6):529–540.
40. Peters-Golden M., Wise R.A., Schneider P., Hochberg M., Stevens M.B., Wigley F. Clinical and demographic predictors of loss of pulmonary function in systemic sclerosis. Medicine Baltimore. 1984;63(4):221–231.
41. Remy-Jardin M., Remy J., Wallaert B. Pulmonary involvement in progressive systemic sclerosis sequential evaluation with CT, pulmonary tests and broncho-alveolar lavage. Radiology. 1993;188:499–506.
42. Ruangjutipopan S., Kasitanon N., Louthrenoo W., Sukitawut W., Wichainun R. Causes of death and poor survival prognostic factors in thai patients with systemic sclerosis. J. Med. Assoc. Thai. 2002;85(11):1204–1209.
43. Sallam H., McNearney T.A., Chen J.D. Systematic review:pathophysiology and management of gastrointestinaldysmotility in systemic sclerosis (scleroderma). Aliment Pharmacol. Ther. 2006;23:691–712.
44. Savarino E., Bazzica M., Zentilin P., Pohl D., Parodi A., Cittadini G., Negrini S., Indiveri F., Tutuian R., Savarino V., Ghio M. Gastroesophagealreflux and pulmonary fibrosis in scleroderma: a study using pH-impedance monitoring. Am. J. Respir. Crit. Care Med. 2009;179:408–413.

 Все пациенты с ГЭРБ получали терапию блокаторами протонной помпы (омепразол, омез, ультоп, нольпаза). Из них 24 принимали препарат на постоянной основе (средняя продолжительность лечения составила 2 года), 3 – курсами длительностью от 2 месяцев. На момент обследования жалобы на изжогу, несмотря на терапию блокаторами протонной помпы, предъявляли 17 из 27 пациентов (63%). Почти у всех пациентов (26 из 27) присутствовало наличие дисфагии, у всех пациентов с наличием ГЭРБ и у 11 пациентов без ГЭРБ.
Все пациенты с ГЭРБ получали терапию блокаторами протонной помпы (омепразол, омез, ультоп, нольпаза). Из них 24 принимали препарат на постоянной основе (средняя продолжительность лечения составила 2 года), 3 – курсами длительностью от 2 месяцев. На момент обследования жалобы на изжогу, несмотря на терапию блокаторами протонной помпы, предъявляли 17 из 27 пациентов (63%). Почти у всех пациентов (26 из 27) присутствовало наличие дисфагии, у всех пациентов с наличием ГЭРБ и у 11 пациентов без ГЭРБ.

