Введение
Хроническая болезнь почек (ХБП) в последние десятилетия находится в центре внимания не только нефрологов, но и врачей других специальностей. Это связано с ее высокой распространенностью в популяции, достигающей в ряде стран 20%, а также с тем, что дисфункция почек уже на начальных стадиях ухудшает контроль существующих заболеваний, имеет прогрессирующее течение и увеличивает риск сердечно-сосудистых осложнений. К группе высокого риска развития ХБП относятся пациенты с сахарным диабетом (СД), артериальной гипертензией (АГ), первично почечной патологией и лица старшего возраста [1]. В последние годы появились данные о развитии дисфункции почек у больных хронической обструктивной болезнью легких (ХОБЛ). Это объясняется, с одной стороны, накоплением и суммарным действием факторов риска ХБП у данных пациентов, с другой – влиянием на почечную функцию системных проявлений ХОБЛ [2–5].
В настоящее время с целью диагностики ХБП широко используется расчет скорости клубочковой фильтрации (СКФ) на основе сывороточного креатинина. Между тем концентрация креатинина не может служить идеальным маркером функции почек, т.к. зависит от многих причин, в наибольшей степени – от состояния мышечной ткани [6]. Поэтому с учетом высокой частоты развития мышечной дистрофии среди больных ХОБЛ стандартная формула расчета СКФ на основании сывороточного креатинина может быть недостаточно информативной [7]. В связи с этим чрезвычайно актуален поиск альтернативных маркеров, не зависящих от состояния мышечной ткани, с целью своевременной диагностики дисфункции почек у больных ХОБЛ.
Цель нашего исследования – оценка стандартных и альтернативных лабораторных маркеров ХБП в ранней диагностике ХБП у пациентов с ХОБЛ.
Материал и методы
В исследование включены 198 пациентов ГБУЗ ККБ № 2 г. Краснодара с диагнозом ХОБЛ (69,6% мужчин, средний возраст – 65,9±10,8 года, средний стаж болезни – 17,2±2,2 года, 30,3% женщин, средний возраст – 62,1±6,9 года, средний стаж болезни – 8,7±2,1 года) и 28 здоровых добровольцев, сопоставимых по возрасту и полу. Диагноз ХОБЛ установлен в соответствии с рекомендациями GOLD (2014) [8]. Оценку вентиляционной функции проводили на спирографе EasyOne Pro фирмы Ultrasound Spirometry Lab (Швейцария). Пациенты разделены на 4 группы соответственно тяжести ХОБЛ (GOLD, 2014) и 5-я группа – контрольная. В 1-ю группу (GOLD 1) включили 36 пациентов, во 2-ю (GOLD 2) – 54, в 3-ю (GOLD 3) – 66, в 4-ю (GOLD 4) – 42 пациента, в контрольную группу вошли 28 здоровых добровольцев, сопоставимых по полу и возрасту (табл. 1).

Помимо общеклинических исследований всем пациентам проведен расчет СКФ по формуле СКD-EPI: СКФкреат – на основании сывороточного креатинина (2009) и СКФцис – на основании сывороточного цистатина С (2012) [9]. Уровень сывороточного цистатина С определен иммунотурбидиметрическим методом («Сystatin C-FS», DiaSys, Германия), креатинин – на основе реакции Яффе. Все исследования выполнены на автоматическом анализаторе для клинической химии AU640 в централизованной лаборатории ООО «Фрезениус Медикал Кеа Кубань» (главный врач – Л.Ф. Еремеева, зав. лабораторией – С.А. Картавенков). С целью изучения состава тела всем пациентам проведен биоимпедансный анализ (БИА) с помощью прибора АВС-01 «Медасс» (Россия) с расчетом стандартных показателей.
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом ФГБОУ ВО КубГМУ (протокол заседания № 32 от 21.10.2014). До включения в исследование от всех пациентов было получено письменное информированное согласие.
Статистическая обработка проведена методами вариационной статистики с использованием пакета статистической программы Statistica 10,0 for Windows. Статистическая значимость межгрупповых различий количественных переменных определена с помощью дисперсионного анализа. Корреляционный анализ проведен путем расчета коэффициента корреляции Пирсона (r), связь считали достоверной при p<0,05. Для оценки статистической значимости различий двух или нескольких относительных показателей использован критерий χ2. Разница считалась достоверной при достигнутом уровне значимости р<0,05.
Результаты
Средние уровни СКФкреат в группе контроля составили 90,5±9,5 мл/мин/1,73 м2, что было сопоставимо с уровнем СКФкреат у больных ХОБЛ, где этот показатель составил 79,6±5,7 мл/мин/1,73 м2 (табл. 2).
Повышение уровня сывороточного креатинина >110 мкмоль/л наблюдалось у 8,1% больных ХОБЛ, а снижение уровня сывороточного креатинина <62 мкмоль/л – у 11,6%. В группе контроля лиц со сниженным уровнем креатинина не выявлено. При межгрупповом сравнении достоверных различий по среднему уровню креатинина в зависимости от степени тяжести ХОБЛ не обнаружено (p>0,05).
При проведении статистического анализа с использованием линейного коэффициента Пирсона обнаружены средней силы положительные корреляции между ИМТ и уровнем креатинина (r=0,501, p=0,035), а также между уровнем креатинина и величиной ОФВ1 (r=0,484, p=0,015). Обнаружена взаимосвязь между показателями биоимпедансометрии, отражающими состояние тощей массы тел, и креатинином: выявлены достоверные положительные корреляции между уровнем сывороточного креатинина и величиной фазового угла (r=0,263, p=0,045), долей активной клеточной массы (r=0,244, p=0,001), долей скелетно-мышечной массы (r=0,343, p=0,001).
Уровень СКФкреат >90 мл/мин/1,73 м2 выявлен почти у половины больных (47,9%), в т.ч. у 11,1% (22) из них выявлена СКФкреат >120 мл/мин/1,73 м2, соответствующая гиперфильтрации. Незначительное снижение СКФкреат (89–60 мл/мин/1,73 м2) – у 51,0% (101), умеренное снижение СКФкреат (59–45 мл/мин/1,73 м2) – у 1,0% (2).
Таким образом, снижение СКФкреат <60 мл/мин/1,73 м2, ставшее основанием для постановки диагноза ХБП, выявлено только у 1% (2) больных ХОБЛ. Распределение величины СКФкреат в зависимости от степени тяжести ХОБЛ представлено в табл. 3.
Таким образом, при расчете СКФ на основании сывороточного креатинина в группе с крайне тяжелым течением ХОБЛ достоверно чаще встречались пациенты с гиперфильтрацией по сравнению с легкой (χ2=4,032, р=0,053) и среднетяжелой ХОБЛ (χ2=5,441, p=0,028). Нормальный уровень клубочковой фильтрации (119–90 мл/мин/1,73 м2) также достоверно чаще имели пациенты с крайне тяжелым течением по сравнению с легким течением ХОБЛ (χ2=5,539, p=0,023).
Вместе с тем средний уровень сывороточного цистатина С был достоверно выше у больных легкой ХОБЛ (1-я группа) по сравнению с группой контроля (р=0,034) и у пациентов с крайне тяжелой ХОБЛ (4-я группа) по сравнению с больными ХОБЛ легкого течения (р=0,002). Выявлены средней силы положительные корреляции между уровнем цистатина С и количеством баллов по шкале mMRC (r=0,423, р=0,002), между уровнем цистатина С и ОФВ1 (r=0,309, p=0,001), а также между цистатином С и С-реактивным белком (СРБ) (r=+0,360, p=0,001).

Средний уровень СКФцис в группе контроля составил 102,1±10,5 мл/мин/1,73 м2, что достоверно выше аналогичных данных у пациентов с ХОБЛ – 63,5±8,7 мл/мин/1,73 м2 (p=0,015). Расчет СКФцис выявил нормальный уровень СКФцис (>90 мл/мин/1,73 м2) у 12,6% (25) больных ХОБЛ, незначительное снижение СКФцис (89–60 мл/мин/1,73 м2) – у 35,8% (71), умеренное снижение СКФцис (59–45 мл/мин/1,73 м2) – у 34,3% (68), существенное снижение СКФцис (44–30 мл/мин/1,73 м2) – у 12,1% (24), резкое снижение СКФцис (29–15 мл/мин/1,73 м2) – у 5,0% (8). Распределение по величине СКФцис в зависимости от степени тяжести ХОБЛ представлено в табл. 4.
Анализ полученных нами данных показал, что почти половина больных легкой ХОБЛ имеют нормальный уровень СКФцис (41,7%), а большая часть больных ХОБЛ с тяжелым и крайне тяжелым течением имеют снижение СКФцис<60мл/мин/1,73 м2 (90,4%). СКФцис, соответствующая гиперфильтрации, выявлена только у больных легкой ХОБЛ (1-я группа), а выраженное снижение СКФцис (29–15 мл/мин/1,73 м2) – только у пациентов с тяжелым и крайне тяжелым течением ХОБЛ (3-я и 4-я группы). Достоверные различия в частоте снижения СКФцис 89–60 мл/мин/1,73 м2 и СКФцис 59–45 мл/мин/1,73 м2 выявлены между пациентами с легкой и крайне тяжелой ХОБЛ (χ2=8,039, р=0,43 и χ2=9,253; р=0,003 соответственно) и между пациентами с легкой и тяжелой ХОБЛ в том же интервале снижения СКФцис (χ2=6,242, р=0,14). Выявлены достоверные различия в частоте снижения СКФцис в зависимости от частоты обострений ХОБЛ. Так, у пациентов с частыми обострениями ХОБЛ средние уровни СКФцис и частота снижения СКФцис<60 мл/мин/1,73 м2 оказались достоверно выше (χ2=45,74, р=0,314).
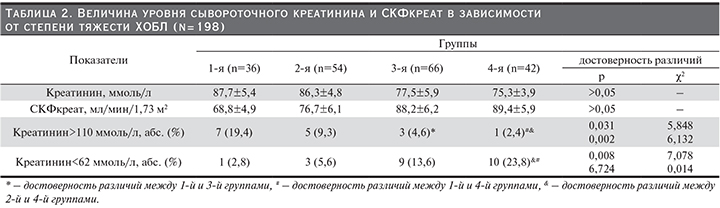
Проведено сравнение данных, полученных при расчете СКФкреат и СКФцис (рис. 1). Установлено, что при расчете СКФ по креатинину частота больных ХОБЛ с нормальным уровнем СКФ (>90 мл/мин/1,73 м2) оказалась достоверно выше, чем по цистатину С (37,1% vs 12,6% соответственно, χ2=52,97, p=0,005). Для группы пациентов со снижением СКФ в интервале 59–45 мл/мин/1,73 м2 получены противоположные результаты – доля пациентов с расчетом СКФ по цистатину С оказалась достоверно выше (34,3 vs 1% соответственно; χ2=48,87, p=0,002). Аналогичные данные получены и при сравнении альтернативного и стандартного методов расчета СКФ в группах СКФ 44–30 мл/мин/1,73 м2 (12,1% по цистатину С vs 0% по креатинину; χ2=28,97, p=0,03) и СКФ 29–15 мл/мин/1,73 м2 (5,1% по цистатину С vs 0% по креатинину; χ2=5,13, p=0,045). Только в группе незначительного снижения СКФ (89–60 мл/мин/1,73 м2) достоверных различий между использованными методами получено не было (51% по креатинину vs 35,8% по цистатину С; χ2=2,95, p>0,05). Частота гиперфильтрации оказалась статистически значимо выше при расчете СКФкреат (χ2=5,13, p<0,05).
В группе здоровых добровольцев достоверных различий между стандартным и альтернативным методами расчета СКФ получено не было – доля пациентов с СКФкреат 89–60 мл/мин/1,73 м2 составила 17,8%, с СКФцис – 14,2% (χ2=0,13, p=0,16).
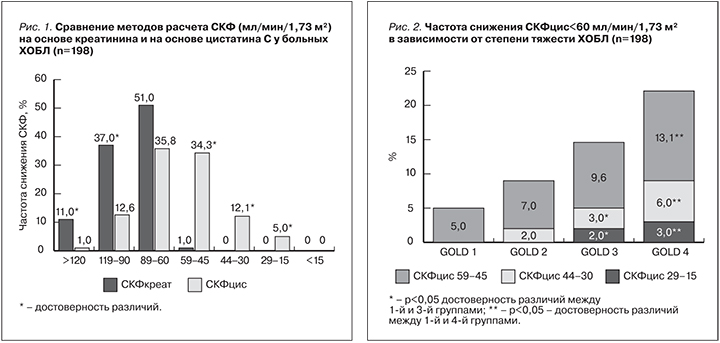
Согласно полученным данным, диагноз ХБП установлен у 50,5% (100) больных ХОБЛ при расчете на основе сывороточной концентрации цистатина С (снижение СКФцис<60 мл/мин/1,73 м2), что статистически значимо выше, чем при расчете СКФ на основе сывороточной концентрации креатинина (1%) (χ2=130,14, p=0,0001). Частота ХБП оказалась достоверно выше у больных ХОБЛ тяжелого и крайне тяжелого течения (GOLD 3, GOLD 4) (χ2=41,12; p=0,03). В этих группах достоверно чаще встречалась ХБП более тяжелых стадий (р<0,05) (рис. 2).
Таким образом, полученные нами данные демонстрируют достоверно более высокую частоту ХБП у пациентов с ХОБЛ при расчете СКФ с использованием цистатина С, чем при использовании креатинина.
Обсуждение
Проведенное нами исследование показало низкую информативность креатинина в диагностике ХБП у больных ХОБЛ. Это демонстрируют высокая частота снижения уровня сывороточного креатинина (11,6%), его тесные корреляции с показателями ИМТ и биоимпедансометрии, отражающими состояние мышечной ткани, а также сопоставимые средние уровни СКФкреат между группой контроля и основной группой. Низкая диагностическая информативность креатинина объяснима тем, что он, по сути, является побочным продуктом мышечного метаболизма, полностью зависимым от объема мышечной ткани, кроме того, способен выводиться за счет внепочечных механизмов – канальцевой секреции и элиминации в кишечнике [10]. Известно, что под влиянием системного воспаления у больных ХОБЛ часто развивается мышечная дисфункция вплоть до «легочной кахексии» [7, 8], что приводит к гиподиагностике ХБП у данной группы пациентов при использовании стандартных методов расчета СКФ по креатинину. В связи с этим, по нашему мнению, у больных ХОБЛ оптимален расчет СКФ на основе уровня цистатина С, представляющего собой низкомолекулярный белок, свободно фильтрующийся сквозь мембрану клубочков, не подверженный канальцевой секреции и метаболизирующийся исключительно в почках [11]. Кроме того, от креатинина как маркера почечной дисфункции цистатин С отличает постоянная скорость синтеза и выведения, зависимая только от ренальных функций без влияния антропометрических и возрастных показателей [11]. Полученные данные о частоте снижения СКФцис<60 мл/мин/1,73 м2, составившие 50,5%, сопоставимы с результатами аналогичного исследования, проведенного в 2015 г. Т. Yoshizawa и соавт., включившего 108 пациентов с ХОБЛ, где аналогичный показатель на основании СКФцис составил 53% [3]. В этом исследовании также была показана низкая информативность применения креатинина для диагностики ХБП у больных ХОБЛ, однако не было проведено анализа влияния частоты обострений на развитие дисфункции почек у данной группы пациентов. В исследовании R.A. Incalzi и соавт. частота ХБП у больных ХОБЛ составила 22,2%, а также, как и в нашем исследовании, указана высокая доля «скрытой ХБП» у больных ХОБЛ, т.е. лиц с нормальными уровнями креатинина, но сниженной СКФкреат [12]. Это подтверждает роль дисфункции мышц, развивающейся под действием системных появлений ХОБЛ, вследствие чего уровень креатинина у больных ХОБЛ снижен [6].
На относительную пригодность креатинина для диагностики ХБП указывают и результаты других исследований, однако разница в полученных данных оказывается не столь значительной, как при ХОБЛ. Так, в исследовании Н.Ю. Боровковой и соавт. с участием больных ХСН I–IV ФК показана достоверно более высокая диагностическая значимость расчета СКФ по цистатину С по сравнению с таковым СКФкреат [13]. Согласно данным C.-W. Tsai и соавт., среди 778 больных СД частота снижения функции почек составила 16,5% при использовании СКФкреат и 22,0% – при СКФцист [14].
В нашем исследовании обнаружено влияние обострений ХОБЛ на частоту и тяжесть дисфункции почек. По нашему мнению, это обусловлено повышением уровня воспалительных медиаторов в сочетании с ухудшением респираторных показателей, усугублением дисбаланса вентиляционно-перфузионных соотношений, приводящих к выраженной гипоксемии и усилению системных проявлений при обострении ХОБЛ [15]. Очевидно, что повторяющиеся обострения являются крайне неблагоприятными не только относительно прогноза ХОБЛ, но и для развития почечной дисфункции.
Таким образом, в нашем исследовании обнаружена гиподиагностика ХБП у больных ХОБЛ при использовании стандартных методов расчета СКФ. Вместе с тем выявлена высокая частота ХБП у данной группы пациентов, взаимосвязанная со степенью тяжести ХОБЛ, что позволяет рассматривать больных ХОБЛ как группу риска развития дисфункции почек.
Выводы
- Применение формул с использованием сывороточного креатинина приводит к гиподиагностике ХБП у больных ХОБЛ, что обусловлено зависимостью уровня креатинина от состояния мышечной ткани.
- Выявлена высокая частота ХБП у больных ХОБЛ, достигающая 51,4% при расчете СКФ по цистатину С, что достоверно выше, чем при расчете СКФ по креатинину, – 1,0% (χ2=130,14, p=0,0001).
- Расчет СКФ на основе сывороточного цистатина С является предпочтительным для больных ХОБЛ, т.к. цистатин С не зависит от состояния мышечной ткани и антропометрических показателей.
- Обнаружено влияние обострений на частоту развития и степень снижения СКФ у больных ХОБЛ.
Авторы выражают свою признательность за помощь в проведении специализированных лабораторных исследований ООО «Фрезениус Медикал Кеа Кубань» в лице главного врача Л.Ф. Еремеевой и руководителя централизованной лаборатории С.А. Картавенкова.



