Введение
Хроническая болезнь почек (ХБП) в большинстве случаев характеризуется прогрессирующим снижением почечной функции, которое, с одной стороны, связано с нарастающей коморбидностью и рисками смерти на додиализном этапе, с другой – ведет к терминальной почечной недостаточности, требующей заместительной почечной терапии. Клинические рекомендации KDOQI (2002) определили темп снижения СКФ как медленный (≤4 мл/мин/1,73 м2 за год) или быстрый (>4 мл/мин/1,73 м2 за год) [1]; это разделение использовано во многих исследованиях вплоть до самых последних [2], однако остается во многом произвольным. В различных популяциях и при разной методологии набора пациентов в исследования параметры прогрессирования и связанные с ними риски различны. Кроме того, во многих исследованиях темпы снижения СКФ оценивают исходя из предположения о их постоянстве, хотя эти величины вполне могут меняться, а в существенной части случаев практически не отличаться от нуля, в частности, нередко у пожилых пациентов с СКФ<45 мл/мин [3], что побуждает ряд исследователей все настойчивее говорить о введении коррекции по возрасту в определение границы «сниженной» СКФ, которая в настоящее время для всех возрастов составляет 60 мл/мин/1,73 м2, что приводит к возможному недовыявлению ХБП у молодых и гипердиагностике у пожилых [4].
Методы
Санкт-Петербургский регистр пациентов с ХБП в электронной форме ведется с 2003 г. после переноса картотеки пациентов с бумажных носителей, что позволило организовать регулярное наблюдение за динамикой почечной функции и другими клинико-лабораторными параметрами [5]. Выявленные пациенты с ХБП-3А при стабильном течении приглашаются на визиты ежегодно (и чаще при необходимости, ХБП-3Б – не реже 1 раза в 6 месяцев, ХБП-4 – 1 раз в 3–4 месяца и чаще). При дальнейшем снижении функции частота рекомендуемых визитов возрастает до двух и ежемесячных.
Скорость снижения СКФ рассчитывается для пациента по всем имеющимся временным точкам регрессионным методом за весь период наблюдения или за выбранную его часть. Таким образом, динамика СКФ отражает усредненное изменение за избранный период, а не разницу между значениями СКФ в крайних временных точках и не зависит от различий в интервалах времени между визитами. Для оценки динамики СКФ использованы данные наблюдения у пациентов с числом визитов не менее пяти за избранный период времени. При снижении числа визитов до 3–4 оценка динамики СКФ давала для все большей части пациентов неприемлемо высокую ошибку оценки коэффициента регресса (тренда СКФ); при наличии только двух измерений оценка доверительного интервала невозможна, а при единственном визите с необходимым набором данных скорость снижения СКФ остается неизвестной. До 2011 г. использовалась формула MDRD, с 2012 г. СКФ рассчитывалась (и была ретроспективно пересчитана) по CKD-EPI [6]. Все биохимические анализы и анализы крови проводились в одной лаборатории.
Статистический анализ
Данные представлены как среднее и стандартное отклонения для нормального распределения и как медиана и интерквартильный размах для распределения, отличного от нормального. Сравнение долей проводилось при помощи критерия хи-квадрат. В корреляционном анализе при нормальном распределении величин оценивали коэффициент Пирсона, при ином распределении использовали метод ранговой корреляции Спирмана. Значимость регресса оценивали по критерию Фишера и по коэффициентам детерминации. Натуральные коэффициенты регресса приведены с указанием 95% доверительного интервала (95% ДИ). Значимыми считались различия при p<0,05. Статистическая обработка выполнена с использованием пакета прикладных статистических программ «SPSS Statistics 20.0.» («SPSS Inc: An IBM Company», США).
Результаты
Из 1029 пациентов, начавших диализ в 2012–2014 гг., 481 (47%) достаточно продолжительное время до старта диализа наблюдался в нефроцентре: имели не менее пяти визитов (медиана – 10; 8÷17) за срок до трех лет (данные за период наблюдения более трех лет до начала диализа не учитывались).

На рис. (А) представлено распределение пациентов по скоростям снижения рСКФ (в расчете за год) за период до трех лет перед началом диализа. Анализ индивидуальных кривых снижения рСКФ позволил выделить три «сценария» снижения рСКФ в трехлетний преддиализный период. Три четверти пациентов характеризовались относительно низкой исходной рСКФ, соответствовавшей ХБП-4 (3Б) в стартовой точке наблюдения и медленным ее снижением. Пятая часть пациентов характеризовались быстрым снижением от ХБП-3Б (4). У небольшого числа пациентов функция почек на протяжении длительного времени сохранялась практически неизменной на относительно высоком уровне (ХБП-3А), а за год до начала диализа (или меньший период) наблюдалось ускоренное снижение рСКФ. К потенциально перенесенному (но не зафиксированному) эпизоду острого повреждения почек напрямую это изменение динамики почечной функции отнести нельзя, поскольку постепенное, хоть и быстрое, снижение фиксировалось, как правило, не менее чем по пяти точкам. Таким образом, пациенты с ускоренным (резко ускорившимся) снижением функции выделялись по признаку смены темпов прогрессирования. Выбор оптимальной границы между медленным и быстрым прогрессированием осуществлен анализом результатов повторных расчетов и использованием в качестве границы величин 3… 8 мл/мин/1,73 м2 за год; критерием выбора границы была минимизация разброса значений в подгруппах (интерквартильный размах – ИР) при максимизации разницы медиан (что вместе увеличивало статистическую значимость различий между ними). Результаты разделения пациентов по оптимальной границе 5 мл/мин/1,73 м2 представлены в табл 1.
На рис. представлены изменения индивидуальных значений рСКФ во времени наблюдения (обратный отсчет от даты старта диализа в месяцах). Для группы медленного темпа снижения рСКФ на графике (Б) представлен каждый случайно выбранный третий пациент в связи с бóльшим числом наблюдений (n=351), затрудняющих представление данных на графике; для группы быстрого прогрессирования (n=106) представлен каждый второй случай (В). Линейный регресс наилучшим образом описывал снижение рСКФ для медленного и быстрого прогрессирования. В немногочисленной группе ускоренного течения (n=24) общая динамика рСКФ за период наблюдения распадается на два тренда в разные периоды времени: практически отсутствует временной тренд для периода, отдаленного более чем на 12 месяцев от старта диализа; при этом тренд последнего года перед диализом характеризуется очень быстрым снижением рСКФ. Стандартный протокол наблюдения не выявил определенных событий (состояний), которые безусловно могли бы вызывать ускорение снижения функции почек.
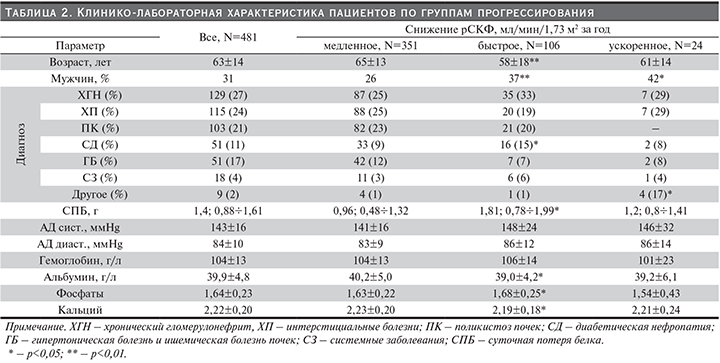
В табл. 2 представлено сравнение характеристик пациентов по выделенным подгруппам. В расчете средних величин (M±SD) или интерквартильного размаха (ИР) (медиана; Q1÷Q3) использованы все значения за интервал за исключением последнего, полученного непосредственно перед стартом диализа.
Группы медленного и быстрого снижения рСКФ не различались по структуре диагнозов в целом (р=0,075 в χ2-тесте), равно как и в сравнении по каждому диагноз (за исключением диабетической нефропатии, частота которой была выше при быстром прогрессировании, чем при медленном). Различия в величинах среднего систолического и среднего диастолического АД (равно как и доля пациентов с артериальной гипертензией и [не представлено]) в указанных группах не достигли статистической значимости (р≈0,09). Средний уровень альбумина был ниже в группе быстрого прогрессирования (р=0,047), уровни гемоглобина – не различались. Группа ускоренного прогрессирования, возможно, разнородна: разброс значений ряда параметров существенно превышает таковой для других групп, а структура зафиксированных диагнозов существенно отличается от остальной группы.
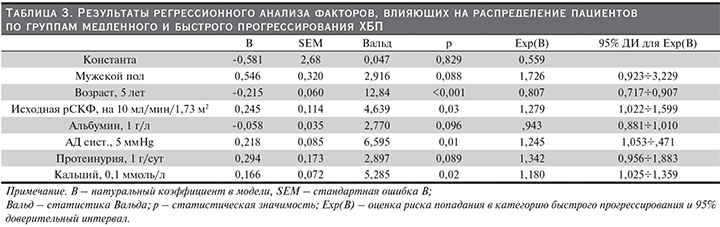
В табл. 3 представлены результаты логистического регрессионного анализа связи демографических и клинико-лабораторных данных с развитием снижения рСКФ по «быстрому» варианту (в альтернативу развития прогрессирования по «медленному» варианту»). Помимо факторов, представленных в табл. 3, в исходную модель были включены также средние за период наблюдения уровни диастолического АД, гемоглобина, фосфатов, которые при пошаговом исключении по методу Вальда не вошли в окончательную модель. Критерием пошагового отбора при включении был уровень р=0,05, при исключении – 0,10. Группа пациентов с «ускоренным» вариантом не включена в анализ, поскольку небольшая выборка не позволила построить устойчивую модель.
В соответствии с поученной моделью шансы на прогрессирование по «быстрому» варианту повышает мужской пол (на 73%), меньший – на каждые 5 лет возраст (на 19%), большая – на 10 мл/мин/1,73 м2 исходная рСКФ (на 28%), более высокое на 5 ммHg систолическое АД (на 25%) и более высокий (на 0,1 ммоль/л) уровень кальциемии (на 18%); не достигает статистической значимости влияние уровня альбумина в крови – тенденция к снижению шансов на быстрое прогрессирование на 5% на каждое повышение альбумина на 1 г/л (р=0,096) – и уровень протеинурии – рост шансов на 34% на аждое увеличение протеинурии на 1 г/сут (р=0,089).
В табл. 4 приведены результаты классификации случаев быстрого и медленного прогрессирования в соответствии с построенной моделью.
Таким образом, полученная модель при относительно высокой эффективности недовыявляет пациентов с риском развития «быстрого» прогрессирования.
Обсуждение
Изучение прогрессирования ХБП ведется уже много лет, но и в 2017 г. исследователи признают, что его характер и темпы недостаточно изучены и плохо контролируются в неотобранных популяциях в реальной практике, хотя вмешательства на этих этапах способны снизить частоту госпитализаций, уменьшить расходы на лечение, улучшить исходы и замедлить прогрессирование заболевания [7, 8, 9]. Только самые крупные эпидемиологические исследования ориентируются в оценке прогрессирования на смену стадий ХБП, например, по изменению кодов регистрации страховых случаев по МКБ10: N18.1÷N18.5 для ХБП-С1÷ХБП-С5 соответственно [7]. Суррогатной оценкой нестабильности почечной функции в некоторых исследованиях является стандартное отклонение или коэффициент вариации нескольких значений СКФ, которые также обнаруживают связь с неблагоприятными исходами [10, 11]. Для оценки темпа прогрессирования ХБП в клинических наблюдениях большинство авторов настаивают на использовании не менее 5 точек измерения/расчета СКФ в регрессионной модели [10,12]. При меньшем числе точек оценка динамики СКФ становится ненадежной или невозможной. Это несколько ограничивает исследуемую группу, но дает возможность находить связи темпов прогрессирования ХБП с потенциально модифицируемыми факторами. Поиск таких факторов в разных популяциях и условиях приводит исследователей к весьма разнообразным выводам, что ярко продемонстрировал систематический обзор 2016 г., по результатам которого в мета-анализе выявлено всего два согласующихся по включенным исследованиям фактора: мужской пол (ОР=1,37; 95% ДИ – 1,17÷1,62) и значимая протеинурия (ОР=1,64; 1,01÷2,66), и даже фактор наличия диабета не достиг статистической значимости (ОР=1,16; 0,98÷1,38) [13].
Ранее такие связи были рассмотрены нами для темпа снижения рСКФ как непрерывной величины: по материалам СПб. городского регистра пациентов с ХБП темп снижения составил -3,3±8,1 мл/мин/1,73 м2 за год; множественный регрессионный анализ выявил следующие факторы, связанные с большими ее значениями:
- мужской пол;
- меньшая (на 10 мл/мин) исходная скорость рСКФ, примерно на 25% большая скорость снижения;
- более высокий (на 0,1 ммоль/л) уровень фосфатов;
- более низкий (на 2 г/л) уровень альбумина;
- более низкий (на 5 г/л) уровень гемоглобина;
- более высокий (на 0,2 ммоль/л) уровень мочевой кислоты;
- более высокая (на 0,3 г/л) протеинурия, примерно на 10% большая скорость снижения [5].
В настоящем исследовании мы оценили влияние ряда факторов (в т.ч. потенциально модифицируемых) на темп снижения рСКФ как на категориальную величину, попытавшись выделить преимущественные варианты траекторий снижения рСКФ на основании проспективного наблюдения за пациентами, начавшими в последующем диализ. Срок такого наблюдения был ограничен тремя годами до начала диализа.
Анализ траектории изменения клинически важных параметров/синдромов находит ширящееся применение в различных областях медицины для выделения подтипов патологии [14, 15], но в нефрологии таких исследований немного, хотя исследование типов снижения почечной функции может оказаться полезным для определения нефропротективной стратегии и прогноза.

Первый и до настоящего времени наиболее детальный анализ траекторий снижения рСКФ опубликован O'Hare AM et al. в 2012 г. [16] и охватывает двухлетнее наблюдение пациентов из США, начавших диализ в 2001–2003 гг. (n=5606 пациентов, имеющих не менее двух определений измерений креатинина сыворотки; медиана числа амбулаторных определений – 12 (7÷18)). Статистическое моделирование [17] групповых траекторий снижения позволило выявить 4 типичных варианта: непрерывное медленное снижение (63% пациентов; медиана темпа снижения – 7 мл/мин за год), прогрессирующее снижение (25%; 16 мл/мин за год), ускоренное снижение (9%; 32 мл/мин за год) и катастрофическое снижение ((3%; 48 мл/мин за год). Очевидно, эта большая неотобранная группа представляет совершенно отличную популяцию от нашей – с медианой темпа снижения 4 мл/мин за год (ИР -6,2÷-2,6).
Действительно, средний возраст составлял 66 лет (по сравнению с нашей группой – 63 года), доля пациентов с сахарным диабетом – 50% (11% в нашей группе) при еще больших различиях в долях пациентов с сосудистой патологией, активными опухолями и в расе. С более медленным прогрессированием в работе O'Hare AM et al. были связаны старший возраст, наличие сосудистой патологии, сахарный диабет и гипертензия в качестве причины тХПН и более высокая протеинурия.
На аналогичной популяции пациентов, вступивших в ХБП-С3 (или выявленных на этой стадии), в пятилетнем наблюдении были оценены траектории достижения ХБП-С4 (финальная рСКФ – 24±4 мл/мин/1,73 м2: 72% демонстрировали медленное снижение (-2,45 мл/мин/1,73 м2 за год; ИР – -3,89÷-1,16) от относительно низких величин (37±9 мл/мин/1,73 м2), 18% – быстрое снижение (-8,6 мл/мин/1,73 м2 за год; ИР – -11,3÷ -26,7), 9% – стабильную функцию с последующим быстрым снижением (от -0,4 мл/мин/1,73 м2 за год в 1÷3-й годы до -8,0 и -21,4 мл/мин/1,73 м2 за год в 4-5-й годы). Первая группа выделялась более старшим возрастом и меньшей (хотя и очень высокой – 62%) частотой диабета и сердечно-сосудистой коморбидностью, а также меньшей, но также очень высокой частотой эпизодов ОПП (50% v. 65 и 77% во второй и третей группах) [18].
В европейской популяции (исследование NECOSAD) оценка темпов снижения СКФ (расчетной и измеренной) проведена в полугодовом наблюдении перед началом диализа в группе 197 пациентов, из которых 39% демонстрировали медленное снижение (<4 мл/мин/1,73 м2 за год), а 61% – более высокие темпы. Группы не различались по демографическим показателям, частоте сахарного диабета (15%) и гломерулонефрита (13%), но реноваскулярная патология встречалась чаще при быстром прогрессировании (21% v. 4%) [2].
Наблюдательное исследование среди 364 пациентов с диабетом I типа (достигших потребности в диализе) показало, что, хотя диапазон скоростей снижения СКФ широко варьировался (от -72 до -2 мл/мин/1,73 м2 за год), 87% демонстрируют постоянную скорость на протяжении периода наблюдения и только 6 и 7% пациентов характеризуются ускорением или замедлением скорости снижения [12]. Дополнительное разнообразие в модели снижения СКФ вносят эпизоды ОПП, которые в долгосрочной перспективе могут в широком диапазоне влиять на функцию почки от незаметных последствий до синдрома внезапного начала тХПН (SORO-ESRD). Анализ траекторий как в режиме on-line, так и ретроспективно открывает дополнительный взгляд в диагностике и прогнозе [19].
В рамках проведения РКИ AASK индивидуальные траектории изменения рСКФ у 846 пациентов на протяжении двух лет использованы для оценки вероятности хода кривой по той или иной траектории; 42% пациентов с вероятностью 0,9 относились к группе с нелинейной траекторией или с продолжительными периодами без прогрессирования, 9% пациентов имели длительные периоды стабильной или увеличивающейся рСКФ с последующими/предыдущими периодами быстрого снижения [20].
Аналогичные данные представлены Hu B. et al.: помимо все более широко признаваемого существования «прогрессоров и «непрогрессоров», очевидно, существуют и «импруверы», демонстрирующие улучшение функции почек на достаточно продолжительном периоде, по крайней мере при гипертензии [21].

Улучшение функции не всегда позитивно по прогнозу и может быть связано с повышенными рисками последующей летальности [22]. В большой (более 200 тыс. пациентов) базе данных Y. Xie et al. [23] выделили 20% пациентов с достаточно продолжительными периодами улучшения функции, при этом высокая альбуминурия повышала шансы на такую динамику рСКФ. Авторы выделили четыре типа исходов периодов улучшения функции, табл. 5.
Пока неясно, что именно может способствовать изменению траектории снижения СКФ. Наиболее вероятной представляется следующая последовательность событий. «Точкой невозврата» скорее всего является эпизод (может быть, серия эпизодов) ОПП преренального генеза. В качестве клинического примера можно привести развитие относительной гиповолемии (возможно, в сочетании с относительной артериальной гипотензией) у пациента, который принимает антигипертензивные препараты и диуретики. Стиль жизни городского жителя предполагает определенную нестабильность: утром не успел позавтракать, вспотел, когда пробежался на остановку общественного транспорта (и увеличение частоты дыхательных движений при этом не нужно сбрасывать со счетов), днем на работе поел всухомятку, вечером старался не употреблять много жидкости (совет врача, боязнь отечности лица утром и т.п.).
В результате концентрация креатинина сыворотки крови увеличилась на 44 мкмоль/л. С точки зрения классификации – это ОПП I стадии. Но ведь об этом никто не знает – ни больной, ни участковый терапевт, ни нефролог. Соответственно, характер терапии не изменяется, доза диуретиков остается прежней – и патологический круг замыкается.
Поскольку траектории снижения СКФ точкой отсчета имеют ХБП С3-стадии, можно предполагать, что изложенный выше сценарий наиболее характерен для пациентов со сниженным почечным резервом [24]. Однако, для того чтобы попытаться изменить траекторию снижения СКФ, проверять наличие почечного резерва необходимо на предыдущей стадии – ХБП-С2. Разумеется, проверить такую гипотезу трудно даже чисто технически. В качестве первого шага в этом направлении представляется целесообразным снабдить все кабинеты нефролога (а тем более нефрологические отделения стационаров) напольными весами с функцией расчета общего объема воды в организме. Далее возможно проведение скрининга для уточнения разного рода погрешностей с контролем адекватности соблюдения водного режима.
Таким образом, хотя темпы снижения СКФ могут существенно влиять на риски потребности в ЗПТ [25] и летальность [26] (что побуждает некоторых исследователей предлагать дополнить классификацию ХБП этим признаком), траектории снижения СКФ и – особенно – потенциально модифицируемые факторы, способные на нее влиять, остаются малоизученными. Основное заболевание не всегда существенным образом влияет на темпы снижения, а более молодой возраст, связанный с большими темпами, указывает на необходимость поиска дополнительных факторов; требуется определить место ОПП в складывающейся картине. Основные исследования проведены на резко отличающейся от российской популяции пациентов с ХБП.
Заключение
В 2017 г. концепции ХБП официально исполняется 15 лет. К сожалению, в РФ много времени ушло на малопродуктивные споры о том, принимать ее или нет. Сожаление вызвано не самими спорами, а тем, что так и не удалось организовать доказательное многоцентровое исследование с достаточно большим числом пациентов. Поэтому, как и раньше, приходится ссылаться на зарубежные работы. В данной статье впервые в нашей стране предпринята попытка дальнейшего развития наших представлений о клиническом течении ХБП при универсальной для постановки диагноза величине СКФ. Проанализирован большой фактический материал. Ограничения исследования перечислены ниже. Мы надеемся, что они не оказали фатального влияния на сделанные предположения и выводы.
Ограничением исследования является характер проведенного отбора пациентов: в исследование включены только пациенты, достигшие после существенного срока наблюдения потребности в заместительной почечной терапии, но не включены пациенты, умершие на стадии ХБП, не требовавшей диализа, – возможно, относящиеся к группе с иными рисками неблагоприятных исходов и с другими траекториями снижения рСКФ. Поскольку критерием включения в исследование был старт диализа в конце наблюдения, из исследования тем самым были исключены пациенты, не демонстрировавшие снижения функции почек («нон-прогрессоры»), а также демонстрировавшие на протяжении длительного времени медленное, но стабильное улучшение функции («импруверы»). Кроме того, только около половины пациентов начинали диализ после длительного наблюдения у нефролога; остальные пациенты (начавшие диализ экстренно или без предшествовавшего наблюдения в нефроцентре), возможно, характеризовались иными траекториями снижения СКФ. После дополнительного сбора информации в последующем анализе планируется расширить распространенность выводов на большую часть популяции преддиализных пациентов.



