Как известно, системные васкулиты (СВ) – это группа заболеваний, главной морфологической особенностью которых является воспаление сосудистой стенки. АНЦА (антинейтрофильные цитоплазматические антитела)-ассоциированные васкулиты (АВ) относили к достаточно редким заболеваниям по отношению к другим нозологическим формам, однако, по данным эпидемиологических исследований, за последние десятилетия в мире отмечена тенденция к увеличению распространенности АНЦА-АВ, что, впрочем, может быть связано с улучшением диагностики этих заболеваний.
СВ, ассоциированные с АНЦА, поражают сосуды мелкого и среднего калибров с развитием некротизирующего васкулита и характеризуются отсутствием или наличием небольшого количества отложений иммунных депозитов, потреблением комплемента (малоиммунные – pauci-иммунный васкулит) [1].
При этих заболеваниях определяется гиперпродукция (АНЦА) со специфичностью к МРО или PR-3. Некоторое время назад найден еще одни тип аутоантител, направленных против лизосомального мембранного белка-2 (anti-LAMP-2), выявляемого у anti-PR3- и anti-MPO-позитивных пациентов с активным васкулитом. Аnti-LAMP-2 вызывает апоптоз эндотелиальных клеток микрососудистого русла и малоиммунный некротизирующий гломерулонефрит [2, 3].
По мнению ведущих специалистов, пусковым моментом могут быть перенесенные вирусные и бактериальные инфекции, иммунная гиперчувствительность к некоторым лекарственным препаратам: антибактериальным, противовирусным, ингибиторам ангиотензинпревращающего фермента, аминазину и др. Установлены специфичные иммуногенетические маркеры отдельных форм васкулитов [4, 5]. Так, например, к иммуногенетическим маркерам гранулематоза Вегенера относятся антигены HLA B7, B8, DR2, DQW7. Аортоартериит Такаясу возникает у людей с разновидностью HLA DPB1 типа 0901, но не встречается, если HLA DPB1 относится к разновидности 0405 [6].
Наряду с разработками и рекомендациями, опубликованными в прежние годы [7–13] международной группой экспертов – членов Европейской антиревматической лиги EULAR (European League Against Rheumatism), Европейской ассоциации по изучению болезней почек ERA-EDTA (European Renal Association – European Dialysisand Transplant Association) и Европейским обществом изучения васкулитов EUVAS (European Vasculitis Society), проводилась огромная работа, в итоге которой были согласованы и в начале 2016 г. опубликованы новые рекомендации по диагностике и лечению СВ, ассоциированных с АНЦА [14, 15], к которым относят гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА).
Таким образом, согласно новой классификации, привычный гранулематоз Вегенера принято называть ГПА, который, по мнению ведущих специалистов, является наиболее распространенной нозологической формой среди системных АНЦА-васкулитов. Распространенность ГПА на 1 млн населения – 8,5 (2±12), средний возраст начала заболевания – 45 (1–76) лет [12, 16–18].
Морфологически при ГПА полиангиит сопровождается полиморфно-клеточной гранулематозной воспалительной реакцией. Такая гранулематозная ткань помимо скоплений нейтрофилов, окруженных антиген-презентирующими клетками, макрофагами, многоядерными гигантскими клетками, CD4+CD28-эффекторнымми T-клетками памяти Th1-типа, Т-клетками, секретирующими интерлейкин-17 (ИЛ-17), гистиоцитами и эозинофилами, содержит фокусы аутоантиген-специфичных CD20 В-лимфоцитов и плазматических клеток, способных продуцировать АНЦА. Кроме того, В-клетки служат источником цитокинов (ИЛ-6, ИЛ-10), фактора некроза опухоли α, проявляют свойства антиген-презентирующих клеток, могут дифференцироваться в длительно живущие клетки памяти [19–25]. Как указывалось выше, Т-клетки служат источником разнообразных цитокинов, играющих ключевую роль на всех этапах реализации сложных механизмов АНЦА-ассоциированного сосудистого повреждения. Функциональный дефицит T-регуляторных клеток лежит в основе хронического аутоиммунного воспаления при ассоциированных васкулитах (АНЦА-СВ) [19].
Отличительный лабораторный признак ГПА – наличие АНЦА в сыворотке крови, причем более характерно выявление антител к PR-3, хотя эти антитела определяются не у всех пациентов. Хорошо известно, что АНЦА, являясь важным диагностическим маркером СВ, имеют невысокую ценность для мониторирования активности заболевания, но могут определяться в сыворотке крови в фазе полной клинической ремиссии и не определяться при рецидиве заболевания, даже несмотря на высокую активность васкулита, а также могут быть выявлены и при других заболеваниях [26, 27]. Кроме того, для ГПА характерна двойственность воспалительных реакций: некротизирующий васкулит, с одной стороны, и своеобразная гранулематозная воспалительная реакция в органах респираторного тракта, с другой, с различной степенью выраженности в разных органах и системах организма и своеобразием у каждого пациента. По данным литературы, поражение почек при ГПА отмечается в 65–80% случаев [17]. Таким образом, для гранулематоза с полиангиитом (Вегенера) в основном характерно некротизирующее гранулематозное воспаление с вовлечением верхних и нижних дыхательных путей и некротизирующий васкулит преимущественно сосудов мелкого и среднего калибров (капилляров, венул, артериол, артерий и вен). Часто развивается некротизирующий гломерулонефрит.
Для расчета клинической активности АНЦА-СВ в баллах предложен Бирмингемский индекс активности васкулита BVAS (Birmingham Vasculitis Activity Score). В зависимости от локализации поражения признаки заболевания разделены на 9 групп, при расчете индекса активности суммируются максимальные значения баллов, полученных в каждой группе (суммарный индекс не превышает 63 балла). При оценке активности принимают во внимание обусловленные васкулитом симптомы, имеющиеся на момент осмотра, а также появившиеся или прогрессировавшие в течение последнего месяца [28].
Индекс VDI (Vasculitis Damage Index) отображает наличие у больного признаков необратимых изменений в 11 системах органов, обусловленных воспалительным процессом в сосудах, лечением васкулита или возникшими с момента дебюта повреждениями, не связанными с васкулитом. В динамике индекс VDI может оставаться на прежнем уровне или увеличиваться, но никогда не уменьшается [29–31]. В стандартную терапию, которую проводят профильные специалисты, входят глюкокортикостероиды (ГКС) и цитостатики [32].
С учетом иммуносупрессивного действия назначаемых препаратов имеется высокий риск инфекционных осложнений, миелотоксичность, онкогенность. В связи с этим в настоящее время проводится и альтернативный метод лечения больных СВ, предложенный с 2011 г. в Европе, а в РФ с 2013 г. применяется генно-инженерный биологический препарат (ГИБП) ритуксимаб (RTX), который считают более безопасным в плане развития побочных эффектов. RTX оказывает более селективное действие, специфически связываясь с трансмембранным антигеном CD 20, который локализуется на поверхности B-клеток и не действует на стволовые клетки из-за отсутствия на них антигена [33–35].
Кроме стандартной терапии цитостатиками и ГКС при развитии повреждения почек, по показаниям, для проведения процедуры гемодиализа (ГД) пациентов направляют в отделение ГД, после окончания которого вновь переводят в профильное отделение для дальнейшего лечения.
Ряд пациентов, проходящих лечение в профильных отделениях, иногда переводили в отделение реанимации по согласованию с нефрологами для проведения однократного сеанса очищения плазмы (КПФ – каскадный плазмоферез), пациенты возвращались в отделения либо вечером того же дня, либо на следующие сутки.
Считают, что склонность к рецидивам после проведения индукционной терапии в виде умеренного и тяжелого обострения в первую очередь свойственна ГПА. Возможен и рефрактерный вариант течения ГПА, проявляющийся отсутствием обратного развития клинических проявлений заболевания или увеличением клинической активности, несмотря на проводимую в течение 6 недель стандартную патогенетическую терапию циклофосфаном (ЦФ) и ГКС или ГИБП в сочетании с ГКС [36, 37].
Здесь следует отметить, что при рефрактерном течении и прогрессировании заболевания возможно сочетанное использование двух ГИБП, RTX и тоцилизумаба, что может значительно улучшить результаты лечения [38].
В случае значительного ухудшения состояния пациенты для дальнейшего лечения переводятся в отделения интенсивной терапии или отделения реанимации (ОРИТ), где им проводится комплексная патогенетическая терапии, в разработке которой используется полидисциплинарный подход. Поскольку в профильных отделениях очищения плазмы не проводилось, целью нашего исследования было определение показаний к проведению плазмоочищения после перевода пациентов в тяжелом состоянии из отделений нефрологии и без стартовой патогенетической терапии пациентов, сразу поступивших в ОРИТ.
Материал и методы
За 10 лет были пролечены 516 пациентов с гранулематозом. Лечение больных этой категории в основном проводилось в профильном отделении и благодаря новым научным разработкам диагностики и лекарственной терапии – с положительным эффектом. Поэтому исследование выполнено на небольшой выборке, поскольку проводился подбор пациентов с одинаковыми полиорганными повреждениями, одинаковыми диагнозами и осложнениями для полноценной сопоставимости этих групп. В исследование выбраны и включены пациенты (n=41), госпитализированные в отделение реанимации (ОР) с диагнозом ГПА и доминирующими в структуре полиорганных повреждений дыхательной недостаточностью, легочным кровотечением и повреждением почек, либо пациенты с аналогичными нарушениями были переведены из профильного отделения.
Таким образом, пациенты разделены на две группы.
В первую вошли пациенты, которым проводилась лекарственная терапия (иммуносупрессивная – ИСТ) в профильном отделении (n=22), во вторую группу (n=19) – пациенты, поступившие в ОР, минуя профильное отделение.
Статистическая обработка выполнена с использованием программы Statistica V10.0 2017. Для переменных с распределением, отличным от нормального, вычислялись медиана и интерквартильный размах, и для выявления различий между группами применялись критерии Манна–Уитни.
Как видно из табл. 1, отмечается повышение показателей BVAS (Birmingham Vasculitis Activity Score), гиперпродукция АТ-РR-3 (ANCA со специфичностью к PR-3) с уровнем иммуноглобулина G (IgG), однако эти показатели были ниже в группе пациентов, переведенных из профильного отделения, что обусловлено проводимой в течение от 5 до 25 дней патогенетической терапией, включившей цитостатики с ГКС или с ГИБП в сочетании с ГКС.
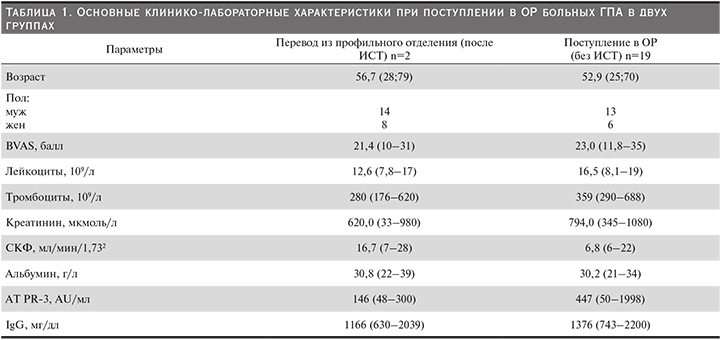
Более высокий уровень АТ-РR-3 отмечен у пациентов 2-й группы, которым лекарственная терапия не проводилась; имело место повышение BVAS, которое был выше, чем у пациентов 1-й группы. Также у пациентов, вошедших во 2-ю группу, значительно отличались показатели скорости клубочковой фильтрации (СКФ).
Основные причинами перевода пациентов от профильных специалистов в ОР: рефрактерное течение, значительное ухудшение состояния пациентов, нарастание дыхательной недостаточности на фоне кровохарканья (альвеолярное кровотечение), тяжелые пневмонии и возможное сочетание с прогрессирующей почечной недостаточности.
Во 2-ю группу вошли пациенты с впервые диагностированным АНЦА-СВ с поражением жизненно важных органов: почек, легких, поражением пазух носа, развитием мышечно-суставного синдрома, поражением кожных покровов.
В ОР использован полидисциплинарный подход (нефрологи, реаниматологи, клинические фармакологи, оторинолярингологи и др.) к лечению всех пациентов.
Всем пациентам, находившимся в нефрологическом отделении до перевода в ОР, 1 либо 2 раза в неделю проводили сеансы ГД, после которых их вновь переводили в профильное отделение.
Летальные исходы имели место только в 1-й группе больных, которым сеансы плазмообмена (ПО) начинали проводить после перевода из профильного отделения. Из 22 умерли 7 (31,8%) пациентов. Основные причины смерти: основное заболевание (рефрактерность к проводимой терапии и присоединение вторичной инфекции на фоне иммуносупрессии) – 3 из 7. Один пациент умер из-за развития острого нарушения мозгового кровообращения, что было расценено как проявление цереброваскулита на 2-е сутки после поступления в ОР. Трое из 7 скончались от дыхательной недостаточности на фоне прогрессирования двусторонней нозокомиальной пневмонии со значительным повреждением легочной ткани, подтвержденной компьютерной томографией (КТ), несмотря на антибактериальную терапию (основные возбудители: Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa) При поступлении в ОР тяжесть по индексу оксигенации (РаО2/FiO2) соответствовала 2–3-й степеням 140–100, что потребовало немедленного перевода на искусственную вентиляцию легких (ИВЛ). С учетом тяжелой степени выраженности дыхательной недостаточности ИВЛ проводилась в режиме IPPV либо SIMV со следующими параметрами: Vt – 4–6 мл/кг/МТ (450–550 мл), f – 14–17 в мин, PEEP 10–14, FiO2 – 60–80%. Следует отметить, что ни у одного из 7 пациентов при переводе в ОР кровохарканья не было. Этим пациентам (n=6) было проведено по 3 сеанса КПФ, объем циркулирующей плазмы (ОЦП) составил 2,5–3,0, Скорость кровотока – 130–150 мл/мин. В качестве антикоагулянта использовался гепарин в дозе 1000 ЕД/ч. Сеансы проводились ежедневно с предварительной премедикацией метипредом и введением иммуноглобулинов после окончания сеанса. На 4-е сутки отмечено снижение уровней креатинина, мочевины плазмы крови и маркеров воспалительного процесса. Однако, несмотря на проводимое комплексное лечение, на 6–7-е сутки пациенты скончались на фоне нарастания полиорганной недостаточности.
Из 22 больных 15, у которых доминировали воспалительное повреждение легких, альвеолярное кровотечение, почечная недостаточность, рефрактерное течение заболевания, перевели из профильного отделения. Всех пациентов сразу после поступления в ОР переводили на ИВЛ. В процессе лечения проведено по 6 сеансов очищения плазмы крови, первые 3 – процедуры высокообъемного ПО на аппарате «Аквариус». Объем замещения составил 2150–2310 мл свежезамороженной плазмы. Перед процедурой вводили в/в 250 мг метипреда в разведении NaCl 0,9% – 100 мл (скорость кровотока – 140 мл) ежедневно без использования гепарина, затем с интервалом через день 6 пациентам продолжались процедуры ПФ. Объем замещения свежезамороженной плазмой – 2000 мл, скорость кровотока – 120–130 мл с предварительной и последующей премедикацией метипредом, обязательным введением октагама по 5,0 г после каждого ПФ. Уже на 4-е сутки у 6 пациентов альвеолярное кровотечение значительно уменьшилось, восстановились показатели гемостаза, улучшились показатели газообмена, снизились показатели азотемии. Больным этой категории были продолжены сеансы КПФ через день в сочетании с лекарственной терапией. У других 9 пациентов после 2–3 сеансов ПФ кровотечение полностью прекратилось, улучшились показатели газообмены, в связи с чем пациенты переведены на вспомогательные режимы вентиляции с постепенным переводом на самостоятельное дыхание. Пациентам продолжены сеансы КПФ через день. КПФ выполнялся на аппарате Plasauto Σ с использованием фильтров Plasmaflo OP-05W(L), Cascadeflo EC-50W, ОЦП составил 2,5–3,0. Основные контролируемые показатели гомеостаза улучшились, что позволило на 7–9-е сутки перевести пациентов в отделение нефрологии для проведения дальнейшей терапии. Следует отметить, что все назначенные профильными специалистами лекарственные препараты также были использованы в процессе лечения в ОР. Детальное описание лекарственных препаратов и лабораторно-диагностических тестов не приводится, поскольку основная цель работы состояла в изучении необходимости и эффективности технологий плазмоочищения для пациентов сложной категории.
Однако можно кратко остановиться на двух рандомизированных контролируемых при ГПА исследованиях – RAVE и RITUXVAS. В них были оценены результаты лечения RTX в сочетании с ГКС и терапия ЦФ в сочетании с ГКС. Полученные результаты исследований подтвердили сопоставимую эффективность RTX и ЦФ в стандартной дозе для индукции ремиссии заболевания при сопоставимой частоте инфекционных осложнений [39, 40]. Также в другом исследовании, RITUXVAS, участвовали пациенты с тяжелым АНЦА-ассоциированным гломерулонефритом (АНЦА-ГН), а RTX не уступал ЦФ в отношении восстановления СКФ. Сопоставимая эффективность RTX и ЦФ для пациентов с тяжелым АНЦА-ГН была продемонстрирована в отдельных сериях наблюдений и ретроспективных исследованиях [41].
Пациенты (n=18), поступившие в ОР, минуя профильное отделение, c диагностированным АНЦА-васкулитом, характеризовались более тяжелым состоянием (гипертермия 38–39 °С, высокие маркеры воспалительной реакции, нарушение газообмена). При КТ органов грудной клетки и придаточных пазух (на основании основных жалоб) у 8 пациентов имели место левосторонний (2-сторонний) гайморит, фронтит (у 4 пациентов), экссудативный средний отит (3 пациента), двусторонняя пневмония с плевральным выпотом (у всех 8 пациентов), нарастающая дыхательная недостаточность, индекс оксигенации 180–160 с учетом декомпенсированной дыхательной недостаточности, нарастанием гипоксической энцефалопатии; больные переведены на ИВЛ в режиме IPPV с параметрами Vt – 500 мл, f – 17 в мин, PEEP – 10 см водн.ст., FiO2 – 50–60%. Начаты сеансы КПФ с перфузией плазмы: 2,5–3,0 ОЦП, с использованием премедикации метипредом и введением октагама после каждого КПФ. Выполнено шунтирование барабанной полости уха (n=3).
Проводилась комплексная терапия, назначенная смежными специалистами, включая массивную антибактериальную терапию, назначенную по чувствительности. Также проводились патогенетическая терапия основного заболевания, санационные бронхоскопии. ИВЛ проводилась в течение 5–6 дней с переводом на вспомогательный режим вентиляции (SIMV с параметрами Vt – 500 мл, f – 17 в мин, PEEP – 8 см вод.ст., FiO2 – 40%, SpO2 – 100%) на этом фоне индекс оксигенации постепенно поднялся до 295–306 мм рт.ст. После отключения седации больные в сознании, выполняют команды, далее режим ИВЛ: СРАР FiO2 – 30%, SpO2 – 100% по пульсоксимеру, затем пациентов перевели на самостоятельное дыхание. На 6–8-е сутки пациенты переведены в отделение нефрологии для дальнейшего лечения.
У 10 пациентов, входящих во 2-ю группу, наблюдалось прогрессирование почечно-легочного синдрома, сопровождавшегося тяжелой степенью дыхательной недостаточности, некротизирующим геморрагическим альвеолитом, что привело к нарушению диффузионной способности легких и способствовало развитию гипохромной анемии (вторичной). Развившееся почечное повреждение у 10 пациентов манифестировало в виде прогрессирующего гломерулонефрита с гематурией и протеинурией. Однако активный нефритический синдром протекал у этих пациентов с сохраненной азотовыделительной функцией почек. У нескольких пациентов (3 из 10) наряду с вышеописанными поражениями были отмечены язвенно-геморрагические высыпания преимущественно на коже конечностей.
Из-за низких показателей газообмена (SpO2 – 88–92%) все пациенты переведены на ИВЛ с индивидуальным подбором режимов вентиляции. Впоследствии выполнена трахеостомия. Использовались режимы IPPV или SIMV с параметрами Vt от 4 до 7 мл/кг/МТ (450–550 мл), f – 14–17 в минуту, PEEP – 10–14, FiO2 – 50–60%.
Проводились сеансы ПФ (ПО) ежедневно для поддержания внутрисосудистого объема, удаленную плазму замещали субституатом различного состава в зависимости от показаний (скорость кровотока – 120–140 мл). Использовали либо свежезамороженную плазму (СЗП), либо СЗП (80% объема) и 5%-ный раствор альбумина (20% объема). Предварительно перед ПО и после сеанса проводилась премедикация метипредом с обязательным введением иммуноглобулина после каждого ПО. Всем пациентам проводилась патогенетическая терапия, назначенная нефрологами, коррекция анемии, выполнялись назначения других профильных специалистов.
После 3 сеансов ПО альвеолярное кровотечение полностью прекратилось у 8 пациентов (из 10 входящих во 2-ю группу), которым в дальнейшем проводили по 3 сеанса КПФ через день. ИВЛ продолжено до 5–7 дней с постепенной сменой режимов вентиляции на фоне улучшения всех показателей газообмена. Седативная терапия отключена, пациенты переведены на режим поддержки СРАР FiO2 – 30–20%, SpO2 – 98–100% по пульсоксимеру, далее пациенты переведены на самостоятельное дыхание, выполнена деканюляция трахеи под контролем бронхоскопии. На 7–9-е сутки пациенты переведены в отделение нефрологии.
У 2 (из 10) пациентов после проведения 3 сеансов ПО кровотечение значительно уменьшилось, однако нарастала лихорадка, уровни маркеров воспалительной реакции, в связи с чем пациентам назначена стартовая антибактериальная терапия, продолжены сеансы ПО (2), ежедневно и на 5-е сутки кровохарканье полностью прекратилось. Также на 5-е сутки выполнено КТ грудной клетки, отмечена отрицательная динамика – двусторонняя полисегментарная пневмония с умеренным выпотом в плевральные полости. Несмотря на проводимую терапию и ИВЛ, с 9-х суток отмечено ухудшение состояния с продолжающимися гипертермией, выраженными нарушениями газообмена и снижением гемодинамических показателей. Проводилась седативная терапия в режиме постоянной дотации препаратов, уровень сознания – 6 по шкале Ramsey. Больные переведены на режим BiLevel: Рвдох – 18 см Н2О, Рsupp – 9 см Н2О, частота дыханий – 18–20 в мин, FiO2 – 70–60%, РЕЕР – 8 см Н2О. В связи с нестабильной гемодинамикой начата вазопрессорная поддержка норадреналином 0,03–0,15 мкг/кг/мин в титруемой дозе по уровню артериального давления для достижения целевых значений. Назначена новая схема антибактериальной терапии (получены результаты посевов и чувствительности к препаратам). Проводились санационные бронхоскопии, пункции плевральных полостей в связи с нарастанием гидроторокса. К 12-м суткам гемодинамическая поддержка снизилась и с 12–13-го дня наблюдения стабилизировалась. Однако, несмотря на проводимую антибактериальную терапию, патогенетическую терапию основного заболевания, оставалась лихорадка до 38,0°С, отмечалось повышение уровней лейкоцитов, СРБ, снижение уровня гемоглобина до 70 г/л, показатели гемостаза были в норме. По уретральному катетеру поступала моча буроватого оттенка, темп диуреза снизился, показатели креатинина, которые снизились после 2 сеансов КПФ, вернулись на прежний уровень. На 15-е сутки после получения новых лабораторных исследований данные КТ – двусторонняя полисегментарная пневмония, плеврального выпота нет. Разработана новая поликомпонентная схема антибактериальной терапии с включением противогрибковых препаратов. Проведено 2 гемотрансфузии с интервалом через сутки. Через трое суток температура тела – 36,7 °С, снизились лейкоцитоз и показатели СРБ, в связи с чем возобновлен сеансы КПФ. Выполнено 3 сеанса КПФ, через день ОЦП – 2,5–3,0, скорость кровотока – 130–150 мл/мин. После первого сеанса КПФ на следующий день проведен сеанс гемодиафильтрации – процедура ГДФ 1,5 часа с УФ 1,0 л. Qb –180 мл/мин, Qd – 300 мл/мин. На фоне проводимой терапии и экстракорпорального очищения крови на 20–22-е сутки состояние пациентов значительно улучшилось (снижение уровня СРБ, СОЭ, креатинина, мочевины, увеличение диуреза до 2000–2250 мл в сутки при сохранении активного нефритического синдрома), что позволило перевести пациентов на вспомогательные режимы вентиляции, а затем на самостоятельное дыхание. При контрольном КТ-исследовании пневмонической инфильтрации на выявлено. На 23–25-е сутки пациенты переведены в профильное отделение.

Сопоставив данные пациентов, входящих в группы 1 и 2, можно оценить эффективность их лечения по основным показателям, представленным в двух таблицах. Все показатели были несколько ниже у пациентов 1-й группы, которым до перевода в ОР проводилось лечение в нефрологическом отделении, чем во 2-й. Например, BVAS в 1-й группе до перевода в отделение реанимации соответствовал 21,4 балла, во 2-й – 23,0, креатинин – 620,0 и 794,0 мкмоль/л; СКФ – 16,7 и 6,8 мл/мин/1,732; АТ РR-3 – 3 146 и 447 AU/мл; IgG – 166 и 1376 мг/дл и т.д. Однако после проведенного лечения у пациентов 2-й группы отмечено более значительное снижение всех указанных выше показателей. Например: BVAS – 13,7 и 10,3 балла; креатинин – 295 и 333 мкмоль/л; СКФ – 4,8 и 10,6 мл/мин/1,732, АТ РR-3 – 23 и 101 AU/мл; IgG – 1003 и 1023 мг/дл Летальные случаи отмечены только в 1-й группе, во 2-й фатальных исходов не было.
Приступая к обсуждению вопроса использования плазмотехнологий в отношении пациентов с АНЦА-васкулитами, следует остановиться на публикациях, посвященных этой теме.
Особый интерес вызвало запланированное исследование, поскольку, несмотря на значительное число публикаций о применение плазмафереза в дополнение к иммуносупрессивой терапии, вопрос об эффективности этого метода лечения в отдаленные сроки оставался открытым. Считали, что ответ на него, возможно, будет получен в крупном исследовании PEXIVAS, в которое включены около 700 пациентов с тяжелым ГПА и МПА. Сроки окончания этого исследования были запланированы на 2018 г. [15].
В 2020 г. опубликованы результаты крупного рандомизированного контролируемого исследования PEXIVAS, в котором проводили изучение известных препаратов: циклофосфамида, RTX, сочетание RTX и циклофосфамида, микофенолата мофетил в сочетании ГКС. Также одной из задач исследования было сопоставление эффективности и безопасности двух схем лечения ГКС – традиционно и с быстрым снижением дозы. Во втором случае начальную дозу 1 мг/кг/сут. снижали вдвое со 2-й недели лечения, а доза 7,5 мг/сут. была достигнута к 11–15-й неделям лечения. При этом эффективность лечения была сопоставимой в двух группах, в то время как частота побочных эффектов, в первую очередь инфекционных осложнений, достоверно снизилась при быстром уменьшении дозы ГКС. Следует отметить, что в исследование была включена масса пациентов с тяжелой почечной недостаточностью на момент начала лечения (концентрация креатинина в дебюте заболевания превышала 500 мкмоль/л у 29% пациентов), в связи с чем его результаты представляют особый интерес при выборе тактики лечения пациентов с АНЦА-ГН [42]. Следует отметить, что основное внимание в этом исследовании уделялось лекарственной терапии различными препаратами и возможной их комбинации, как указывалось выше.
Также в крупном рандомизированном контролируемом исследовании PEXIVAS изучали эффективность ПО при АНЦА-васкулитах. Исследование проводилось более 3 лет с включением 704 пациентов с тяжелыми АНЦА-васкулитами [43]. Все пациенты получали лечение ЦФ или RTX и были случайным образом распределены на четыре группы в соотношении 1:1:1:1, лечение ПО по 7 сеансов через день (14 дней) с объемом эксфузии 60 мл/кг и возмещением 3–5%-ным раствором альбумина, в случае непереносимости последнего использовали свежезамороженную плазму в сочетании с ГКС по стандартной схеме, лечение ПО и ГКС в уменьшенной дозе и лечение ГКС в стандартной дозе без ПО. Оценка эффективности такого комбинированного лечения ориентирована на т.н. конечную точку: терминальная почечная недостаточность или летальный исход. Результаты исследования оказались сопоставимыми у пациентов, которым проводился (28,4%) или не проводился ПО (31,0%). Однако в более ранних исследованиях содержалась конкретная информация о применении сеансов очищения плазмы.
В одном из исследований MEPEX (Европейская группа исследования васкулитов) показана роль ПО для пациентов с АНЦА-васкулитом с имеющимися нарушениями функции почек. В исследование были включены 137 пациентов с первоначальным диагнозом «АНЦА-васкулит», креатинином плазмы>5,7 мг/дл, получавших стандартную терапию ГКС и циклофосфамидом. Пациенты были разделены на две группы: первая со стандартной терапией и сеансами КПФ (ТРЕ – терапевтический плазмоферез), пациенты 2-й группы получали дополнительно к стандартному лечению пульс-терапию метилпреднизолоном (1000 мг/сут. 3 дня). Из группы больных, получавших ПО (7 сеансов в течение 14 дней), у 54% пациентов восстановилась функция почек; во 2-й группе произошло восстановление функции почек лишь в 29% случаев. Однако высокая смертность (около 25%) наблюдалась в обеих группах в течение всего исследования [43].
В следующее (самое большое) исследование MEPEX были включены 387 пациентов с различными показателями креатинина – от 3,2 до 13,5 мг/дл. Добавление ПО к стандартной иммуносупрессии оказало влияние на восстановление функции почек и снижение летальности [44].
Известно, что большинство клинических проявлений системных аутоиммунных заболеваний связано с наличием антител и/или отложением иммунных комплексов, поэтому одним из важных компонентов лечения считается использование методов очищения плазмы: ТРЕ и двойная каскадная плазма-фильтрация DFPP (Double filtration plasmapheresis). ТРЕ применяют в случаях АНЦА-СВ с тяжелой почечной недостаточностью или легочным кровотечением, он достаточно эффективен, особенно в случаях сочетания АНЦА и антител к базальной мембране клубочков при назначении даже на ранней стадии [45–49].
По мнению ведущих ученых, в настоящее время АНЦА-СВ – контролируемое, но неизлечимое заболевание и часто имеет отдаленные последствия, требующие продолжительного комплексного лечения. Как известно, к неблагоприятным прогностическим факторам относят высокий индекс BVAS в дебюте заболевания: у пациентов с последующим летальным исходом, по данным литературы, BVAS составлял в среднем 20,5 балла [50].
Пациенты с частыми рецидивами, что свойственно ГПА, с обострениями и рефрактерным вариантом течения АНЦА-васкулитов имеют всегда серьезный прогноз, особенно без лечения до госпитализации, а одним из самых частых и прогностически значимых проявлений остается поражение почек – АНЦА-ГН, который без раннего адекватного лечения может приводить к быстрой и необратимой утрате почечной функции и оказывает негативное влияние на общую выживаемость пациентов [51–53].
Известно, что смертность в течение первого года при АНЦА‑СВ с поражением почек достигает 90%. Наиболее частыми причинами смерти служат почечная и дыхательная недостаточность, интеркуррентные инфекции. При ЭГПА причиной смерти в половине случаев становятся сердечно-сосудистые осложнения. Пятилетняя смертность на фоне стандартной индукционной терапии ЦФ и ГКС достигает 20%, наиболее неблагоприятным прогнозом характеризуется МПА (5-летняя смертность – 27,5%) по сравнению с ГПА и ЭГПА (13,2 и 13,9% соответственно) [54].
Как известно, в Европейских рекомендациях 2016 г. отмечено, что применение ТРЕ следует рассматривать при быстропрогрессирующем гломерулонефрите с уровнем креатинина крови >500 мкмоль/л (5,7 мг/дл) у лиц с дебютом или рецидивом АНЦА-СВ [55–57]. У ряда пациентов с АНЦА-ГН и повышением сывороточного уровня креатинина >500 мкмоль/л присоединение плазмафереза к традиционной терапии ЦФ и ГКС характеризовалось высокой эффективностью в отношении восстановления функции почек через 3 месяца и более [45].
В исследованиях, рассмотренных выше, указывалось, что (объем эксфузии – 60 мл/кг) замещение удаленной плазмы рекомендовано проводить альбумином, однако, по нашему мнению, пациентам с кровохарканьем первые сеансы КПФ (ПО) целесообразно возмещать СЗП, поскольку удаляется значительный объем плазмы (до 30–40% ОЦП), а дотация СЗП возмещает потерянные факторы свертывания крови.
С удаленным объемом плазмы снижается нагрузка антител к цитоплазме нейтрофилов, таким образом, при проведении ТРЕ можно удалить иммунные комплексы – патофизиологические источники болезни. Также следует уделять особое внимание проведению сеансов КПФ (DFPP), поскольку при КПФ из плазмы больного удаляются аутоантитела, вирусы, иммунные комплексы, вещества большого молекулярного веса, служащие причиной ряда заболеваний. Сеансы КПФ проводятся без использования замещающих растворов, но наиболее важно – это возможность удаления IgG до 75%. После прохождения через второй фильтр плазма пациент возвращается.
Заключение
В заключение следует акцентировать внимание на целесообразности использования технологий очищения пациентов с АНЦА-васкулитами. Согласно полученной информации из различных научных публикаций и приобретенному опыту сотрудников, можно заключить, что проведение ПФ (ПО) показано пациентам с легочно-почечным синдромом, причем проведение первых сеансов ПФ в отношении пациентов с альвеолярным кровотечением возможно в безгепариновом режиме с замещением ОЦП СЗП. Дальнейшее лечение пациентов после прекращения кровохарканья и восстановления показателей гемостаза возможно с переводом на сеансы ПФ.
Пациентам с частыми рецидивами, что свойственно ГПА, обострениями, и рефрактерным вариантом течения АНЦА-васкулитов показано включать в комплексную схему лечения сеансы ТРЕ.
Применение ТРЕ следует назначать при быстропрогрессирующем гломерулонефрите с уровнем креатинина крови >500 мкмоль/л (5,7 мг/дл) пациентам с дебютом или рецидивом АНЦА-СВ, что подтверждено в рекомендациях 2016 г.
Также при уровне креатинина >500 мкмоль/л присоединение ПФ к традиционной терапии ЦФ и ГКС характеризуется высокой эффективностью и способствует восстановлению функции почек.
Высокий индекс BVAS (в среднем 20,5 балла) в дебюте заболевания требует комплексного подхода к разработке схемы лечения с включением методов экстракорпорального очищения организма, поскольку такой показатель служит неблагоприятным прогностическим фактором.
Целесообразно рассматривать использование альтернирующего варианта, т.е. поочередно применять КПФ и при необходимости ГД; ПФ с ГД; либо ПФ (ПО) с КПФ в зависимости от клинической ситуации.



