Введение
Хорошо известно, что белки необходимы для питания человека и животных. Биологическая ценность белка определяется его аминокислотным составом. Одни аминокислоты (незаменимые) не синтезируются в организме при их отсутствии в пище, тогда как другие (заменимые) в аналогичном случае могут синтезироваться в организме. Восемь аминокислот (лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валин и изолейцин) необходимы всем исследованным видам животных и являются незаменимыми [1]. Что касается гистидина, то до сих пор идут споры о возможности его синтеза в животном организме, а следовательно, о том, относить его к незаменимым или заменимым аминокислотам.
Необходимо добавить, что под невозможностью синтеза в организме понимается свойственная всем незаменимым аминокислотам необратимость распада их углеродного скелета. Но почти все аминокислоты, как заменимые, так и незаменимые, способны подвергаться обратимому переаминированию с α-кетокислотами. Значительный интерес представляет следующий факт. Отмечено [2], что после того, как крысам и кроликам добавляли в пищу глицин, меченный N15, треонин не содержал этого изотопного маркера (в отличие от других аминокислот, кроме лизина). Отсюда можно сделать вывод: треонин, подобно лизину, не принимает участия в переносе аминогруппы, который наблюдается у других аминокислот, как заменимых, так и незаменимых. Но другие авторы [3] после кормления крыс лейцином, меченным N15, нашли очень небольшое количество метки в треонине. Тот факт, что некоторое количество азота лейцина было обнаружено в молекуле треонина, указывает на наличие в организме животных незначительного синтеза треонина путем переаминирования.
Целью настоящего обзора стало обсуждение открытий японских биохимиков, сделанных в разные годы, но долгое время остававшихся незамеченными в мировой биохимической науке, которые проливают свет на белые пятна в понимании возможности переаминирования треонина и биосинтеза гистидина, а также значения этих процессов для терапии хронической болезни почек (ХБП). Поскольку переаминирование треонина изучено лучше, чем биосинтез гистидина у человека и животных, обзор следует начать с него.
Треонин
Углеродный скелет треонина необратимо распадается в печени млекопитающих под влиянием двух ферментов: треониндегидратазы и треониндегидрогеназы. Крысы ярко демонстрируют невозможность синтеза у млекопитающих углеродного скелета треонина – иными словами, что треонин – незаменимая аминокислота. В то же время именно у крыс в организме был обнаружен N15, введенный в организм с лейцином [3]. Это могло быть только результатом переаминирования, поскольку последнее является единственным способом биосинтеза незаменимых аминокислот у животных.
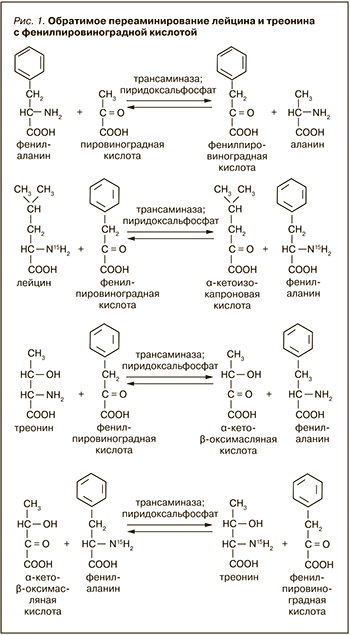 Т. Т. Березов в своей монографии [4] в 1969 г. пишет: считается доказанным, что в тканях млекопитающих механизм переаминирования является главным путем дезаминирования L-аминокислот, и перечисляет их. Cреди аминокислот Т. Т. Березов называет треонин, но не называет лизин, следовательно, он имеет в виду непосредственно аминокислоты, а не продукты их превращения, потому что продукт превращения лизина (α-аминоадипиновая кислота) активно подвергается переаминированию. Несмотря на то что традиционно считается, что партнером той или иной аминокислоты при переаминировании является α-кетоглутаровая кислота (соответственно, партнером той или иной α-кетокислоты – глутаминовая кислота), Т.Т . Березов отмечает, что переаминирование может происходить в тканях между разнообразными монокарбоновыми донорами и акцепторами аминогрупп без участия дикарбоновых аминокислот. К реакциям этого типа относятся процессы переаминирования между рядом аминокислот и пировиноградной кислотой с образованием аланина и соответствующих α-кетокислот, протекающие в митохондриях печени. Была показана и обратимость этих реакций, а также различная способность отдельных тканей катализировать описанные превращения. Дальнейшие исследования японских биохимиков подтвердили возможность переаминирования треонина у крыс. Так, Т. Noguchi et al. [5] рассматривают фермент серин-пируватаминотрансферазу, выделенный из митохондрий печени крыс и катализирующий переаминирование различных аминокислот как с пировиноградной, так и с фенилпировинградной кислотой. Причем если фенилаланин весьма активно переаминируется серин-пируватаминотрансферазой с пировиноградной кислотой, то лейцин (в большой степени), треонин (в меньшей степени) и глицин (в очень малой степени) переаминируются ею только с фенилпировиноградной кислотой (рис. 1): В свете этого легко объясняется указанный выше факт. Когда кроликов и крыс снабжали рационом с избытком N15 в глицине, треонин этого избытка не содержал: в организме млекопитающих треонин из глицина образовываться не может, а переаминированию подвергается лишь очень незначительная часть глицина. В то же время обнаружение в треонине N15, введенного в организм крысы с лейцином, есть результат переаминирования, которому активно подвергается лейцин и более слабо – треонин. T. Ishikawa et al. [6] устанавливают идентичность кинуренинаминотрансфераз почек и мозга крыс. Что касается субстратной специфичности обоих ферментов, то кроме кинуренина (продукт распада триптофана) они способны катализировать переаминирование многих аминокислот как с пировиноградной, так и с фенилпировиноградной кислотами, но если кинуренинаминотрансфераза мозга хорошо переаминирует почти все аминокислоты с фенилпировиноградной кислотой, то кинуренинаминотрансфераза почек переаминирует с ней только часть из них. Что касается треонина, то он переаминируется с фенилпировиноградной кислотой обеими кинуренинаминотрансферазами, но в почках в небольшой степени, а в мозге так же активно, как и другие аминокислоты, уступая лишь метионину. С пировиноградной кислотой обе кинуренинаминотрансферазы переаминируют только ароматические аминокислоты. На лизин же обе кинуренинаминотрансферазы не действуют, что подтверждает отсутствие у него способности к переаминированию. Следовательно, активное переаминирование различных аминокислот, включая треонин, с фенилпировиноградной кислотой, катализируемое кинуренинаминотрансферазой мозга крысы, подтверждает мысль Т. Т. Березова, согласно которой в тканях млекопитающих переаминирование как таковое является главным путем дезаминирования L-аминокислот.
Т. Т. Березов в своей монографии [4] в 1969 г. пишет: считается доказанным, что в тканях млекопитающих механизм переаминирования является главным путем дезаминирования L-аминокислот, и перечисляет их. Cреди аминокислот Т. Т. Березов называет треонин, но не называет лизин, следовательно, он имеет в виду непосредственно аминокислоты, а не продукты их превращения, потому что продукт превращения лизина (α-аминоадипиновая кислота) активно подвергается переаминированию. Несмотря на то что традиционно считается, что партнером той или иной аминокислоты при переаминировании является α-кетоглутаровая кислота (соответственно, партнером той или иной α-кетокислоты – глутаминовая кислота), Т.Т . Березов отмечает, что переаминирование может происходить в тканях между разнообразными монокарбоновыми донорами и акцепторами аминогрупп без участия дикарбоновых аминокислот. К реакциям этого типа относятся процессы переаминирования между рядом аминокислот и пировиноградной кислотой с образованием аланина и соответствующих α-кетокислот, протекающие в митохондриях печени. Была показана и обратимость этих реакций, а также различная способность отдельных тканей катализировать описанные превращения. Дальнейшие исследования японских биохимиков подтвердили возможность переаминирования треонина у крыс. Так, Т. Noguchi et al. [5] рассматривают фермент серин-пируватаминотрансферазу, выделенный из митохондрий печени крыс и катализирующий переаминирование различных аминокислот как с пировиноградной, так и с фенилпировинградной кислотой. Причем если фенилаланин весьма активно переаминируется серин-пируватаминотрансферазой с пировиноградной кислотой, то лейцин (в большой степени), треонин (в меньшей степени) и глицин (в очень малой степени) переаминируются ею только с фенилпировиноградной кислотой (рис. 1): В свете этого легко объясняется указанный выше факт. Когда кроликов и крыс снабжали рационом с избытком N15 в глицине, треонин этого избытка не содержал: в организме млекопитающих треонин из глицина образовываться не может, а переаминированию подвергается лишь очень незначительная часть глицина. В то же время обнаружение в треонине N15, введенного в организм крысы с лейцином, есть результат переаминирования, которому активно подвергается лейцин и более слабо – треонин. T. Ishikawa et al. [6] устанавливают идентичность кинуренинаминотрансфераз почек и мозга крыс. Что касается субстратной специфичности обоих ферментов, то кроме кинуренина (продукт распада триптофана) они способны катализировать переаминирование многих аминокислот как с пировиноградной, так и с фенилпировиноградной кислотами, но если кинуренинаминотрансфераза мозга хорошо переаминирует почти все аминокислоты с фенилпировиноградной кислотой, то кинуренинаминотрансфераза почек переаминирует с ней только часть из них. Что касается треонина, то он переаминируется с фенилпировиноградной кислотой обеими кинуренинаминотрансферазами, но в почках в небольшой степени, а в мозге так же активно, как и другие аминокислоты, уступая лишь метионину. С пировиноградной кислотой обе кинуренинаминотрансферазы переаминируют только ароматические аминокислоты. На лизин же обе кинуренинаминотрансферазы не действуют, что подтверждает отсутствие у него способности к переаминированию. Следовательно, активное переаминирование различных аминокислот, включая треонин, с фенилпировиноградной кислотой, катализируемое кинуренинаминотрансферазой мозга крысы, подтверждает мысль Т. Т. Березова, согласно которой в тканях млекопитающих переаминирование как таковое является главным путем дезаминирования L-аминокислот.
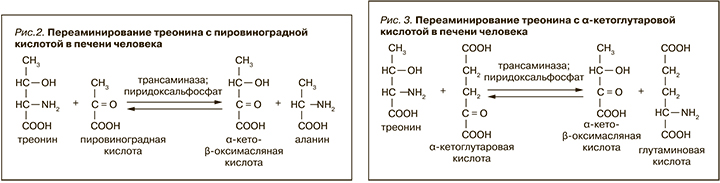
В то же время в большинстве современных учебников и справочников по биохимии способность треонина к переаминированию отрицается наряду с лизином. Однако правоту японских исследователей подтверждает работа G. Barret (2012) [7], где отмечается, что млекопитающим, больным уремией и находящимся на низкобелковой диете, в рацион добавляли α-кетокислоты – производные незаменимых аминокислот. Последние синтезировались в организме путем переаминирования. Оказалось, что в виде аминокислот необходимо давать только лизин, для которого отсутствует трансаминаза. Следует отметить, что степень использования α-кетокислот для синтеза соответствующих аминокислот различается. Валин, лейцин, изолейцин, метионин и фенилаланин быстро синтезировались путем переаминирования, в то время как гистидин, треонин и триптофан синтезировались в меньшей степени, а синтеза лизина вообще не наблюдалось. В исследовании E. Okuno et al. (1980) [8] сообщается о кинуренинаминотрансферазе, полученной из печени человека. Этот фермент оказался идентичным серин-пируватаминотрансферазе и аланин-глиоксилатаминотрансферазе. В отличие от серин-пируватаминотрансферазы крыс он катализирует переаминирование ряда аминокислот с пировиноградной, но не с фенилпировиноградной кислотой, причем треонин с ней переаминируется в небольшой степени (рис. 2). В работе того же автора за 1993 г. [9] рассматривают аминоадипатаминотрансферазы-I и -II печени человека. Оба фермента способны катализировать обратимое переаминирование с α-кетоглутаровой кислотой не только α-аминоадипиновой кислоты, но и природных аминокислот, а также кинуренина и орнитина (продукта распада аргинина). Если в отличие от аминоадипатаминотрансфераза-II аминоадипатаминотрансфераза-I не действовала на триптофан и кинуренин, то на остальные аминокислоты, в т.ч. треонин, действовали оба фермента в одинаково небольшой степени (рис. 3).
При уремии незаменимые аминокислоты в диете заменяют их кетоаналогами в расчете на то, что при переаминировании последние превратятся в первые [10]. Но при этом не используют кетоаналоги лизина и треонина, т.к. считается, что эти две аминокислоты не подвергаются переаминированию. Как было показано выше, треонин переаминированию подвергается, а следовательно, также может замещаться своим кетоаналогом в диете больных уремией, а в случае неустойчивости последнего – гидроксианалогом, который обратимо превращается в кетоаналог. Отсутствие замены циклических аминокислот, кроме фенилаланина, кето- или гидроксианалогами, как и замена метионина гидроксианалогом, выходит за рамки статьи и здесь не рассматривается.
Гистидин
После открытия в 1935 г. треонина появилась возможность применять рационы, вместо белков содержащие смеси аминокислот. W. C. Rose в 1937 г. путем последовательного исключения аминокислот из рациона поодиночке установил, что для белых крыс незаменимы девять аминокислот, включая гистидин [11]. Вскоре незаменимость гистидина была установлена для мыши, собаки и цыпленка [1]. Для сохранения азотистого равновесия у человека гистидин не нужен [12].
В работе L. Levy и M. J. Coon (1952) [13] срезы человеческой печени были инкубированы с формиатом-С14 и найдены продуцирующими меченое соединение, которое на бумажной хроматографии идентифицировано как гистидин. На этом основании в учебнике биохимии для медицинских институтов Ф. Б. Штрауба (1963) [14] делается вывод: для человека гистидин является заменимой аминокислотой и не слишком продолжительное его отсутствие в пище не вызывает никаких расстройств в организме, и приводится схема биосинтеза гистидина в человеческом организме. Там же утверждается, что гистидин синтезируется из гистидинола, что подтверждено в недавнее время японскими биохимиками [15, 16]. При этом приводится предполагаемая схема биосинтеза гистидина у человека из пуринового основания аденина, а пуриновые основания, как известно, синтезируются в животном организме. Здесь не имеет смысла приводить эту схему, ибо она наличествует у микроорганизмов, но не подтверждена у человека. В исследовании F. B. Stifel и R. H. Herman (1972) [17], также приняв во внимание уже упомянутую работу L. Levy и M. J. Coon [13], утверждается, что гистидин требуется младенцам (поскольку не синтезируется в их организме) и, возможно, при определенных болезненных состояниях (уремия и ревматоидный артрит), когда он усиленно расходуется.
Новым этапом доказательств синтеза гистидина у здорового взрослого человека является работа Y. B. Sheng и T. M. Badger (1977) [18]. После 22 дней безгистидинового питания NH4Cl был принят испытуемыми перорально. N15 появлялся в общем белке плазмы крови, глобине гемоглобина и мочевине. Причем N15 присутствовал как в аминогруппе гистидина, так и в его имидазольном кольце. Из этого делается заключение, согласно которому гистидин синтезируется в норме у взрослого человека: это продемонстрировано включением N15 в имидазольное кольцо гистидина. Хотя кишечная микрофлора может вносить свой вклад в биосинтез гистидина, из данного опыта не могут быть выведены ни местоположение, ни степень биосинтеза гистидина.
В обзоре M. E. Swendseid (1981) [19] отмечается, что гистидин является единственным среди незаменимых аминокислот, при исключительно низком содержании которого в диете в течение короткого времени в человеческом организме поддерживалось азотистое равновесие. Авторы отмечают несколько гипотез для объяснения этого феномена:1) гистидин составляет 8% молекулы гемоглобина, и распад гемоглобина обеспечивает наибольшим количеством гистидина в пропорции к другим незаменимым аминокислотам; 2) гидролиз дипептида карнозина мышц освобождает гистидин (хорошим доказательством является снижение содержания карнозина у крыс в мышцах при безгистидиновой диете и пополнение содержания карнозина при снабжении гистидином); 3) биосинтез гистидина. Комбинация этих гипотез может объяснить уникальную потребность тканей в гистидине при безгистидиновой диете.
 Но, несмотря на очевидные доказательства биосинтеза гистидина в человеческом организме, в 1985 г. ФАО отнесла гистидин к незаменимым аминокислотам. И только в XXI в. S. Wadud et al. (2001) [15] впервые сообщили об активности в печени и почках крупного рогатого скота фермента гистидинолдегидрогеназы, окисляющего гистидинол в гистидин (рис. 4). Причем количество гистидина, образующегося в этой реакции, полностью удовлетворяет потребность в нем крупного рогатого скота. Отсюда делается вывод: для него гистидин может быть заменимой аминокислотой, если достаточна продукция гистидинола из предшественников.
Но, несмотря на очевидные доказательства биосинтеза гистидина в человеческом организме, в 1985 г. ФАО отнесла гистидин к незаменимым аминокислотам. И только в XXI в. S. Wadud et al. (2001) [15] впервые сообщили об активности в печени и почках крупного рогатого скота фермента гистидинолдегидрогеназы, окисляющего гистидинол в гистидин (рис. 4). Причем количество гистидина, образующегося в этой реакции, полностью удовлетворяет потребность в нем крупного рогатого скота. Отсюда делается вывод: для него гистидин может быть заменимой аминокислотой, если достаточна продукция гистидинола из предшественников.
В той работе активности гистидинолдегидрогеназы из печени и почек крупного рогатого скота сравнивались с таковыми у свиньи, не являющейся жвачным животным. Было установлено, что количество синтезируемого гистидина не может удовлетворять потребность свиньи в нем. Из этих результатов делается следующий вывод: гистидин может быть заменимой аминокислотой для крупного рогатого скота, но незаменимой для свиней. Вскоре R. Onodera (2003) [16] показал активность гистидинолдегидрогеназы в печени, почках и мышцах крупного рогатого скота, а также свиньи, мыши, домашней птицы и дикой утки и обсуждал незаменимость гистидина для этих животных. В той же работе указывается, что гистидин может не быть незаменимой аминокислотой как для растущего, так и для взрослого крупного рогатого скота, если образования гистидинола из его предшественников достаточно в органах, содержащих гистидинолдегидрогеназу: в печени, почках и мышцах. В то же время в работе отмечается, что образование гистидина у телят возрастает с весом тела и если у растущих телят потребность в гистидине возрастает вплоть до 300 кг веса тела, то при 450 кг образование гистидина в организме превышает потребность в нем. Начальным продуктом синтеза гистидина в этих органах считают фосфорибозилпирофосфат, но при этом заявляют, что именно активность гистидинолдегидрогеназы определяет возможность синтеза гистидина de novo, т.к. этот фермент катализирует конечный шаг в серии реакций в пути биосинтеза гистидина. У всех исследованных видов животных обнаружена гистидинолдегидрогеназа, но с разной активностью. Делается вывод, согласно которому эта активность и служит тем самым показателем, по которому можно судить о незаменимости (заменимости) гистидина для того или иного вида животного, включая человека. И только это может объяснить парадоксальную заменимость гистидина для человека в отличие от большинства животных, а также незаменимость гистидина для детей. Поэтому вполне естественно, что в издании книги о современном питании за 2014 г. [20] также подтверждается возможность синтеза гистидина в организме человека. В той книге специальный раздел посвящен гистидину, где замечено, что, хотя незаменимость гистидина показана для крыс, трудно его определить как незаменимую аминокислоту в питании взрослых людей.
Между тем еще в 1970 г. J. Bergstrom et al. [21] сообщали, что гистидин является незаменимой аминокислотой для больных уремией и что добавление его в диету вместе с теми аминокислотами, что незаменимы для здоровых людей, улучшает азотистый баланс. С тех пор на эту тему проведен ряд исследований. Замечено, что в отличие от других заменимых аминокислот для больных уремией характерны низкие внутриклеточная и плазменная концентрации гистидина [22]. Поэтому в обзоре W. J. Visek [23] гистидин определяется как незаменимая аминокислота для младенцев, заменимая – для здоровых взрослых людей, но у больных ХПН гистидин относится к условно незаменимым аминокислотам, т.к. эти больные не способны поддерживать азотистое равновесие диетой с низким содержанием гистидина. Вряд ли человеческий организм теряет при этом способность синтезировать гистидин, ибо в других современных источниках и других работах [26], написанных уже после обнаружения в животном организме гистинолдегидрогеназы, ничего не говорится об исчезновении или снижении ее активности при уремии. Резкое снижение содержания гистидина в организме больных уремией, по-видимому, объясняется вступлением значительной части гистидина во взаимодействие с ионами тяжелых металлов с целью снижения воспаления и оксидативного стресса и последующей потерей этой аминокислоты для организма.
Заключение
Открытия японских биохимиков, сделанные в конце XX и начале XXI вв., пролили свет на белые пятна в превращении двух аминокислот – треонина и гистидина. До того в представлении многих биохимиков и смежных специалистов (биологов, врачей и пр.) присутствовали устоявшиеся стереотипы, отрицающие а) участие треонина в переаминировании и б) способность гистидина синтезироваться в животном организме.
Первое может использоваться при уремии, когда незаменимые аминокислоты, кроме лизина и треонина, в диете замещают α-кетоаналогами в расчете на их превращение в незаменимые аминокислоты путем переаминирования, которое справедливо считают не существующим для лизина, но несправедливо – для треонина. Второе открытие позволяет понять, почему для одних организмов (большинство животных) гистидин является незаменимой аминокислотой, для других (в частности, здоровые взрослые люди) – заменимой, для третьих (люди, больные уремией) – условно незаменимой. А ведь именно различный статус гистидина у здоровых людей и больных уремией обусловливает составление различных рационов этим категориям людей, а также предписывает применять гистидин при уремии для улучшения состояния больных. В конце концов, никто не ставит под сомнение заменимость тирозина, который является нормальным продуктом превращения незаменимой аминокислоты фенилаланина (если этого не происходит, то с рождения развивается фенилпировиноградная олигофрения). Однако у больных уремией тирозин также становится условно незаменимой аминокислотой, т.к., по-видимому, будучи, как и гистидин, циклической аминокислотой, расходуется на те же процессы. Отмечено и прекращение образования тирозина из фенилаланина в почках при ХПН, но это уже выходит за рамки статьи.



