Болезни мочевой системы занимают одно из ведущих мест в структуре заболеваемости и составляют в среднем до 30 на 1000 детского населения [1, 2]. В повседневной практике педиатры, специалисты по детской нефрологии, урологии и хирургии наиболее часто встречаются с воспалительными заболеваниями почек и мочевыводящих путей (МВП), в частности с острым пиелонефритом (ОП) [3–6].
Морфологи характеризуют п и е л о н е ф р и т как микробно-воспалительное заболевание с поражением в основном межуточной ткани почек. Различают при этом острый и хронический пиелонефрит с рецидивирующим течением последнего в виде атак ОП [7].
Однако клиницистами оговаривается, что прижизненное морфологическое исследование далеко не всегда позволяет разграничивать бактериальное и абактериальное воспаление. Часто трудно найти патогмоничные признаки, позволяющие разводить данные состояния. К сожалению, этиологические и предрасполагающие факторы также не всегда выявляются при обычных методах исследования. На фоне упомянутого не прослеживается явных признаков снижения распространенности пиелонефрита, несмотря на постоянно внедряемые современные лечебно-диагностические технологии. Пиелонефрит остается ключевой проблемой в патологии тубулоинтерстициальной части почек [8, 9].
Многими исследователями подчеркивается, что клинические данные не отражают истинной частоты пиелонефрита. Нередко заболевание не диагностируется либо протекает под маской другого патологического состояния. У части детей ряд острых заболеваний вне уропоэтической си-
стемы является провоцирующим фактором, позволяющим выявлять латентно протекающий пиелонефрит. У других пациентов пиелонефрит возникает как осложнение имеющегося патологического состояния [10, 11]. У 20–32 % больных пиелонефрит сочетается или развивается на фоне энтероколита, токсико-септических состояний, полиорганных травматических повреждений [12].
Пиелонефрит у детей нередко связан с врожденными или наследственными дисэмбриогенетическими (диспластическими) процессами либо с тубулопатиями, дисметаболическими расстройствами, парциальным иммунодефицитным состоянием [13, 17]. Некоторые авторы считают возможным внутриутробное инфицирование почки, предполагая заражение ребенка через амниотическую жидкость, кровь, плаценту [5].
П а т о м о р ф о л о г и и п и е л о н е ф р и т а первым посвятил свои изыскания в 1894 г. T. Escherich, описав воспаление почечной лоханки. В 1899 г. К.Я. Степанов и в 1913 г. М.Н. Москалев создали экспериментальную модель пиелонефрита. В 1910 г. M. Thiemich сделал важное наблюдение: воспаление почечной лоханки сопровождается вовлечением в процесс паренхимы почек [8]. Патоморфология ОП определяется ренальными макро- и микроскопическими изменениями, характерными для конкретной фазы процесса и его распространенности. Большинство авторов подчеркивают, что морфологические проявления ОП не связаны с видом и характером бактериальной флоры, а также не зависят от пути проникновения инфекции и возраста пациента [3, 5, 19, 20].
Ю.А. Кириллов (1982) на основании гистологических исследований выделяет три фазы изменений, характерных для острой стадии пиелонефрита: серозную, гнойную и фазу мезенхимальной реакции. При этом каждая из них имеет свое время развития от начала клинических проявлений пиелонефритической атаки: серозная – на 1–2-й день заболевания, гнойная – на 4–8-й и ОП с мезенхимальной реакцией – на 10–14-й день. При серозном пиелонефрите выявляются признаки венозного полнокровия и отека интерстициальной ткани. На фоне нарастающего отека стромы увеличиваются признаки нейтрофильной инфильтрации, распространяющейся в основном перитубулярно. При гнойном пиелонефрите прогрессирует венозное полнокровие и отек интерстиция. Лейкоцитарная инфильтрация, распространяясь в корковом и мозговом веществе, принимает диффузный характер. Появление и развитие признаков дистрофии, деструкции капсул клубочков, канальцев и трубочек приводит к возникновению подкапсульных милиарных мочевых экстравазатов – апостем. При апостематозном пиелонефрите очаги деструкции чаще располагаются на расстоянии друг от друга. Иногда они исходят из одного общего инфильтрата, сливаются и образуют карбункул почки, который может быть на поверхности или в глубине органа. Вскрытие одного или нескольких абсцессов в полость коллекторной системы почки ведет к образованию пионефроза [3, 20, 21–23].
ОП с мезенхимальной реакцией проявляется сменой альтеративной и экссудативной фаз воспалительного процесса пролиферативной. Пучки коллагеновых волокон, как и в нормальной почке, располагаются перигломерулярно, перитубулярно и периваскулярно. Разрастание соединительной ткани говорит об обратном развитии процесса, несмотря на то что в почке могут сохраняться инкапсулированные гнойные очаги. В случаях диффузного разрастания соединительной ткани развивается равномерное сморщивание почки – пиелонефротическая сморщенная почка [23].
Б.И. Шулутко (2002) подчеркивает, что первоначально на фоне воспалительных проявлений в интерстиции и стенках лоханки клубочки не изменены. Дальнейшее развитие процесса отличается прежде всего ишемическими повреждениями почки сосудистого происхождения: прогрессирует тубулярная атрофия, повреждаются междольковые артерии и афферентные артериолы, присоединяется “функциональный” компонент – спазм артерий, большая активность вазопрессорных субстанций, как следствие – разрушающее поражение тубулярных структур и клубочков; лимфоцитарные инфильтраты замещаются постепенно прогрессирующим фиброзом [8] .
Таким образом, морфогенез ОП состоит из последовательно сменяющих друг друга фаз, соответствующих общим стадиям патологического процесса: альтерации–сосудисто-тканевой реакции–пролиферации. В частности, относительно ОП прослеживается фаза развития сосудисто-тканевой реакции от отечно-инфильтративных проявлений до деструктивных, далее – фаза стромально-клеточных и склеротических реакций как проявление репарации [3, 8, 21].
А.Я. Пытель и С.Д. Галигорский (1961) подчеркивают, что разногласий между патологоанатомами в отношении морфологических проявлений ОП и его форм нет. Не только дифференцированы стадии интраренального острого воспалительного процесса: серозная, гнойно-деструктивная (апостематозный пиелонефрит, карбункул, абсцесс), но и обозначены их сроки. Однако основной трудностью остается своевременное клиническое распознавание фазы интраренального воспалительного процесса [23–25].
Таким образом, при ОП на практике клиницисты имеют ряд патоморфологических предпосылок, заставляющих их выборочно подходить к оперативному лечению даже в случаях предполагаемого локального гнойно-деструктивного поражения почки. Достаточно упомянуть о высокой вероятности двустороннего поражения, а также о заболевании единственной почки [3, 26–29]. При этом многими авторами подчеркивается значимость регенеративных возможностей почечной ткани в детском возрасте и опыте успешного консервативного лечения гнойных форм ОП с применением мощных антимикробных и иммунокорригирующих средств, инфузионной терапии [5, 8].
Характерное для детей быстрое развитие и распространение воспалительного процесса при ОП с учетом повышенной чувствительности к провоцирующим этиологическим факторам, отсутствие специфических клинико-лабораторных признаков, превалирование общей клинической симптоматики, особенно выраженное у детей ранних возрастных групп, требуют применения информативных методов диагностики, позволяющих клиницисту действовать уверенно и эффективно [3, 28]. Естественное желание лечащего врача выявить ("увидеть") и оценить воспалительный очаг для своевременного определения оптимальной лечебной тактики делает визуализирующие методы основными при оценке ренальных структур. При этом лидируют рентгенологические и ультразвуковые технологии.
С учетом же абсолютной безвредности на практике все больше предпочтений отдается эхографии [4, 30, 31].
Э х о г р а ф и ч е с к и е т е х н о л о г и и в уронефрологии обеспечили значительное качественное улучшение диагностики, в т. ч. острых воспалительных изменений почек. Выделяют несколько факторов, делающих ультразвуковую диагностику лидером визуализирующих методов в детской клинической практике. Основные из них – отсутствие противопоказаний, неинвазивность, повышенная разрешающая способность, а также независимость получения результата исследования от ренальной функции [32–36].
С середины 1990-х гг. определилась перспектива систем цветового ангиокартирования для качественной оценки сосудов кортикального отдела почечной паренхимы с оценкой острых и хронических дистрофических проявлений [37–39].
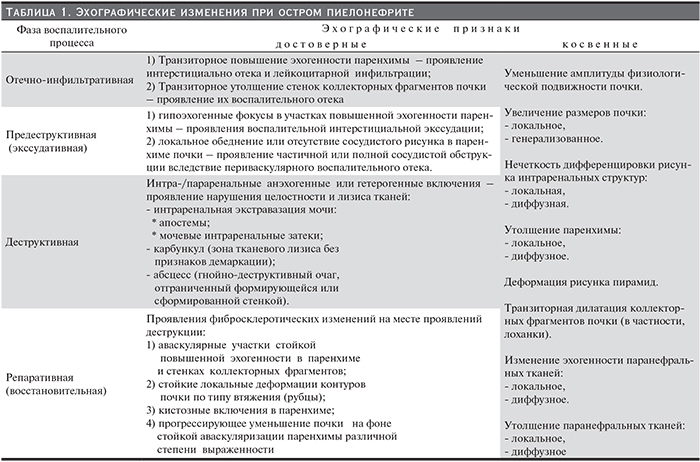
К настоящему времени накоплен значительный опыт применения УЗИ для диагностики поражений почечной паренхимы воспалительного генеза у детей [32, 35, 38]. Как правило, эхографически выделяют четыре основных типа локальных изменений по степени интенсивности отражения эхосигнала от измененных структур: гиперэхогенные (эхопозитивные) – поглощающие или целиком отражающие ультразвук; анэхогенные (эхонегативные) – не задерживающие ультразвук; гипоэхогенные (средней интенсивности отражения) и смешанные (гетерогенные). Исследователи при этом по-разному относятся к разрешающей способности метода. Одни считают, что ультразвуковое сканирование следует проводить в комплексе с другими методами, например экскреторной урографией или компьютерной томографией [4, 9, 30, 31, 33]. Другие авторы на основании значительного клинического опыта рекомендуют эхографию для ранней диагностики локальных поражений в качестве обязательного метода, который позволяет точно дифференцировать интраренальную патологию, в частности объемные образования и очаговые изменения паренхимы в 90–100 % случаев [37–39]. Следует подчеркнуть, что авторами, предлагающими сочетать ультразвуковое сканирование с клинико-лабораторными и рентгенологическими методами исследования, использовалась аппаратура – в основном среднего класса сложности. Подобное оборудование укомплектовывается датчиками, по частоте сканирования не превышающими 5-8 МГц с соответствующим линейным и тональным разрешением [3, 30, 32, 35].
Попыткам эхографической оценки почек при ОП как наиболее распространенной ренальной воспалительной патологии с конца прошлого века посвящено значительное количество исследований.

F. Konerschnik и соавт. (1982) – одними из первых отметили возможность с помощью ультразвуковой визуализации выявлять характерные воспалительные очаговые интраренальные изменения на ранних стадиях заболевания до формирования абсцесса [41].
Последние 10 лет отличаются внедрением в клиническую практику высокоразрешающих ультразвуковых диагностических технологий (с линейным разрешением до 0,2 мм). Анализ наработок с их использованием, во-первых, подтвердил высокую результативность применения эхографии в диагностике ОП. Во-вторых, показал смещение изысканий “вглубь” – в тонкости эхтографических проявлений при оценке фазовых морфологических изменений, сопровождающих воспаление почечных структур [39, 40].
Однако, несмотря на общепризнанные значительные достоинства эхографии, немало авторов сдержанно оценивают ее роль в диагностике ОП, особенно на ранних этапах заболевания. Ими либо не выделяется никаких достоверных интраренальных изменений до периода деструктивных проявлений, либо не предается им серьезного значения [4, 8, 31, 42, 43]. Так, A. Hoberman и соавт. (2003) на большом клиническом материале (309 детей с инфекцией МВП) в 88 % не установили на ранних стадиях заболевания каких-либо значимых эхографических интраренальных изменений [44]. Отдельные специалисты изначально подчеркивают условность предлагаемых ими же “эхографических” классификаций ОП, аргументируя это отсутствием точных морфологических верификаций воспалительного процесса в почках [45]. Выделяя и достаточно подробно описывая эхографические признаки отдельных интраренальных симптомов при ОП, в большинстве своем авторами не предлагается стройной концепции развития эхографической симптоматики как проявления единого эволюционирующего патологического процесса [30–37, 44, 45].
Таким образом, вопрос детальной клинической оценки интраренальных изменений при ОП в публикациях продолжает носить дискутабельный характер, что доказывается поздним поступлением детей в стационар, долгим и безуспешным лечением их от других заболеваний, большим количеством осложнений и высоким процентом хронизации. В большинстве случаев педиатры, детские нефрологи и урологи не располагают методами своевременного объективного подтверждения предполагаемой фазы ренальных изменений при ОП.
Анализ литературы подтверждает приоритет ультразвукового метода в оценке состояния почек детей на разных стадиях их воспалительной трансформации. Однако работы с представлением подобных концепций немногочисленны, подтверждают отсутствие единых установок относительно объективной оценки различных по значимости эхографических признаков ОП. Не прослеживаются также общепринятые концепции ультразвуковой семиотики ОП, включая ранние предеструктивные проявления заболевания. В практике детской уронефрологии клиницисты нередко продолжают ориентироваться в основном на инвазивные, не безразличные для ребенка, но объективно малоинформативные рентгенологические методы.
Все это диктует необходимость дальнейших разработок в области эхографии почек с целью оптимизации диагностики при ОП и его осложнениях у детей. Опыт собственных исследований позволяет представить результаты оценки интраренальных структур у детей в норме и при проявлениях различных форм ОП, получаемых с помощью высокоразрешающей эхографии. Целенаправленное представление возможностей эхографической оценки нормальных интраренальных структур при использовании высокоразрешающих ультразвуковых технологий позволяет описать эхографическую семиотику ОП на основе изученных данных о фазах его патоморфогенеза с применением высокоразрешающих сканирующих систем и предложить методику эхографической оценки доминирующих интраренеальных изменений при ОП, которая может быть использована для своевременного выбора оптимального объема лечебных мероприятий и контроля результативности их применения.
Нами были обследованы 300 детей в возрасте от 5 суток жизни до 16 лет с различной степенью выраженности ОП по соответствующим клинико-лабораторным и эхографическим данным. Получаемые эхографические данные сопоставлялись с результатами других визуализирующих методов (РГ, КТ, цистоуретеропиелоскопия), а также с интраоперационными находками, данными макро- и микроскопических морфологических исследований. Контрольная группа (без проявлений уронефрологической патологии) составила 50 детей в возрасте от месяца до 14 лет.
Помимо этого проведено экстракорпоральное эхографическое исследование почек без макроскопических изменений от трупов 25 субъектов в возрасте от месяца до 16 лет, погибших в результате несчастных случаев, сопровождавшихся не совместимой с жизнью травмой.
УЗИ проводились с использованием систем ACUSON/Sequoia-512 , Philips JU22 и Mindrаy 7M, оснащенных мультичастотными датчиками до 6–17 МГц. Методика эхографической оценки почек в острой фазе заболевания представляла собой полипозиционное многоосевое сканирование интра- и параренальных структур с интервалом, определенным скоростью развития патологических изменений. Минимальный интервал – 4 часа, максимальный – 2 суток (при условии проведения не менее 4 сеансов УЗИ).
Изучение нормальных ренальных структур у детей контрольной группы, а также результаты экстракорпоральной эхографии почек заставили полностью отказаться от нередко рекомендуемой до сегодняшнего дня методики сравнения рисунка нормальной и измененной почечной паренхимы с паренхимой печени или селезенки [46].
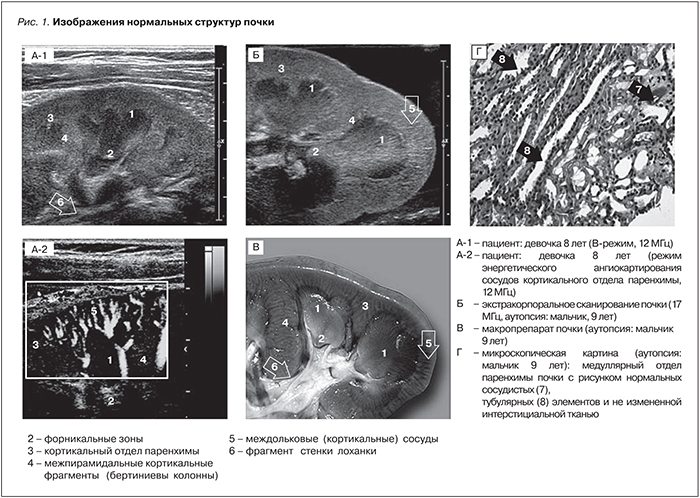
Рисунок структур нормальной почки при визуализации с использованием соответствующих ультразвукового прибора, датчиков и режимов сканирования имеет присущую только ей и не сравнимую с другими паренхиматозными органами эхографическую картину. В этой картине четко выделяются изображения форникальных элементов, тубуломезенхимальных комплексов пирамид, кортикальной ткани с междольковыми сосудами, включая субкапсулярные фрагменты последних. В сумме перечисленные элементы при сканировании почки составляют на экране (безусловно с учетом плоскости сканирования) специфическую эхографическую текстуру с определенной совокупностью характерных теневых градаций и для каждого тканевого участка, и для органа в целом (рис. 1).
Изменение этих присущих изображению почки всегда теневых градаций зависит в первую очередь от наличия изменений морфологического субстрата. Необходимо учитывать специфичность и распространенность выявляемых изменений относительно конкретного патологического процесса, равно как и от фазы его развития. Современные ультразвуковые технологии позволили отмечать эти изменения на уровне сосудисто-тканевого региона и сопоставлять их с эволюционирующими морфологическими проявлениями ОП. То есть эхография позволила выявлять признаки последовательно развивающихся изменений соответственно основным фазам патологического процесса – альтерации, сосудисто-тканевой реакции и регенерации.
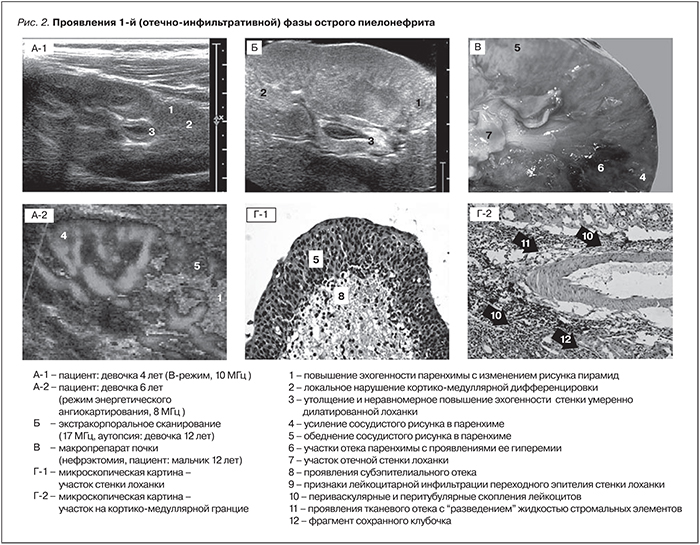
Первый признак воспалительно-альтеративных проявлений в виде ранней сосудисто-тканевой реакции отмечается появлением неравномерного повышения эхогенности на отдельных участках паренхимы почки. Это хорошо прослеживается в зонах пирамид, как правило, за счет их изначальной гипоэхогенности по сравнению с кортикальным отделом и межпирамидальными участками (бертиниевыми колоннами). Вследствие чего рисунок пирамид теряет свою треугольную форму, которая становится “ломаной”, “срезанной”, “неправильной” и т. п. На отдельных участках паренхимы начинает также нарушаться кортико-медуллярная дифференцировка за счет слияния участков необычно повышенной эхогенности пирамид с кортикальными тканевыми фрагментами, изначально имеющими подобную эхогенность (рис. 2: А-1, Б).
Причины отмечаемого повышения эхогенности – разворачивающиеся изменения и в паренхиматозно-стромальных элементах, и в межклеточном веществе. Это в первую очередь появление различной степени выраженности интерстициальной (периваскулярной и перитубулярной) лейкоцитарной инфильтрации. Неравномерное экстравазальное скопление лейкоцитов “уплотняет” интерстиций с соответствующим возрастанием его акустического импеданса (рис. 2: Г-1, Г-2).
Вторая причина изначального увеличения эхогенности интраренальных тканей – появление отека с изменением степени гидратации межклеточного вещества. Увеличение при отеке объема жидкости в межклеточном пространстве “разводит” между собой отдельные стромальные элементы. От увеличенных за счет заполнения жидкостью микроскопических межклеточных пространств, очевидно не различимых по отдельности вследствие недостаточности разрешения при ультразвуковом сканировании, формируется множество эхосигналов. Совокупность этих сливающихся отражений отображается на экране сканера участками повышенной эхогенности. (рис. 2: Г-2). Ситуацию условно можно сравнить с вариантом поликистоза почек т. н. инфантильного типа, когда множество компактно расположенных мелких кист по всему объему паренхимы при недостаточной разрешающей способности сканера сливаются в картину “диффузного повышения эхогенности паренхимы”.
Изначальные проявления воспалительного отека помимо неравномерного повышения эхогенности тканей отмечаются в утолщении стенок коллекторных фрагментов почки, в частности стенок лоханки. Степень утолщения может быть различной – и совсем невыраженной на отдельных участках, и значительной на всех визуализируемых фрагментах (рис. 2: А-1, Б, Г-1).
Таким образом, изначальные ультразвуковые проявления в виде повышения эхогенности интраренальных тканей и утолщения стенок коллекторных фрагментов всегда соответствуют морфологическим изменениям, сопровождающим начальные признаки ОП. Это позволяет выделять первую эхографическую фазу начальных проявлений заболевания, определив ее как отечно-инфильтративную.
Обозначив эту фазу, следует подчеркнуть очень важные в клиническом плане моменты.
Во-первых. Инфильтративные проявления в паренхиме почки в виде участков неравномерного повышения эхогенности могут отмечаться еще до признаков отека стенок лоханки. Очевидно, подобные ситуации формально не позволяют делать эхографическое заключение о наличии ОП, а лишь об имеющихся “отечно-инфильтративных воспалительных проявлениях в паренхиме” (или “реактивных отечно-инфильтративных интерстициальных проявлениях”). Однако факты невыраженного проявления или даже отсутствие признаков воспалительных изменений почечной лоханки на самых ранних стадиях развития ОП хорошо известны морфологам [23, 24]. Важно учитывать, что появление развивающихся эхографических признаков отечно-инфильтративных изменений независимо от изначального поражения конкретных интраренальных тканей само по себе является угрозой быстрого развития процесса с возможной в ближайшее время воспалительной деструкцией.
Во-вторых. Изначальные отечно-инфильтративные проявления в этой первой одноименной фазе можно считать минимальными. Еще не отмечается трансформаций клубочков ишемического генеза. На эхограммах (при использовании технологий допплерангиографии) это отражается иногда обедненным (вследствие периваскулярного отека), но сохранным сосудистым рисунком, в т. ч. в кортикальных отделах паренхимы. Более того, у части пациентов имеет место усиление сосудистого рисунка (проявление воспалительной гиперемии) (рис. 2: А-2). Отсутствие значимых ишемических проявлений позволяет считать рассматриваемую фазу острого процесса полностью обратимой. Имеется в виду возможность полного восстановления морфологии структур и, соответственно, эхографического изображения нормальной почечной ткани. Однако подобный благоприятный исход наблюдается при исключении условий прогрессирования процесса.
При наличии сохраняющихся причин, а также различных вариантов их комбинаций (снижение иммунитета, развивающаяся острая интра- или экстраренальная обструкция МВП, активность первичного септического очага, развитие процесса в диспластичной ткани, неадекватная терапия и т. д.) отмечается отрицательная эхографическая динамика, проявляющаяся следующими признаками.
Прослеживаются эхопризнаки распространения отечно-инфильтративных проявлений вплоть до тотального поражения почки с изменением ее размеров и формы. При этом кортико-медуллярная дифференцировка может отсутствовать на всех визуализируемых участках органа. Параллельно не исключен вариант распространения отечно-инфильтративных воспалительных проявлений на паранефральные ткани. Однако подобная ситуация прослеживается не всегда. Чаще значительным прогрессирующим изменениям подвергается один или несколько участков, что, очевидно, связано с неравномерной выраженностью сосудистой обструкции вследствие периваскулярных отеков в различных фрагментах пораженного органа.
Нарастающие стромально-сосудистые изменения – второй признак отрицательной морфологической и, соответственно, интраорганной эхографической динамики. Увеличивается объем лейкоцитарной и лимфоцитарной инфильтрации. Их массивные конгломераты объясняют еще большее усиление эхогенности в отмечаемых на УЗИ очагах воспалительной инфильтрации. В выявляемых участках наиболее повышенной эхогенности прослеживается значительное обеднение или даже отсутствие сосудистого рисунка (рис. 3: А, Б). Это говорит о том, что в участках с наиболее выраженными периваскулярными отечно-инфильтративными проявлениями процесс будет отличаться теперь ишемическим повреждением сосудистого генеза. Особенно уязвимы междольковые и афферентные артериолы. Прогрессирование ОП характеризуется также значительным изменением канальцев. Изначально отмечается их неравномерная (в зависимости от степени дистального перитубулярного отека) дилатация с дистрофическими проявлениями в эпителиоцитах (рис. 3: В). Именно выраженная дилатация отдельных тубулярных фрагментов до пределов разрешающей способности используемого сканера в совокупности с увеличением объема жидкостного компонента экссудата в интерстиции создает эхографический феномен т. н. гипоэхогенных фокусов (рис. 3: А). Выявление этих очень малых по размеру (изначально до 2–3 мм) гипоэхогенных участков в паренхиме почки на фоне других обозначенных прогрессирующих изменений позволяет говорить о т. н. предеструктивной фазе.
Предеструктивная фаза отличается своей кратковременностью – от нескольких часов до 1,0–1,5 суток. Отсутствие своевременного лечебного пособия, направленного в первую очередь на разрешение интраренальной (тубулярной) обструкции, а также на борьбу с тканевой ишемией, способствует весьма быстрому развитию уже деструктивных тканевых проявлений, которые можно также дифференцировать эхографически, объединив в последующую (деструктивную) фазу.
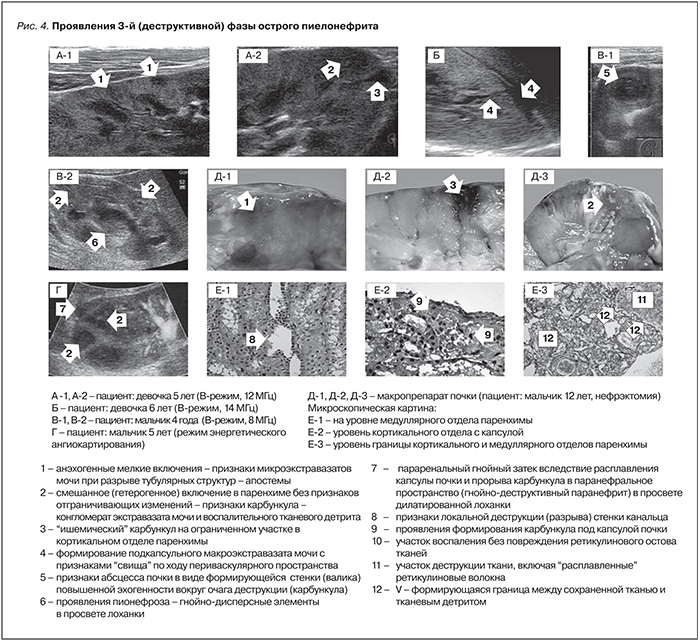
Деструктивная фаза ОП начинает проявляться признаками нарушения целостности стенок тубулярных структур. Как правило, это является следствием нарастания их обструкции при сохраняющейся клубочковой функции. При таких условиях канальцы, не выдерживая внутреннего гидродинамического давления на истонченные стенки, просто рвутся с излиянием мочи в интерстиций с образованием т. н. интраренальных экстравазатов [18, 23]. Чаще всего эти экстравазаты представляют собой апостемы – маленькие по размеру скопления излившейся мочи, смешанной с накопившейся в интерстиции лейкоцитарно-лимфоцитарной массой. Нередко в публикациях и клинической среде их называют “гнойничками”, или “маленькими гнойниками”, с чем можно согласиться лишь отчасти. Ибо помимо мочи и лейкоцитарно-лимфоцитарных скоплений они изначально не содержат клеточно-тканевого детрита. При использовании высокоразрешающей эхографии апостемы начинают быть различимыми при размерах от 1–2 мм (рис. 4: А-1, Д-1, Е-1).
Объем мочи в интерстиции может достаточно быстро нарастать и быть представлен уже не только апостемами – многочисленными, но мизерными по размеру включениями, а и значительными по объему жидкостными образованиями. На эхограммах они выявляются в виде анэхогенных включений (часто с дисперсным компонентом) различных размеров и формы, стремящихся к распространению по наиболее “податливым” участкам паренхимы. Нередко они формируют здесь своего рода мочевые свищи (рис. 4: Б). В первую очередь – в периваскулярных щелевых пространствах, далее – в подкапсульном пространстве почки [18].
Похожими по своей текстуре включениями различной формы и размеров выглядят на эхограммах карбункулы. Следует упомянуть, что этим термином в урологической практике традиционно обозначают два различных по своему морфогенезу состояния. Чаще именно у детей карбункул рассматривается как слившийся конгломерат апостем. Однако он отличается наличием не только первичной мочи с лимфоцитарной массой, но и присутствием тканевого детрита – фрагментов стромы и паренхимы с различной степенью их лизиса. Это объясняет не анэхогенный, а в большинстве своем смешанный по эхогенности характер карбункулов при их сканировании. От абсцесса и морфологически, и эхографически такой карбункул отличается отсутствием признаков демаркации – сформированной или хотя бы формирующейся границы в виде стенки (или валика) (рис. 4: А-2,В-2, Д-3, Е-2, Е-3).
Таким же термином – “карбункул” – принято обозначать зону отграниченной тканевой деструкции, как правило, специфической треугольной формы в кортикальном отделе почечной паренхимы. Причина формирования подобного карбункула – локальная сосудистая обструкция интра- или параваскулярного генеза с отстрой ишемией в конкретном сосудисто-тканевом участке (рис. 4: А-2, Д-2, Е-2).
Прогрессирование очагов интраренальной деструкции проявляется вовлечением в них все большей массы почечной паренхимы, а также степенью поражения стенок коллекторных фрагментов. В частности, локальная воспалительная деструкция стенки лоханки может приводить к ее перфорации с развитием т. н. пионефроза – скопления гноя в просвете коллекторных фрагментов почки, что хорошо выявляется в случаях их дилатации (рис. 4: В-2).
При деструкции капсулы почки отмечается распространение гнойного содержимого в паранефральные ткани с формированием здесь собственного параренального воспалительного очага в виде гнойной экссудации тканей (гнойный паранефрит) либо в виде гнойного паранефрального затека с тенденцией к формированию здесь абсцесса (рис. 4: Г).
Деструктивная фаза ОП кроме отмечаемой потери канальцев отличается от предшествующих этапов развития процесса серьезным повреждением клубочковых структур. Помимо признаков распространения воспалительного процесса на клубочки, отдельные проявления чего можно было отмечать и в предшествующей (предеструктивной) фазе, появляются признаки их разрушения вследствие ишемии с последующим т. н. ишемическим сморщиванием гломерул.
В клиническом и прогностическом плане очень важна степень распространенности любых из перечисленных признаков выделенных фаз развития ОП относительно объема почки. Результаты своевременного динамического УЗИ позволяют определять степень распространения патологического процесса:
- очаговые интраренальные изменения (одно- или двустороннее) – проявления ОП занимают не более половины объема почки;
- диффузные (тотальные) интраренальные изменения (одно- или двусторонние) – проявления распространения процесса более чем на половину почечного объема (сюда же включаются сопутствующие признаки паранефральных воспалительных изменений);
- генерализованные (или полиорганные) изменения – упоминается в случаях выявления вторичных острых воспалительных проявлений в других органах, что позволяет с помощью эхографии делать заключение об имеющихся признаках уросепсиса.
Не в малой степени именно распространенность процесса помимо других ранее перечисленных факторов (сопутствующие аномалии почек и МВП, сохраняющаяся интраренальная обструкция и т. д.) сказывается на финале репаративных процессов.
Собственно о фазе репарации (восстановления), точнее – о ее начале, можно говорить в отсутствие в первую очередь эхографических признаков дальнейшего распространения органных изменений. Протяженность этой фазы и прогноз последствий для пораженной почки зависят именно от распространенности и выраженности имеющихся предшествующих ей изменений.
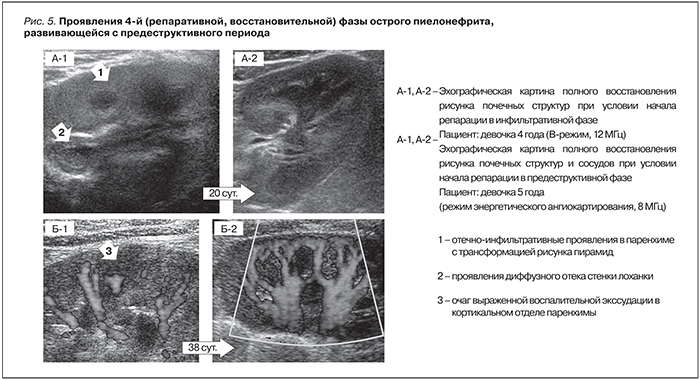
В случаях, когда репарация начинается в инфильтративной или даже предеструктивной фазе, обычно в течение 1–3 месяцев процесс заканчивается полным восстановлением рисунка структур и их взаимоотношений (рис. 5: А-1, А-2, Б-1, Б-2). Морфологически это объясняется сохранностью стромального “скелета”, который остается основой для восстановления на нем новых эпителиальных элементов.
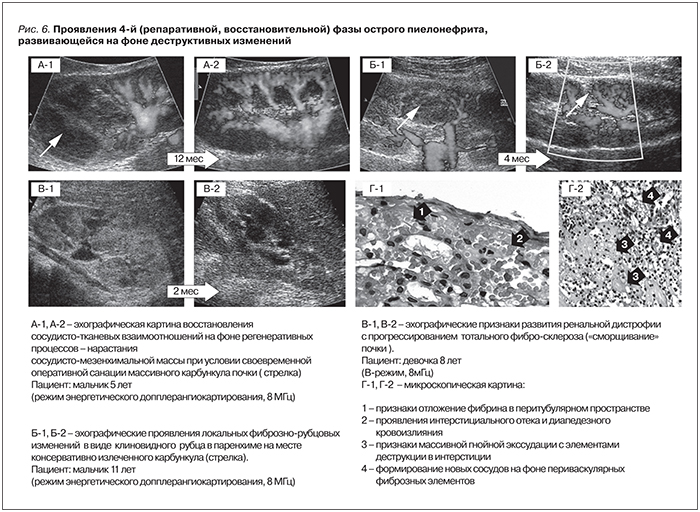
В случае имевших место очаговых деструктивных изменений при условии адекватной терапии и сохранности ретикулярной тканевой основы отмечается восстановление рисунка почечных структур за счет регенерации сосудисто-мезенхимальной массы (рис. 6: А-1, А-2, Г-2). Чаще на фоне полного клинического выздоровления в почке отмечаются участки стойкого повышения эхогенности. Эти участки расцениваются как зоны фиброзных проявлений различной степени выраженности: от элементов умеренного перитубулярного, перигломерулярного и периваскулярного фиброза до массивных рубцов без, естественно, перспективы восстановления здесь морфофункциональных элементов (рис. 6: Б-1, Б-2, Г-1).
Значительные деструктивные изменения с разрушением ретикулярного остова могут заканчиваться более серьезными изменениями. Так, ишемические повреждения сосудистого происхождения приводят к необратимым сосудисто-клубочковым изменениям. Помимо перигломерулярного фиброза отмечаются проявления коллагенизации внутрикапсулярного пространства, запустевание и гиалиноз петель капилляров.
К концу репаративной фазы эхографическая картина нефросклероза целиком зависит от имевшей место распространенности процессов деструкции: от локальных рубцовых проявлений в виде аваскулярных участков стойкого повышения эхогенности с деформацией контуров почки по типу втяжения до проявлений тотального нефросклероза (рис. 6: Б-1, Б-2, Г-1). Последний отличается признаками т. н. вторичного сморщивания почки – прогрессирующего уменьшения органа в размерах на фоне проявлений тотальной ишемии в виде нарастающего неравномерного обеднения или отсутствия интраренального сосудистого рисунка (3,8 % случаев в группе пациентов с гнойно-деструктивнм пиелонефритом) (рис. 6: В-1, В-2).
В единичных случаях последствием воспалительно-деструктивных трансформаций тубулярных элементов отмечались признаки формирования небольших стойких кистозных включений в медуллярном отделе паренхимы (1,3 %).
При эхографической оценке интра- и параренальных структур, сопровождающих ОП, помимо перечисленных постоянных стадийных проявлений отмечаются другие непостоянные изменения, которые можно обобщить в группу косвенных (табл. 1). Наличие, количество и комбинация косвенных признаков, их выраженность и распространенность не всегда зависят от тяжести проявления острого воспаления в почке. Без соотношения с постоянными (достоверными) признаками они не представляют объективной информации о наличии и выраженности рассматриваемого патологического процесса. Значение косвенных признаков возрастает лишь в сочетании с достоверными, основанными на сопоставлении с эволюционирующими морфологическими проявлениями ОП.
Таким образом, данные эхоморфологического анализа интраренальных фазовых изменений при ОП, а также оценка скорости их развития и распространенности позволяют выделять д о м и н и р у ю щ и е на момент проведения УЗИ изменения. Имеются в виду изменения, определяющие общую тенденцию развития патологического процесса и прогноз для пациента в целом. Возможно определить доминирование, например, ишемических проявлений или признаков интраренальной мочевой обструкции, либо развитие и распространение гнойно-деструктивного повреждения тканей. Очевидно, нарастание (в течение нескольких часов) одного из перечисленных достоверных признаков определяет его ведущим фактором в прогрессировании патологического процесса. И наоборот, отсутствие признаков его распространения и развития говорит о положительной локальной динамике или по крайней мере о ее начале.
Таким образом, своевременная диагностика ОП с оценкой стадий воспалительного процесса в почке остается сложной клинической задачей. Наиболее объективным и безвредным для пациентов методом оценки состояния почечных структур при подозрении на ОП у детей можно считать динамическое УЗИ с применением высокоразрешающего оборудования, обеспечивающего оценку эволюции изменений структур на уровне сосудисто-тканевого региона. Применение высокоразрешающего динамического эхографического исследования позволяет получать данные о наличии, локализации, стадии, распространенности и эволюции воспалительного процесса при ОП. Выделяемые как достоверные, эхографические изменения структур и стадийность их развития ассоциируются исключительно с фазовыми проявлениями патоморфогенеза заболевания. Не отмечено зависимости этих изменений от пола и возраста пациентов, а также имеет ли место первичная атака пиелонефрита или отмечается обострение хронического процесса? Это позволяет говорить об ультразвуковой семиотике ОП, подразумевающей эхографические фазы ренальных изменений: инфильтративную, предеструктивную (экссудативную), деструктивную и репаративную (восстановительную). Знание эхографической семиотики различных фаз ОП позволяет получать оперативные данные о доминирующих локальных морфо-гемодинамических нарушениях на момент проведения УЗИ. С учетом быстрого развития у детей очаговых и генерализованных изменений на фоне множества клинических масок пиелонефрита это может иметь принципиальное значение в своевременном определении органосохраняющей тактики. Внедрение методики эхографической оценки доминирующих интраренальных изменений при ОП позволило значительно снизить количество радикальных операций (на 76 %), в т. ч. и при активно локализованных гнойно-деструктивных формах заболевания.



