Введение
Трансплантация почки (ТП) является оптимальным методом лечения пациентов с хронической болезнью почек 5-й стадии (терминальной стадией хронической почечной недостаточности), поскольку обеспечивает не только более высокую выживаемость больных по сравнению с гемо- и перитонеальным диализом, но и более полную медицинскую, социальную и психологическую реабилитацию [1, 2]. Однако посттрансплантационные осложнения (сердечно-сосудистые, инфекционные, онкологические) могут быть причиной смерти пациентов с функционирующим почечным аллотрансплантатом (ПАТ), сокращать сроки функционирования трансплантированной почки, существенно ухудшать качество жизни пациентов.
Цитомегаловирусная инфекция (ЦМВ-инфекция) является одним из наиболее значимых инфекционных осложнений в клинической трансплантологии. Цитомегаловирус (ЦМВ) относится к типичным микроорганизмам – «оппортунистам», вызывающим у человека заболевание только при подавлении иммунитета. Наиболее высок риск развития ЦМВ-болезни у серонегативных реципиентов ПАТ, получивших почку от серопозитивных доноров (Донор+/Реципиент-), а также у пациентов, которым проводится усиленная иммуносупрессивная терапия, например введение анти-T-лимфоцитарных антител для лечения криза отторжения. В то же время недавно было показано, что в случае «Донор+/Реципиент+» нередко возникает поздняя ЦМВ-болезнь с высокой летальностью [3].
К прямым эффектам ЦМВ относятся ЦМВ-синдром (виремия, общая слабость, повышение температуры тела, лейкопения, тромбоцитопения) и инвазивная ЦМВ-болезнь, поражающая органы и ткани [4]. ЦМВ-болезнь в отсутствие специфической противовирусной терапии или несвоевременном ее начале может стать причиной смерти пациента. Чаще всего больные с ЦМВ-болезнью погибают от тяжелой дыхательной недостаточности, ассоциированной с ЦМВ-пневмонитом. Большое клиническое значение имеют и т. н. непрямые эффекты вируса: способность провоцировать острое и хроническое отторжение трансплантата, развитие других тяжелых оппортунистических инфекций и посттрансплантационного сахарного диабета; повышать риск сердечно-сосудистых осложнений у реципиентов ПАТ [5–8].
Ранее частота активной ЦМВ-инфекции после ТП составляла в различных центрах от 30 до 80 %, а ЦМВ-болезнь развивалась у 30–60 % больных. В XXI в. частота ЦМВ-инфекции существенно снизилась в связи с широким внедрением в трансплантологическую практику специфической профилактики. С целью предупреждения инфекции применялись ганцикловир в/в или перорально, оральный валацикловир, ЦМВ-специфический иммуноглобулин. Сейчас широкое распространение получил валганцикловир (ВГЦ), обладающий высокой биодоступностью и эффективностью при приеме per os и удобный для применения.
До недавнего времени акцент делался на предотвращении ранней ЦМВ-болезни, и по этой причине продолжительность профилактики обычно не превышала 3 месяцев [9]. Но возможно и позднее появление активной репликации вируса – более чем через 3 месяца после операции. Поздние эпизоды ЦМВ-инфекции сложны для диагностики из-за неспецифичной или атипичной симптоматики, а также сопровождаются повышенной летальностью [10–12]. Для определения оптимальной продолжительности профилактики ЦМВ-инфекции у реципиентов ПАТ с высоким риском ЦМВ-инфекции было проведено крупное международное двойное слепое рандомизированное контролируемое исследование IMPACT 200, которое показало, что применение ВГЦ в течение 200 дней по сравнению со 100-дневной профилактикой достоверно снижало частоту ЦМВ-болезни и ЦМВ-виремии в течение 12 месяцев после трансплантации [13]. Исследователи из США показали также экономическую эффективность 6-месячной профилактики ЦМВ-инфекции с помощью ВГЦ у больных после ТП [14].
Настоящее одноцентровое исследование было проведено для оценки эффективности профилактики активной ЦМВ-инфекции в посттрансплантационном периоде препаратом валганцикловир у больных, которым была выполнена трансплантация почки в Центре трансплантации и диализа МОНИКИ им. М.Ф. Владимирского.
Материал и методы
В одноцентровое ретроспективное исследование были включены 349 пациентов с терминальной ХПН, которым была выполнена ТП в Центре трансплантации и диализа МОНИКИ им. М.Ф. Владимирского. Доноры органов были серопозитивными по ЦМВ (имели анти-ЦМВ антитела IgG в сыворотке крови) в 100 % случаев, а среди 349 реципиентов, вошедших в исследование, серопозитивными были 93 %. Таким образом, самым частым сочетанием серологических статусов было следующее: Донор+/Реципиент+.
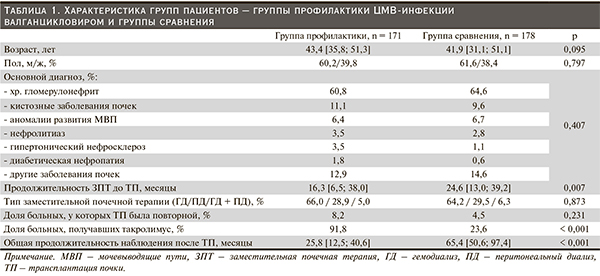
 В нашем центре плановая профилактика ЦМВ-инфекции валганцикловиром (ВГЦ) была начата в 2010 г., поэтому в исследуемую группу (группа профилактики – гр. 1) были включены больные (171 человек), оперированные в 2010 г. и позднее, а 178 пациентов, получивших почечный аллотрансплантат (ПАТ) ранее 2010 г., составили группу сравнения – гр. 2. Всем пациентам была выполнена ТП от умерших доноров. Все больные обеих групп получали в посттрансплантационном периоде иммуносупрессивную терапию, включавшую ингибитор кальцинейрина (такролимус в стартовой дозе 0,13–0,18 мг/кг/сут или циклоспорин А в начальной дозе 5 мг/кг/сут) и препарат группы микофенолатов (микофенолата мофетил или микофенолат натрия) в стандартной дозе; на фоне приема такролимуса доза микофенолатов уменьшалась в 2 раза с 15-го дня после трансплантации. Большинство реципиентов ПАТ принимали также кортикостероиды – преднизолон перорально в начальной дозе 30 мг/сут с последующим постепенным снижением дозы до поддерживающей – 5–10 мг/сут. В группе профилактики 13 пациентов не принимали стероиды в составе поддерживающей иммуносупрессии, в группе сравнения преднизолон получали все больные.
В нашем центре плановая профилактика ЦМВ-инфекции валганцикловиром (ВГЦ) была начата в 2010 г., поэтому в исследуемую группу (группа профилактики – гр. 1) были включены больные (171 человек), оперированные в 2010 г. и позднее, а 178 пациентов, получивших почечный аллотрансплантат (ПАТ) ранее 2010 г., составили группу сравнения – гр. 2. Всем пациентам была выполнена ТП от умерших доноров. Все больные обеих групп получали в посттрансплантационном периоде иммуносупрессивную терапию, включавшую ингибитор кальцинейрина (такролимус в стартовой дозе 0,13–0,18 мг/кг/сут или циклоспорин А в начальной дозе 5 мг/кг/сут) и препарат группы микофенолатов (микофенолата мофетил или микофенолат натрия) в стандартной дозе; на фоне приема такролимуса доза микофенолатов уменьшалась в 2 раза с 15-го дня после трансплантации. Большинство реципиентов ПАТ принимали также кортикостероиды – преднизолон перорально в начальной дозе 30 мг/сут с последующим постепенным снижением дозы до поддерживающей – 5–10 мг/сут. В группе профилактики 13 пациентов не принимали стероиды в составе поддерживающей иммуносупрессии, в группе сравнения преднизолон получали все больные.
Пациенты группы профилактики получали планово ВГЦ (Вальцит®) с 10-го дня после операции в дозе 900 мг/сут при скорости клубочковой фильтрации (СКФ) ≥ 60 мл/мин, при сниженной СКФ доза препарата снижалась в соответствии с инструкцией к препарату. Продолжительность приема ВГЦ составляла от 3 до 6 месяцев, при этом у части больных были пропуски в приеме из-за перебоев в снабжении препаратом. При выявлении репликации ЦМВ (наличия ДНК вируса в крови) в сочетании с клиническими симптомами или без них пациентам обеих групп назначался ганцикловир в/в (Цимевен®) или ВГЦ в лечебной дозе (пациентам группы профилактики доза повышалась до лечебной, если репликация ЦМВ выявлялась на фоне продолжающегося профилактического приема ВГЦ. Отдельным пациентам группы сравнения, получавшим антилимфоцитарные антитела с целью лечения острого отторжения, проводилась профилактика в/в ганциковиром во время терапии отторжения – в течение 10–14 дней.
Характеристика пациентов групп профилактики и сравнения представлена в табл. 1. Из таблицы видно, что группы не различались по возрасту пациентов, полу, основному диагнозу (причине терминальной ХПН), типу заместительной почечной терапии (ЗПТ) до ТП, доле больных, у которых ТП была повторной.
В то же время в силу ретроспективного характера исследования изменения политики иммуносупрессивной терапии в нашем центре и особенностей формирования групп (больные группы сравнения были оперированы раньше) у пациентов группы профилактики по сравнению с больными группы сравнения была достоверно меньше продолжительность ЗПТ до трансплантации (16,3 [6,5; 38,0] и 24,6 [13,0; 39,2] месяца соответственно, p = 0,007) и продолжительность наблюдения после ТП (25,8 [12,5; 40,6] и 65,4 [50,6; 97,4] месяца соответственно, p < 0,001). В группе профилактики было больше реципиентов, получавших такролимус, – 91,8 против 23,6 % в группе сравнения, p < 0,001.
В обеих группах была проанализирована частота развития активной ЦМВ-инфекции в целом за 12 месяцев после ТП, частота бессимптомной репликации ЦМВ, ЦМВ-синдрома и инвазивной ЦМВ-болезни за 12 месяцев, частота выявления репликации других герпетических вирусов (вирусов простого герпеса 1-го и 2-го типов, вируса varicella-zoster, вируса Эпштейна–Барр, вирусов герпеса человека 6-го и 7-го типов), частота кризов отторжения, всех инфекционных осложнений, доля больных, погибших с функционирующим трансплантатом за указанный период наблюдения после ТП. Бессимптомная репликация ЦМВ констатировалась при выявлении ДНК вируса в крови, не сопровождавшемся какой-либо клинической симптоматикой и/или изменениями состава периферической крови. ЦМВ-синдром определялся как виремия в сочетании с лихорадкой, общей слабостью, лейкопенией или тромбоцитопенией. Инвазивной ЦМВ-болезнью считалась активная репликация вируса в сочетании с пневмонитом, гепатитом, поражением желудочно-кишечного тракта, ПАТ.
Все случаи отторжения подтверждались морфологическим исследованием биоптатов трансплантированной почки в лаборатории морфологической диагностики Московского городского нефрологического центра. ДНК вирусов в крови определялась с помощью полимеразной цепной реакции (ПЦР) с частотой 1 раз в 1–2 месяца в лаборатории диагностики СПИД и вирусных гепатитов МОНИКИ им. М.Ф. Владимирского, а также в лаборатории молекулярной диагностики Института молекулярной генетики РАН.
При статистической обработке данных показатели с распределением, отличающимся от нормального, описывались при помощи медианы и квартилей – Me [25 %; 75 %]; качественные показатели – в долях (процентах) либо в абсолютных значениях. Межгрупповой анализ данных проведен с помощью критерия Манна–Уитни. При сравнении частотных показателей применен критерий χ2 или точный критерий Фишера. Выживаемость реципиентов и трансплантатов оценивалась с помощью метода Каплана–Мейера с построением кривых выживаемости. При расчете бессобытийной выживаемости событием считались потеря трансплантата, смерть реципиента, острое отторжение, ЦМВ-синдром и инвазивная ЦМВ-болезнь (но не бессимптомная репликация вируса), другие серьезные инфекционные осложнения (пиелонефрит ПАТ, пневмония, раневая инфекция, сепсис), посттрансплантационные онкологические заболевания, сердечно-сосудистые осложнения (инфаркт миокарда, инсульт, серьезные нарушения сердечного ритма, тромбоз глубоких вен, тромбоэмболия легочной артерии). В качестве критического уровня достоверности различий был принято значение 0,05.
Результаты и обсуждение
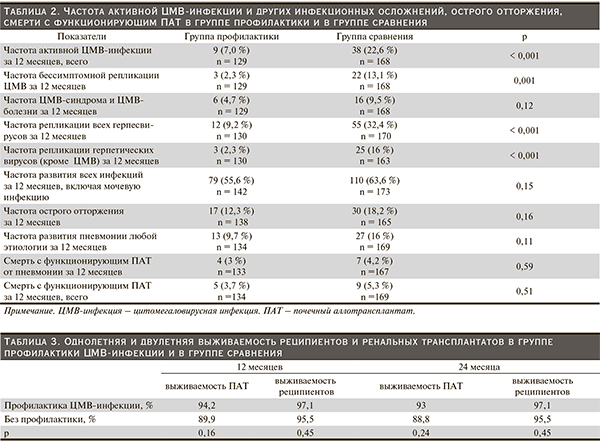
В группе профилактики частота активной ЦМВ-инфекции в целом (включавшей бессимптомную репликацию вируса, ЦМВ-синдром и инвазивную ЦМВ-болезнь) за первые 12 месяцев посттрансплантационного периода была достоверно ниже по сравнению с группой пациентов, не получавших профилактику, – 7,0 и 22,6 % соответственно, p < 0,001 (табл. 2).
Частота бессимптомной репликации также была значимо ниже в гр. 1 по сравнению с гр. 2 – 2,3 и 13,1 %, p = 0,001. Частота ЦМВ-инфекции с клиническими симптомами (ЦМВ-синдрома и инвазивной ЦМВ-болезни) была меньше в группе профилактики, однако различия с группой сравнения не достигали степени статистической достоверности: 4,7 и 9,5 %, p = 0,12. Вероятно, отсутствие достоверных различий объясняется невысокой частотой данного осложнения и недостаточным числом пациентов в группах.
 Обращает на себя внимание достоверное влияние профилактики на частоту других герпетических инфекций, вызванных вирусами простого герпеса, varicella-zoster, вируса Эпштейна–Барр: частота репликации всех герпетических вирусов (включая ЦМВ) и репликации герпес-вирусов (кроме ЦМВ) за 12 месяцев после ТП была более низкой в группе 1 по сравнению с группой 2: 9,2 и 32,4 %, p < 0,001 и 2,3 и 16 %, p < 0,001.
Обращает на себя внимание достоверное влияние профилактики на частоту других герпетических инфекций, вызванных вирусами простого герпеса, varicella-zoster, вируса Эпштейна–Барр: частота репликации всех герпетических вирусов (включая ЦМВ) и репликации герпес-вирусов (кроме ЦМВ) за 12 месяцев после ТП была более низкой в группе 1 по сравнению с группой 2: 9,2 и 32,4 %, p < 0,001 и 2,3 и 16 %, p < 0,001.
Группы не различались достоверно по частоте всех инфекций, острого отторжения, смерти с функционирующим трансплантатом от любой причины и смерти с функционирующим трансплантатом от пневмонии. Однако отмечена тенденция к меньшей частоте развития пневмоний любой этиологии в группе профилактики по отношению к группе сравнения: частота пневмоний за 12 месяцев после трансплантации составила 9,7 % в гр. 1 и 16 % в гр. 2, p = 0,11. Это важно, так как пневмонии, особенно полиэтиологичные, являются одним из самых серьезных осложнений у реципиентов ПАТ, нередко угрожающих жизни больных, требующих госпитализации пациентов, длительного и дорогостоящего лечения.
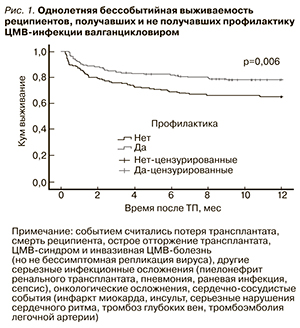
Одно- и двухлетняя выживаемость и реципиентов, и почечных трансплантатов была достаточно высокой в обеих группах (табл. 3). Все эти показатели были несколько выше в группе профилактики, однако межгрупповые различия не были статистически достоверными.
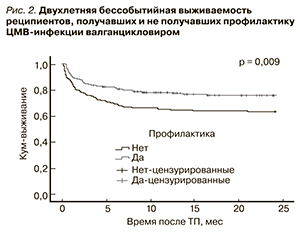
Была рассчитана бессобытийная выживаемость реципиентов в обеих группах. Оказалось, что однолетняя бессобытийная выживаемость реципиентов, получавших ВГЦ, составила 78,4 % по сравнению с 65,2 % в группе реципиентов, не получавших плановую профилактику ЦМВ-инфекции, p = 0,006 (рис. 1). Двухлетняя бессобытийная выживаемость также была достоверно лучше в группе профилактики по отношению к группе сравнения: 76,6 против 63,5 %, p = 0,009 (рис. 2).
Наше исследование показало положительное влияние профилактики ВГЦ на результаты трансплантации почки, хотя оно имеет и определенные недостатки: во-первых, проведенное исследование было ретроспективным, во-вторых, группы изначально различались по некоторым важным характеристикам. Так, в группе профилактики была достоверно выше доля пациентов, получавших более мощный по сравнению с циклоспорином А иммуносупрессивный препарат – такролимус, и это могло повлиять на бессобытийную выживаемость. Однако снижение в группе профилактики частоты активной ЦМВ-инфекции и тенденция к снижению частоты пневмоний любой этиологии даже на фоне более интенсивной иммуносупрессии свидетельствуют об эффективности профилактического применения ВГЦ. К сожалению, у некоторых пациентов группы профилактики из-за перебоев с получением препарата были пропуски его приема, что могло негативно отразиться на результатах профилактики. Также не у всех пациентов по указанным выше причинам была достигнута оптимальная для реципиентов ренального трансплантата продолжительность профилактического приема ВГЦ – 6 месяцев после трансплантации. Тем не менее полученные результаты свидетельствуют об эффективности профилактики с помощью ВГЦ активной ЦМВ-инфекции у реципиентов ПАТ, что совпадает с результатами ранее проведенных исследований [13, 15]. В нашем центре частота ЦМВ-инфекции была даже более низкой, чем в исследовании IMPACT 200, что объясняется, по-видимому, тем, что наши реципиенты в большинстве своем были серопозитивными до трансплантации.
Заключение
Проведенное исследование продемонстрировало высокую эффективность плановой профилактики ЦМВ-инфекции валганцикловиром у реципиентов трансплантированной почки: достоверное снижение частоты активной ЦМВ-инфекции в течение 12 месяцев после трансплантации, тенденция к меньшей частоте развития пневмоний любой этиологии, повышение одно- и двухлетней бессобытийной выживаемости реципиентов.