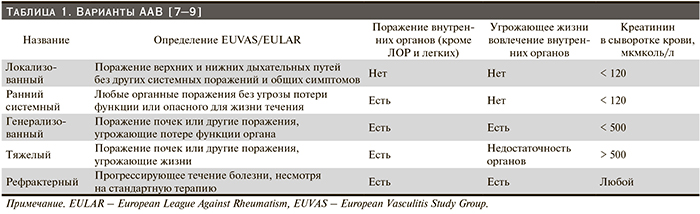
АНЦА-ассоциированные васкулиты (ААВ) – группа заболеваний, которая характеризуется наличием воспалительного поражения сосудов мелкого и среднего калибра и частым обнаружением антинейтрофильных цитоплазматических антител (АНЦА). К ААВ относят гранулематоз с полиангиитом (Вегенера), микроскопический полиангиит и эозинофильный гранулематоз с полиангиитом (Черга–Страусс) [1, 2]. ААВ – угрожающие жизни заболевания, в отсутствие терапии смертность достигает 80 % к первому году болезни [3]. Стандартная иммуносупрессивная терапия включает назначение комбинации высоких доз глюкокортикоидов и цитостатиков (чаще всего циклофосфамида) для индукции ремиссии с заменой последнего на азатиоприн или метотрексат для поддержания ремиссии [4–6]. В зависимости от распространенности и тяжести органных поражений выделяют несколько вариантов ААВ (табл. 1), различающихся в т.ч. по объему иммуносупрессивной терапии (табл. 2).
Эффективность стандартной терапии подтверждена в клинических исследованиях (результаты обобщены в табл. 3), частота достижения ремиссии составляет 80–90 %, а смертность снизилась до 25 % к пятому году болезни, однако у многих пациентов возникают рецидивы и необходимо продолжительное иммуносупрессивное лечение [25–27].
Иммуносупрессивная терапия обладает многочисленными ранними и поздними нежелательными эффектами, которые могут утяжелять течение болезни, повреждение внутренних органов и прогноз. Несмотря на поддерживающую терапию, по крайней мере у 10 % пациентов ежегодно возникает рецидив [32]. Минимизация дозы и продолжительности приема глюкокортикоидов имеет ключевое значение для снижения риска инфекционных осложнений, сердечно-сосудистых заболеваний и других нежелательных эффектов, снижающих качество жизни [33, 34]. При этом следует помнить, что, по данным мета-анализа [35], полная отмена глюкокортикоидов сопровождается повышенным риском рецидива, однако оптимальная продолжительность и дозы препаратов для поддерживающей терапии не установлены.
Таким образом, наиболее актуальные проблемы традиционной неселективной иммуносупрессивной терапии обобщены в табл. 4.
В связи с потребностью улучшения исходов терапии ААВ продолжается активное изучение патогенеза этой группы заболеваний, в частности, продемонстрированы многочисленные изменения в функционировании В- и Т-лимфоцитов, нейтрофилов и комплемента (особенно альтернативного пути). Моноклональные антитела к CD20-рецепторам В-лимфоцитов (ритуксимаб) в настоящее время одобрены для использования при ААВ, продолжается активное изучение перспективных препаратов с более избирательным действием по сравнению с традиционными иммуносупрессивными средствами.
Терапия, направленная на В-лимфоциты
Наличие В-лимфоцитов в очагах воспаления [36, 37], корреляция активации В-лимфоцитов с активностью ГПА [38], эффективность ЦФ, относительно специфично воздействующего на В-лимфоциты [39], и значение аутоантител (АНЦА к миелопероксидазе/протеиназе-3) в патогенезе ААВ обосновывают возможность воздействия на В-лимфоциты. После получения очень обнадеживающих результатов в сериях наблюдений, ретроспективных исследованиях [40–45] было проведено два крупных рандомизированных исследования, в которых оценивалась эффективность ритуксимаба (РТМ) для индукции ремиссии у пациентов с впервые установленным диагнозом ААВ и при развитии рецидива. Оба исследования, RAVE [13] и RITUXVAS [14], продемонстрировали близкие показатели частоты достижения ремиссии в группах РТМ и ЦФ (в сочетании с высокой дозой ГК) у пациентов с впервые установленным диагнозом. В исследовании RAVE также было установлено, что РТМ превосходит ЦФ по эффективности в случае рецидивирующего течения ААВ. При этом различий по безопасности между группами РТМ и ЦФ установлено не было, что позволяет говорить о терапии высокими дозами ГК как о ключевом модифицируемом факторе нежелательных эффектов при ААВ.
РТМ как препарат индукции ремиссии предпочтителен при рецидивирующем течении ААВ и при впервые установленном диагнозе, когда ограничена возможность применения ЦФ. Результаты продолженного наблюдения в рамках исследования RAVE показывают, что один курс РТМ не уступает продолжительному лечению ЦФ с последующим переходом на прием АЗА в поддержании ремиссии на протяжении 18 месяцев [46]. При этом рецидивы могут возникать через 6–12 месяцев после индукционной терапии, особенно после восстановления В-лимфоцитов и повышения титра АНЦА, хотя необязательно [46, 47]. Оптимальная терапия для поддержания ремиссии после индукции РТМ в настоящее время не установлена. Ретроспективные исследования рецидивирующих ААВ свидетельствуют, что повторные введения РТМ снижают риск рецидива, при этом введения РТМ могут выполняться регулярно через равные интервалы времени (обычно каждые 6 месяцев) [47–50] или по факту повышения титра АНЦА, или возврата В-лимфоцитов [51]. Возможно, повторные введения РТМ части пациентов могут приводить к персистирующей гипогаммаглобулинемии и частым инфекциям. Опубликованы предварительные результаты рандомизированного исследования MAINRITSAN (NCT00748644), в котором проводилось сравнение двух вариантов поддерживающей терапии ААВ: приема АЗА в стандартной дозе и РТМ (по 500 мг в/в каждые 6 месяцев до 18 месяцев), которые свидетельствуют о превосходстве РТМ (обострения развились у 27 % больных в группе АЗА и у 3,6 % в группе РТМ) [52]. Продолжается исследование RITAZAREM (NCT01697267), в котором также оценивается эффективность и безопасность повторных введений РТМ через фиксированные промежутки времени при впервые установленном диагнозе и рецидивирующем течении ААВ.

Фактор активации В-лимфоцитов (BAFF) имеет важное значение для выживания и созревания этих клеток, его уровень повышен в сыворотке крови больных ГПА [38]. Он является мишенью для белимумаба (анти-BAFF антитела), зарегистрированного для лечения СКВ. Белимумаб в настоящее время исследуется как препарат, снижающий риск рецидива при ААВ в рамках исследования BREVAS (NCT0163623).
В качестве перспективного препарата может рассматриваться эпратузумаб, который представляет собой анти-CD22-моноклональные антитела. CD22 экспрессируется на поверхности зрелых В-лимфоцитов и выступает отрицательным регулятором трансдукции сигнала через B-клеточный рецептор. По механизму действия эпратузумаб является скорее иммуномодулирующим средством, т.к. вызывает анергию В-лимфоцитов, в меньшей степени – антителозависимую клеточную цитотоксичность и совсем не приводит к комплемент-зависимой цитотоксичности в отличие от РТМ, который разрушает В-лимфоциты посредством двух последних механизмов. В настоящее время представлены предварительные данные об эффективности эпратузумаба при СКВ [53, 54].
Терапия, направленная на Т-лимфоциты
При ААВ отмечаются функциональные нарушения регуляторных Т-лимфоцитов, а также экспансия эффекторных клеток памяти CD4+ Т-хелперов, способствующая локальному повреждению ткани и прогрессированию васкулита [55]; развитие тубулита, опосредованного Т-лимфоцитами, является независимым прогностическим фактором почечных исходов [56].
Абатацепт, который состоит из внеклеточного домена CTLA4 и Fc области иммуноглобулина, ингибирует ко-стимулирующий сигнал B7-CD28 и в последующем подавляет активацию Т-лимфоцитов. В настоящее время препарат одобрен для лечения ревматоидного артрита. В небольшом открытом исследовании (NCT00468208), включившем пациентов с рецидивом нетяжелого ГПА, было продемонстрировано частое достижение ремиссии при назначении абатацепта [57].
Алемтузумаб представляет собой анти-CD52-моноклональные антитела, зарегистрирован для лечения хронической лимфоцитарной лейкемии и Т-клеточной лимфомы. CD52 экспрессируется на зрелых лимфоцитах (как Т-, так и В-клетках) и макрофагах, которые разрушаются под действием алемтузумаба. В одном исследовании было продемонстрировано, что применение алемтузумаба может приводить к достижению стойкой ремиссии при ААВ [58], однако сильные иммуносупрессивные свойства алемтузумаба и высокий риск тяжелых нежелательных эффектов (особенно для пожилых и при наличии почечной недостаточности) ограничивают возможность его использования даже при рефрактерном течении ААВ.
Терапия, направленная на комплемент
Компоненты альтернативного пути активации комплемента, фактор В, фактор Р, С3d и мембраноатакующий комплекс обнаруживаются в клубочках и мелких кровеносных сосудах в образцах биопсии почки больных ААВ [59]. Еще одним аргументом является отсутствие болезни в модели МПА после «отключения» генов фактора В или С5 [60]. Недавно также продемонстрировано повышение уровня C5a в сыворотке крови и моче больных активным ААВ [61]. Таким образом, альтернативный путь активации комплемента имеет большое значение в патогенезе ААВ.

С5а представляет собой продукт расщепления С5 компонента комплемента, обладающего сильными хемотаксическими и анафилактическими свойствами. CCX168 – новый пероральный ингибитор рецептора С5а, который в настоящее время исследуется во II фазе клинического испытания CLEAR (NCT01363388) у больных активным гломерулонефритом в рамках ААВ (подтвержденным при биопсии или клинически).
Антицитокиновая терапия
Воспалительные цитокины служат важным компонентом развития болезни при ААВ. Фактор некроза опухоли-α (ФНО-α) связан с активностью болезни при ГПА, а блокада ФНО-α останавливает развитие экспериментального почечного васкулита [62]. Хотя небольшие исследования у пациентов с рефрактерным течением болезни показали обнадеживающие результаты [63, 64], однако рандомизированное исследование этанерцепта в добавление к стандартной терапии для достижения стойкой ремиссии при ГПА не смогло продемонстрировать эффективность по сравнению с плацебо [31]. В рамках пилотных исследований инфликсимаба и адалимумаба обсуждалась возможность снижения дозы ГК при использовании ингибиторов ФНО-α [65, 66], однако дальнейшего развития это направление не получило. Таким образом, в настоящее время ингибиторы ФНО-α не включены в рекомендации по терапии ААВ.
Другим важным воспалительным цитокином является интерлейкин-6; показано, что АНЦА индуцируют продукцию интерлейкина-6 эндотелиальными клетками in vitro [67], в отдельных наблюдениях продемонстрировано, что тоцилизумаб (моноклональные антитела к рецепторам интерлейкина-6) эффективен при МПА [68].
Недавно было установлено, что Th17-лимфоциты играют важную роль в развитии ААВ и ранних этапах образования гранулем при ГПА [55]. Интерлейкин-23 необходим для пролиферации Th17-лимфоцитов. Можно предположить, что устекимумаб (анти-интерлейкин-12/23р40-моноклональные антитела) окажется эффективным при ААВ, как при других аутоиммунных заболеваниях, связанных с Th17-лимфоцитами, например псориазе.
Другие возможные мишени
Бортезомиб – ингибитор протеасомы, воздействующий на плазмабласты и зрелые плазматические клетки, разрешен к применению при миеломной болезни. В мышиной модели заболевания, ассоциированного с АНЦА к миелопероксидазе, бортезомиб продемонстрировал сопоставимую с комбинацией ЦФ + ГК -эффективность в предотвращении развития некротизирующего гломерулонефрита с полулуниями и более выраженный эффект по снижению титра АНЦА к миелопероксидазе [69]. Некоторые плазматические клетки существуют на протяжении лет, что может объяснять продолжительное сохранение повышенного уровня АНЦА, иногда наблюдаемое после деплеции В-лимфоцитов.

Натализумаб – анти-α4-интегрин-моноклональные антитела, разрешенные для лечения рассеянного склероза и болезни Крона. Он связывается с α4-интегрином – компонентом адгезионных молекул, экспрессируемых на поверхности лимфоцитов, и предотвращает миграцию аутореактивных лимфоцитов в поражаемые органы. Похожий механизм действия объясняет таковое модулятора рецептора сфингозин-1-фосфата (FTY720 – финголимод), также одобренного для лечения рассеянного склероза. Адгезионные молекулы могут быть мишенью для лекарственных препаратов и при ААВ [4].
Селезеночная тирозинкиназа (Syk) представляет собой нерецепторную цитоплазматическую тирозинкиназу и имеет большое значение в передаче сигнала от многих рецепторов иммунной системы, в т.ч. В-клеточного рецептора. АНЦА также могут активировать Syk через Fcγ-рецептор; сообщается о возможности предотвращения гломерулонефрита и снижения продукции аутоантител в мышиной модели гломерулонефрита с полулуниями при назначении фостаматиниба – малой молекулы, ингибирующей Syk [4].
Сигналы через цитокиновые рецепторы I/II типа передаются через киназу Janus (Jak); ее блокада может оказаться эффективной при аутоиммунных заболеваниях с повышением провоспалительных цитокинов. Тофацитиниб – малая молекула, ингибирующая Jak, уже зарегистрирован для лечения ревматоидного артрита [70].
Перспективные подходы к терапии эозинофильного гранулематоза с полиангиитом (Черга–Страусс)
Эозинофильный гранулематоз с полиангиитом (Черга–Страусс) (ЭГПА) характеризуется наличием бронхиальной астмы и эозинофилии. ЭГПА обычно не включают в клинические исследования при ААВ в связи со сложностями оценки активности болезни (в первую очередь симптомов бронхиальной астмы) и предполагаемых различий в патогенезе. Данных, обосновывающих современную терапию ЭГПА, значительно меньше по сравнению с ГПА/МПА [71]. Французская группа по изучению васкулитов оценивала эффективность и безопасность монотерапии ГК при нетяжелом ЭГПА и комбинированной терапии ГК + ЦФ при тяжелом ЭГПА. Частота рецидивов при нетяжелом ЭГПА в случае монотерапии ГК оказалась высокой, что обосновывает необходимость проведения клинических исследований по оценке комбинированной терапии [72].
В литературе представлены единичные наблюдения успешного применения РТМ при рецидивирующем и рефрактерном ЭГПА, при этом патофизиологическое обоснование сводится только к наличию АНЦА (хотя и у меньшей части пациентов) [45, 73–75]; кроме того, не исключен более высокий риск нежелательных реакций при использовании ГИБП при ЭГПА [76].
В развитии ЭГПА ключевая роль принадлежит иммунному ответу по Th2-пути с повышением интерлейкинов-4, -5 и -13.
В двух небольших открытых исследованиях [77, 78] меполизумаб (анти-интерлейкин-5 моноклональные антитела) продемонстрировал хорошую эффективность и безопасность при ЭГПА; в настоящее время планируется более крупное рандомизированное исследование (NCT02020889). Питакинра является рекомбинантным белком и ингибирует интерлейкин-4 и -13, действуя как антагонист рецептора α интерлейкина-4. Оба препарата продемонстрировали эффективность в терапии бронхиальной астмы.
Интерферон-α влияет на Th2-опосредуемый иммунный ответ, в небольших исследованиях была продемонстрирована его эффективность в индукции и поддержании ремиссии при ЭГПА [79]. Возможности более широкого изучения и применения ограничиваются неблагоприятным спектром нежелательных эффектов.
Перспективные возможности неселективной иммуносупрессивной терапии
Микофенолата мофетил (ММФ) может использоваться как альтернативный препарат при рецидивирующем течении васкулита или для поддержания ремиссии [30]. В качестве препарата для индукции ремиссии ММФ продемонстрировал сопоставимую с ЦФ эффективность при ААВ (АНЦА к МПО) с поражением почек в небольших клинических исследованиях [80, 81]; к настоящему моменту завершено более крупное исследование MYCYC (NCT00414128) ММФ для индукции ремиссии при ААВ, предварительные результаты которого подтверждают, что ММФ не уступает ЦФ в/в для индукции ремиссии к 6-му месяцу, однако при последующем наблюдении риск рецидива значительно выше в группе ММФ [29].
Гусперимус (15-деоксиспергуалин) подавляет преимущественно созревание Т-лимфоцитов и пролиферацию цитотоксических Т-лимфоцитов, а также влияет на В-лимфоциты. В двух открытых исследованиях была показана высокая частота достижения улучшения при рефрактерном ГПА [20], существенную проблему представляет необходимость частого мониторинга для уменьшения риска цитопений. В настоящее время зарегистрировано клиническое исследование SPARROW (NCT01446211), в котором оценивается эффективность гусперимуса при рецидивирующем и рефрактерном ГПА.
Плазмаферез (ПАФ) может применяться при тяжелых ААВ. Патогенетическим обоснованием эффективности ПАФ является участие АНЦА в повреждении тканей и органов; кроме того, возможно удаление при ПАФ и других факторов. Мета-анализ данных исследований ПАФ подтверждает его эффективность в отношении уменьшения риска развития терминальной почечной недостаточности, однако не влияние на смертность [82]. В настоящее время ПАФ обычно рекомендуют при тяжелом поражении почек или альвеолярном кровотечении, хотя по последнему показанию отсутствуют убедительные доказательства. Продолжается исследование PEXIVAS (NCT00987389), в котором оценивается влияние ПАФ на общую и почечную выживаемость больных с СКФ менее 50 мл/мин или тяжелым альвеолярным кровотечением [83].
В дополнение к основной (иммуносупрессивной) терапии важное значение в лечении ААВ принадлежит разработке вспомогательных методов лечения (например, профилактика инфекционных осложнений, остеопороза, почечной заместительной терапии). Гемодиализ и трансплантация почки стали рутинными методами лечения терминальной почечной недостаточности, при этом тяжелая дыхательная недостаточность представляет гораздо большую проблему для ведения и все еще остается одной из ведущих причин смертельных исходов. Недавно была продемонстрирована возможность успешного использования экстракорпоральной мембранной оксигенации при острой дыхательной недостаточности, вызванной геморрагическим альвеолитом при ААВ [84]. Возможности лечения хронического прогрессирующего легочного фиброза при ААВ, в первую очередь МПА, остаются весьма ограниченными. Пирфенидон – антифибротический препарат, разрешенный к лечению идиопатического легочного фиброза, в настоящее время не получил широкого распространения из-за малой эффективности в сочетании с серьезными нежелательными эффектами, например тяжелой фоточувствительностью.
Определенное внимание привлекают методы экстракорпоральной гемокоррекции (отличные от ПАФ), продемонстрировавшие эффективность в отдельных наблюдениях [85, 86]. Обнадеживающие результаты ожидаются в области стволовой медицины, где уже начато изучение эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток, но сроки их возможного клинического применения еще сложно прогнозировать.
Заключение
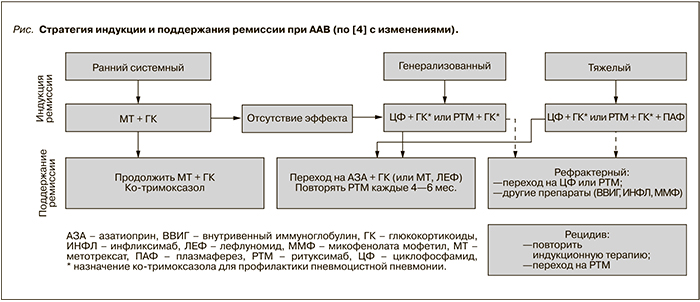
Современное понимание стратегии лечения ААВ представлено на рисунке.
Множество новых препаратов и кандидатов в настоящее время изучается в разных фазах клинических и экспериментальных исследований ААВ. Можно надеяться, что эффективное использование новых подходов позволит в значительной степени справиться с сохраняющимися в настоящее время проблемами, в т.ч. обеспечить более эффективную профилактику рецидивов, снизить риск нежелательных эффектов, в первую очередь за счет уменьшения потребности в глюкокортикоидах.



