Введение
Анемия почечного происхождения, или нефрогенная анемия, наблюдается у подавляющего большинства пациентов, находящихся на программном гемодиализе, и имеет многофакторный генез, характеризующийся главным образом сочетанием дефицита продукции эндогенного эритропоэтина (ЭПО), истощения доступного для эритропоэза пула железа и резистентности костного мозга к действию эритропоэтин-стимулирующих агентов (ЭСА). Еще 15 лет назад единственным методом лечения данного варианта анемии были многократные гемотрансфузии. Наряду с риском аллергических, анафилактических и посттрансфузионных реакций переливание крови приводило к перегрузке гемодализных больных железом, распространению переносимой с кровью перэнтеральной вирусной инфекции (гепатиты В, С, ВИЧ-инфекция), а также возникновению феномена HLA-иммунизации, в свою очередь ухудшавшего результаты трансплантации почки [1, 2].
Внедрение в клиническую практику препаратов рекомбинантного человеческого ЭПО — стимуляторов эритропоэза — существенно изменило стратегию лечения нефрогенной анемии и позволило практически отказаться от гемотрансфузий для пациентов на программном гемодиализе. Первые результаты применения стимуляторов эритропоэза показали, что использование этих препаратов позволяет не только устранять анемический синдром, но и снижать заболеваемость, а также смертность больных, в первую очередь от сердечно-сосудистых и инфекционных осложнений. Наряду с этим коррекция анемии приводит к улучшению качества жизни, улучшает когнитивные функции, сексуальную активность и способствует сохранению трудоспособности пациентов как на диализе, так и в преддиализных стадиях хронической болезни почек (ХБП) [3—5].
Эндогенный стимулятор эритропоэза (рчЭПО) был впервые выделен из мочи больных апластической анемией Miyake в 1977 г. За ним последовали клонирование гена ЭПО Jacobs в 1985 г. и первое применение эпоэтина-альфа в клинике Echbach в 1987 г. [6]. Препараты первого поколения, эпоэтин-альфа и -бета, биологически идентичны нативному ЭПО и представляют собой сиалогликопротеидный гормон с молекулярной массой 30,4 кДа. Оба продукта были синтезированы в культуре овариальных клеток китайского хомячка, в которые включена молекула ДНК человеческого ЭПО. Аминокислотная последовательность полипептидной цепочки обоих ЭПО идентична и состоит из 165 аминокислот, различие состоит в процессе и уровне ее гликозилирования (путем присоединения до 3 N-связанных разветвленных боковых углеродных цепей). В организме человека вырабатывается не единая гомогенная молекула, а смесь различных ее изоформ, определяемых по числу свободных сиаловых остатков в боковых цепях (их количество может достигать 14). Установлено, что наибольшей эритропоэтической активностью обладает изоформа 14. С другой стороны, изоформы с меньшим числом остатков сиаловой кислоты имеют большее сродство к рецептору ЭПО, но более короткий период циркуляции. Очищенные коммерческие препараты ЭПО-альфа и -бета состоят из смеси изоформ от 9 до 14 [1, 11, 12].
При создании дарбэпоэтина альфа, ЭСА 2-го поколения, принимался во внимание тот факт, что увеличение в изоформе количества цепей гликозилирования и свободных сиаловых остатков приводит к усилению ее эритропоэтических свойств вследствие удлинения периода ее полувыведения, Так как наибольшее число сиаловых остатков в молекуле рчЭПО несли 3 N-концевые углеводородные цепи, методом сайтнаправленного мутагенеза к базовой молекуле рчЭПО были присоединены еще 2 дополнительные углеводородные цепи, тем самым их число возросло до 5, а число сиаловых остатков с 14 доведено до 22. В результате была создана новая молекула дарбэпоэтина альфа (ДА) с возросшей массой с 30,4 до 37,1 кДа и увеличенным содержанием углеводов с 40 % примерно до 52 %. ДА имеет меньшее, чем ЭПО-альфа или -бета, сродство к рецептору, что перевешивается его возросшей активностью и более длительной циркуляцией. Так, период полувыведения ДА при внутривенном введении по сравнению с эпоэтином-альфа (8,5 часов) увеличен в 3 раза и составляет 25,3 часа, при подкожном введении время полувыведения ДА вдвое превышает показатель эпоэтина-альфа (48 против 24 часов). Такие фармакологические свойства позволяют вводить ДА существенно реже, чем эпоэтины короткого действия. Его эффективность установлена при введении 1 раз в неделю в фазе коррекции и 1 раз в 2 недели в поддерживающей фазе у большинства больных как на диализе, так и в преддиализных стадиях ХБП [13—15].
Нерешенной проблемой коррекции анемии препаратами рчЭПО являются цикличные флуктуации уровня гемоглобина. Под цикличными флуктуациями уровня гемоглобина подразумеваются его нефизиологические спонтанные колебания, составляющие примерно 1,5 г/дл по амплитуде вверх или вниз от некой равновесной точки с длительностью цикла не менее 8 недель. Как показали специально проведенные клинические исследования, в которых изучалась временная вариабельность уровня гемоглобина, в течение года 905 стабильных пациентов на диализе демонстрируют хотя бы один цикл флуктуаций гемоглобина, а в среднем число таких циклов составляет 3,3 на 1 пациента в год со средней амплитудой 2,5 г/д. Цикличные колебания гемоглобина связаны с комплексом факторов, среди которых наиболее важным считают изменения дозы рчЭПО [7]. Другими факторами, очевидно способствующими циклическим флуктуациям гемоглобина, считаются госпитализации, обусловленные развитием осложнений и/или обострением сопутствующих заболеваний, терапия железом, нутриционный статус, наличие воспалительного процесса. Показано, что чем длительнее больной находится в целевом диапазоне (11—12,5 г/дл), тем ниже у него риск смерти. Предполагают, что плохой прогноз при циклических колебаниях гемоглобина объясняется флуктуациями в доставке кислорода тканям и эпизодами ишемии миокарда, как только уровень гемоглобина значимо снижается [16].
За последние 3 года были проведены исследования (CREATE, CHOIR) [12], в которых было установлено, что повышение уровня гемоглобина более 13 г/дл приводит к увеличению риска сердечно-сосудистых осложнений. Более поздние рекомендации были пересмотрены и рекомендован новый целевой уровень гемоглобина, от 10 до 12 г/дл, для всех категорий пациентов. Последние публикации результатов дополнительного анализа исследования CHOIR подтвердили, что высокие дозы ЭПО-альфа стали причиной увеличения риска неблагоприятных исходов даже в большей степени, чем высокий уровень гемоглобина [14, 17, 18].
Таким образом, стратегия достижения и поддержания целевых значений гемоглобина при ХПН постоянно эволюционируют, а подходы к применению конкретных терапевтических агентов, стимулирующих эритропоэз, требуют дальнейшей оптимизации. В связи с этим целью настоящего исследования стала оценка эффективности ДА при переводе с рчЭПО короткого действия в достижении и поддержании целевых значений гемоглобина у больных с ХПН, получающих терапию диализом.
Материал и методы
Под нашим наблюдением состояли 49 пациентов с терминальной почечной недостаточностью, находившихся на программном гемодиализе в центрах амбулаторного гемодиализа ООО “Центр Диализа” Московской области.
Мужчины составляли 53,1 % (n = 26), женщины — 46,9 % (n = 23) из включенных в исследование. Возраст больных был от 17 до 80 лет и в среднем составил 51,56 ± 14,86 года.
Среди заболеваний, послуживших причиной ТПН, наиболее частым был хронический гломерулонефрит (ХГН) — 55,1 % случаев (табл. 1).
Таблица 1. Заболевания, послужившие причиной формирования терминальной почечной недостаточности.
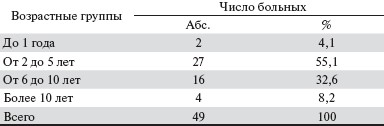
У обследованных больных длительность лечения гемодиализом составила от 6 месяцев до 18 лет (табл. 2).
Таблица 2. Длительность лечения гемодиализом.
Всем больным проведен гемодиализ или гемодиафильтрация on line (объем замещения 40—50 литров в режиме предилюции) средняя продолжительность сеансов гемодиализов составила 4 часа 27 минут) 3 раза в неделю со скоростью кровотока 350—450 мл/мин до достижения KT/V ≥1,51 за сеанс диализа. Типы использованных диализаторов включали:
- низкопоточные диализаторы (F6HPS у 41,1 % больных, F7HPS у 20,3 %, F8 HPS у 38,6 % больных);
- высокопоточные гемофильтры (F60S у 55,6 % больных, F80S у 44,4 % больных).
Все больные получали препараты рчЭПО короткого действия, дозы которых приведены в табл. 3.
Таблица 3. Таблица доз рчЭПО.
Эральфон преимущественно вводился внутривенно, т. к. его введение вызывало у большинства пациентов болезненные ощущения в месте инъекции. Схема перевода на ДА приведена ниже:
- пациентов, получавших еженедельно по одной, две или три инъекции рчЭПО, переводили на режим однократного еженедельного введения ДА или его введение один раз в две недели;
- исходную еженедельную дозу ДА (мкг/нед) определяли, разделив общую еженедельную дозу рчЭПО (МЕ/нед) на 200;
- исходную дозу ДА (мкг/2 нед) при режиме введения один раз в 2 недели определяли путем деления суммарной кумулятивной дозы рчЭПО короткого действия, введенного за недельный период, на 200;
- для всех пациентов стартовая доза ДА составила 30 мкг 1 раз в неделю.
При достижении уровня гемоглобина ≥ 11,0 г/дл пациент получал по 30 мкг ДА 1 раз в 2 недели. Всем больным определялись показатели обмена железа. Средний уровень ферритина перед началом терапии ДА составил 718 ± 120 мкмоль/л, Процент насыщения транферрина — 33,6 ± 2,1. Таким образом, видно, что в исследуемой группе пациентов не было выраженного дефицита железа.
Количественные показатели представлены в виде средних значений и стандартного отклонения (M ± SD). Достоверными считали различия при p < 0,05.
Результаты и обсуждение
После назначения ДА значения уровня Hb составили 9,62 ± 1,40 г/дл через месяц после перевода с терапии рчЭПО, 10,4 ± 1,49 г/дл — через 3 месяца, 10,3 ± 1,24 г/дл — через 4 месяца терапии. Данные динамики уровня средних значений гемоглобина после перевода пациентов на лечение ДА в течение четырех месяцев представлены в табл. 4.
Таблица 4. Динамика уровня средних значений гемоглобина после перевода пациентовс рчЭПО на лечение ДА в течение 4 месяцев.
Уже через 1,5 месяца 67 % пациентов достигли целевых значений уровня гемоглобина, 33 % пациентов не достигли целевых значений данного показателя.
Нами были констатированы следующие причины резистентности к терапии ДА у пациентов, не достигших целевых значений Hb:
- вторичный гиперпаратиреоз (ВГПТ) — у 78 % больных;
- инфекционные осложнения — у 18 % больных;
- кровотечения — у 4 % больных.
В табл. 4 представлена динамика уровня гемоглобина при коррекции нефрогенной анемии у больных с выраженным ВГПТ (средние значения уровня паратиреоидного гормона у них составили108 пмоль/л).
В целом результаты применения ДА для коррекции анемии у больных ХБП на гемодиализе, полученные в нашей клинике, согласуются с опытом других авторов. Увеличение интервала дозирования ДА считают целесообразным для длительного лечения пациентов с ХБП. Так, показано, что терапия ДА при увеличении режима введения 1 раз в неделю до 1 раза в 2 недели одинаково эффективно поддерживает уровень гемоглобина без изменения дозы препарата [18, 19].
Применение ДА позволяет достигать целевых уровней гемоглобина большему числу пациентов по сравнению с терапией короткими ЭПО. Продемонстрировано, что перевод с терапии рчЭПО 2—3 раза в неделю на терапию ДА 1 раз в неделю позволяет повышать средний уровень гемоглобина на 0,7 г/дл и достигать/поддерживать целевой уровень гемоглобина дополнительно у 20 % пациентов [7]. В клиническом исследовании P. Biggar et al. (2008) [20] пациенты на диализе, получавшие терапию ДА 1 раз в неделю или 1 раз в 2 недели, были переведены на терапию эпоэтином бета (с использованием коэффициента 1 : 200, рекомендованного для обратного перевода). На фоне терапии ДА у 71 % пациентов уровень гемоглобина поддерживался в целевом диапазоне, в то время как после перевода на терапию эпоэтином бета доля таких пациентов снизилась до 54 %.
Еще одной особенностью дарбэпоэтина альфа является отсутствие достоверных различий в эффективности между подкожным, внутривенным путями введения, что объясняют удлиненным периодом его полувыведения [30]. Это дает определенные преимущества дарбэпоэтину при лечении пациентов на гемодиализе и позволяет переводить их с подкожного введения рчЭПО на более комфортный — внутривенный — путь безо всякого снижения эффекта в той же дозе [1].
В нашем исследовании применение ДА позволило достичь целевого уровня гемоглобина у большего числа пациентов, чем при терапии рчЭПО. ДА в целом хорошо переносился: нежелательные явления (артериальная гипертензия и головная боль) были отмечены у 5 (10,2 %) из 49 пациентов. Следует еще раз подчеркнуть удобство применения препарата и различные пути его введения — при этом эффективность препарата практически не меняется.
Период полувыведения ДА длителен, что позволяет уменьшать частоту его введения и при этом эффективно контролировать уровень гемоглобина. Применяя ДА для коррекции нефрогенной анемии, необходимо учитывать адекватность диализа, выраженность вторичного гиперпаратиреоза, а также контролировать развитие инфекционных и воспалительных заболеваний. В целом назначение ДА можно рассматривать как один из наиболее эффективных подходов к долгосрочному контролю анемии при ХБП.



