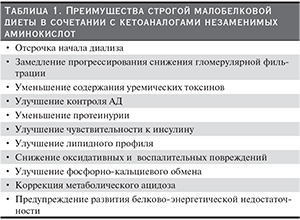
Как для нефрологов, так и для пациентов с ХБП одной из основных терапевтических целей является задержка времени до начала диализа, замедление прогрессирования почечной недостаточности за счет коррекции уремической интоксикации. При этом важной задачей при лечении пациентов с ХБП остается поддержание удовлетворительного нутритивного статуса, профилактика сердечно-сосудистых и метаболических расстройств, ухудшающих качество жизни и приводящих к сокращению продолжительности жизни больных с почечной недостаточностью. В качестве препаратов первой линии терапии для достижения некоторых из этих целей, особенно прогрессирования почечной недостаточности и сердечно-сосудистых осложнений, предлагаются ингибиторы ангиотензин-превращающего фермента (ИАПФ) и блокаторы рецепторов ангиотензина. Рекомендуется назначение МБД, которая является также синергистом для ингибиторов ренин-ангиотензин-альдостероновой системы (табл. 1).
Более 140 лет назад было показано, что снижение потребления белка благоприятно влияет на уремический синдром – преимущественно из-за уменьшения накопления продуктов метаболизма пищевого белка, а также фосфатов и снижения ацидоза. Кроме того, в последнее время было показано, что изменения количества потребляемого с пищей белка может сильно влиять на скорость потери функции почек, по крайней мере в некоторых моделях у животных [1].
Более 20 лет назад Бергстрём. и соавт. [4] подчеркнули важность влияния терапии на додиализной стадии на отдаленные исходы у пациентов с ХБП, что было подтверждено позже в других исследованиях [5].
Помимо обычной МБД, которая обеспечивает потребление 0,6–0,8 г белка/кг/сут для лечения пациентов с ХБП была предложена строгая МБД (сМБД) с очень низким содержанием белков в сочетании с назначением препаратов, содержащих незаменимые аминокислоты (ЭАК) или кальциевые соли их безазотистых кетоаналогов (KA); необходимым количеством водорастворимых витаминов, карбоната кальция и железа. Такое сочетание позволяет безопасно ограничивать суточное потребление белка до 0,3 г/кг/сут, обеспечивая достаточное количество незаменимых аминокислот и нейтральный баланс азота в связи с уменьшением азота мочевины. У больных ХБП адаптивный ответ на МБД с низким содержанием белков сохраняется длительное время [2].
Мониторинг больных, находящихся на строгой МБД в сочетании с применением кетоаналогов незаменимых аминокислот
Строгая МБД предусматривает потребление белка 0,3–0,5 г/кг/сут с высоким процентом белков растительного происхождения (табл. 2). Энергопотребление (30–35 ккал/кг/сут) обеспечивается в основном за счет углеводов (65%), липиды и белки покрывают 30 и 5% общей энергии потребления соответственно.
Преимуществом назначения препаратов, содержащих незаменимые аминокислоты и кетоаналоги незаменимых аминокислот для пациентов с ХБП, является отсутствие необходимости употребления больших количеств белка с высокой биологической ценностью, а также возможность расширить выбор продуктов с лучшими вкусовыми качествами.
При нефротическом синдроме потребление пациентами белка с пищей может быть увеличено на 1,5 г белка высокой биологической ценности на каждый грамм белка, потерянного с мочой, при протеинурии выше 3 г/сут.
Строгая МБД в сочетании с назначением кетоаналогов незаменимых аминокислот показана пациентам 4–5-й стадий ХБП без тяжелых сопутствующих заболеваний, предрасполагающих к развитию гиперкатаболического синдрома.
Пациенты, не спосбные приспособиться к такой диете и/или строгому мониторингу, также должны быть исключены.
 Такой вид диетотерапии предполагает необходимость более частых консультаций клиницистов и диетологов. Программа тщательного клинического мониторинга позволяет лучше контролировать АД и адекватность питания пациентов, а также проверять их комплаентность в отношении назначенной диетотерапии. В этих условиях строгая МБД в сочетании с назначением кетоаналогов незаменимых аминокислот может быть широко предлагаться, хотя на практике полноценно используется примерно 30–40% пациентов 4–5-й стадий ХБП.
Такой вид диетотерапии предполагает необходимость более частых консультаций клиницистов и диетологов. Программа тщательного клинического мониторинга позволяет лучше контролировать АД и адекватность питания пациентов, а также проверять их комплаентность в отношении назначенной диетотерапии. В этих условиях строгая МБД в сочетании с назначением кетоаналогов незаменимых аминокислот может быть широко предлагаться, хотя на практике полноценно используется примерно 30–40% пациентов 4–5-й стадий ХБП.
У пациентов, не имеющих осложнений, дополнительных катаболических факторов, потребление белка может быть рассчитано в соответствии с балансом азота, что равно потере азота с мочой плюс немочевая экскреция азота; последняя не зависит от потребления белка и составляет в среднем 0,031 г/кг массы тела/сут [6].
Пищевые дневники пациентов позволяют оценивать фактическое потребление энергии. Соблюдение диеты, которое является краеугольным камнем эффективности лечения, определяется как фактическое потребление, которое не должно отличаться более чем на 20% от предписанного потребления. Даже у тщательно отобранных и мотивированных пациентов удовлетворительная комплаентность достигалась лишь в 40% и 60% [7]. Исследование MDRD (Modification of Diet in Renal Disease Study) подтвердило, что степень соблюдения диеты в группе пациентов со строгой МБД в сочетании с назначением кетоаналогов незаменимых аминокислот была одинаковой с группой получавших обычную МБД [8].
Влияние на уремический синдром
Результаты влияния строгой МБД с назначением кетоаналогов незаменимых аминокислот на уремический синдром четко доказали задержку времени до начала диализной терапии. Резкое снижение концентрации сывороточного азота мочевины, обусловливающее улучшение большинства проявлений уремического статуса, позволяет пациентам на строгой МБД с назначением кетоаналогов незаменимых аминокислот начать лечение диализом при уровне остаточной функции почек ниже, чем обычно рекомендуется [3, 9].
Вальзер и соавт. подсчитали, что благодаря задержке появления уремической симптоматики использование строгой МБД с назначением кетоаналогов незаменимых аминокислот продлевает интервал до наступления почечной смерти в среднем на 1 год, после того как пациенты достигают СКФ на уровне 10 мл/мин без сахарного диабета и 15 мл/мин для пациентов с сахарным диабетом [10].
Несколько мета-анализов показали преимущества влияния МБД и/или строгой МБД с назначением кетоаналогов незаменимых аминокислот на риск развития почечной недостаточности и смерти. В мета-анализе, обобщившем 5 исследований, включая исследование MDRD, Педрини и соавт. показали значительное снижение (RR=0,67) такого риска при среднем периоде наблюдения 18–36 месяцев [11].
В двух последовательных мета-анализах Фук и соавт. также показали сокращение на 39% числа почечной смерти у пациентов на МБД или строгой МБД с назначением кетоаналогов незаменимых аминокислот [12].
Однозначное влияние строгой МБД с назначением кетоаналогов незаменимых аминокислот на уремическую симптоматику объясняет различия в выводах мета-анализов в соответствии с выбором основных конечных точек: спорными, когда оценивается потеря функции почек (СКФ), и весьма значительными, когда в качестве основных конечных точек используется время наступления смерти почек (начало диализа или трансплантация) или смерти пациентов.
Позднее начало диализа при ХБП (как при неудавшейся трансплантации) может быть безопасным, пока это позволяет симптоматика пациента [13]. Задержка времени начала диализа, вероятно, является наиболее важным фактором для пациента. Строгая МБД с назначением кетоаналогов незаменимых аминокислот является ценным методом для достижения этой цели у многих пациентов, а также создает дополнительные преимущества с позиции влияния на сосудистые или метаболические осложнения ХБП.
Воздействие строгой малобелковой диеты в сочетании с кетоаналогами незаменимых аминокислот на осложнения ХБП
Сердечно-сосудистые заболевания и нарушения обмена веществ являются основными осложнениями ХБП; они тесно переплетены, и в большинстве случаев метаболические расстройства способствуют дальнейшему развитию сердечно-сосудистых осложнений
Сердечно-сосудистые осложнения
Сердечно-сосудистые заболевания являются основной причиной заболеваемости и смертности среди пациентов с ХБП, что составляет около 50% всех случаев смерти пациентов на диализе. Высокий риск развития сердечно-сосудистых заболеваний присутствует на самых ранних стадиях почечной недостаточности и увеличивается с прогрессированием утраты функции почек; риск смерти, связанный с сердечно-сосудистыми осложнениями, оценивается в 15 раз выше, чем с прогрессированием ХБП и развитием терминальной ХПН.
Строгая малобелковая диета в сочетании с кетоаналогами незаменимых аминокислот с ее важным вегетарианским компонентом ограничивает потребление не только белка, но и хлорида натрия и фосфатов, позволяя уменьшить традиционные и нетрадиционные сердечно-сосудистые факторы риска различными путями [14, 15].
Контроль артериального давления
В проспективном нерандомизированном исследовании, включившем 110 пациентов 4–5-й стадий ХБП, Беллицци и соавт. показали, что назначение строгой малобелковой диеты в сочетании с кетоаналогами незаменимых аминокислот вызывало значительное снижение артериального давления, связанное с одновременным уменьшением потребности в антигипертензивной терапии [16].
Несколько механизмов были выдвинуты, чтобы объяснить эти результаты:
- повышение концентрации в плазме аминокислот с разветвленной цепью, которые обладают сосудорасширяющим эффектом;
- переход от обычной мясной диеты на вегетарианское питание, что приводит к значительному снижению артериального давления у пациентов с нормальной функцией почек, [17] или более простой: ограничение употребления соли, связанное со строгой МБД, может играть ведущую роль в снижении уровня артериального давления [18].
Снижение протеинурии
Помимо хорошо известной роли в качестве маркера и фактора риска прогрессирования ХБП протеинурия имеет дозозависимый характер фактора сердечно-сосудистого риска как в общей популяции [19],так и у пациентов с нефропатией [20]. Таким образом, протеинурию следует рассматривать в качестве одной из главных мишеней обеспечения как кардио-, так и нефропротекции. Действительно, в многочисленных исследованиях наблюдалась положительная корреляция между снижением у пациентов протеинурии при назначении ИАПФ или блокаторов рецепторов ангиотензина II и снижением сердечно-сосудистого риска независимо от влияния на артериальное давление.
Снижение протеинурии при использовании эффектов строгой малобелковой диеты в сочетании с кетоаналогами незаменимых аминокислот аналогично зарегистрированным эффектам медикаментозной терапии: после первоначального уменьшения на первой неделе наибольшее улучшение протеинурии достигается в течение 3 месяцев со средним снижением в диапазоне между 20 и 47% [21, 22]. Вполне вероятно, что влияние строгой малобелковой диеты в сочетании с кетоаналогами незаменимых аминокислот на кардиоваскулярные исходы также аналогично тому, которое наблюдается при использовании медикаментозной терапии. Тем не менее, как и антагонисты системы ренин-ангиотензина, строгая малобелковая диета в сочетании с кетоаналогами незаменимых аминокислот оказывает свое антипротеинурическое действие с помощью различных механизмов: постгломерулярной вазодилатациии на начальном этапе и прегломерулярной вазоконстрикции в последующем. Что касается комбинированного использования ингибиторов РААС и строгой МБД в сочетании с кетоаналогами незаменимых аминокислот, то их эффекты являются синергичными и позволяют уменьшать протеинурию до самого достижимого низкого уровня [23, 24].

Метаболические осложнения
Строгая МБД с назначением кетоаналогов незаменимых аминокислот уменьшает признаки уремической интоксикации либо через непосредственное влияние на некоторые метаболические нарушения (такие как метаболический ацидоз или расстройства фосфорно-кальциевого обмена) или благодаря снижению выработки побочных продуктов метаболизма белка, которые ведут себя как метаболические ингибиторы.
Улучшение резистентности к инсулину
Помимо ведущей роли в формировании белково-энергетической недостаточности инсулинорезистентность также является независимым предиктором сердечно-сосудистой смертности, который появляется на ранних стадиях ХБП. Благоприятное влияние на толерантность к глюкозе и чувствительность к инсулину наблюдались после 3 месяцев строгой МБД с назначением кетоаналогов незаменимых аминокислот [25]. Снижение выработки и накопления продуктов метаболизма пищевых белков, которые ведут себя как ингибиторы инсулина, может быть причиной снижения гиперинсулинизма и его кардиоваскулярных осложнений.
Улучшение липидного профиля, оксидативного и воспалительного статуса
Резкое сокращение потребления белка животного происхождения при использовании строгой МБД с назначением кетоаналогов незаменимых аминокислот связано с сопутствующим снижением потребления насыщенных жирных кислот и улучшением профиля липидов сыворотки: снижение в сыворотке триглицеридов и увеличение соотношения Apo A1/Apo B [26].
В ответ на улучшение протеинурии существует также корреляция со снижением общего холестерина и холестерина липопротеинов низкой плотности, что может быть связано с высокой долей белка растительного происхождения [27]. Окислительный статус также улучшается у пациентов, находящихся на строгой МБД с назначением кетоаналогов незаменимых аминокислот, потому что эта диета содержит широкий спектр антиоксидантных соединений: витамины–антиоксиданты и каротиноиды, которые способны уменьшать окислительный стресс.
По сравнению с пациентами, получавшими обычную МБД, пациенты, находившиеся на строгой МБД с назначением кетоаналогов незаменимых аминокислот, показали улучшение липидного профиля и снижение окислительного стресса с уменьшенным ответом острой фазы [28]. Назначение кетоаналогов незаменимых аминокислот пациентам с ХБП, получавшим эритропоэтин, потенцировало благоприятное влияние последнего на обмен белков, аминокислот и липидов [29].
Коррекция нарушений фосфорно-кальциевого обмена
Гиперфосфатемия является независимым фактором риска смертности среди больных ХБП в связи с развитием кальцификации сосудов и кардиальных повреждений. Гиперфосфатемия является результатом положительного баланса фосфора, несмотря компенсационный вторичный гиперпаратиреоз, и способствует увеличению продукции фактора роста фибробластов 23 (FGF-23).
Результаты недавнего исследования показали, что использование строгой МБД с назначением кетоаналогов незаменимых аминокислот снижает как гиперфосфатемию, так и концентрацию FGF-23 в сыворотке крови [30].
Это особенно важно, так как концентрации FGF-23, которые у больных ХБП в несколько раз выше, чем обычно, являются независимыми предикторами сердечно-сосудистых событий и всех причин смерти.
Другое исследование из этой группы показало сильную корреляцию уровня фосфатов с антипротеинурическим эффектом строгой МБД с назначением кетоаналогов незаменимых аминокислот: снижение протеинурии в ответ на строгую МБД отрицательно коррелировало с сывороточными уровнями фосфора. Этот факт может частично объяснить взаимосвязь высоких уровней фосфата сыворотки с более быстрым прогрессированием ХБП [31].
Общее влияние строгой МБД с назначением кетоаналогов незаменимых аминокислот на нарушения фосфорно-кальциевого обмена является хорошей иллюстрацией комплементарных эффектов различных компонентов такой диеты. Строгая МБД обеспечивает очень низкую нагрузку по фосфору, не превышающую 7–9 мг/кг/сут, т.к. потребление фосфора связано с потреблением белка, а также предотвращает положительный баланс фосфора и развитие соответствующих сосудистых и костных осложнений. Пропорциональное увеличение белка растительного происхождения при строгой МБД также играет роль в снижении гиперфосфатемии. Биодоступность фосфора варьируется в зависимости от источника: в то время как всасывание фосфора в кишечнике из мясных продуктов питания достигает 80%, из растительного белка, в основном в сложной форме фитиновой кислоты, не превышает 30–40% из-за отсутствия фитазы в организме человека, что облегчает контроль сывороточного фосфора и FGF-23 [32, 33]. Наконец, кетоаналоги незаменимых аминокислот, представленные солями кальция, обеспечивающие поступление с каждой таблеткой 50 мг кальция, оказывают гипофосфатемический эффект, связанный с образованием нерастворимого фосфата кальция в кишечнике [34].
Коррекция метаболического ацидоза
Метаболический ацидоз, довольно часто встречающийся у пациентов с ХБП, ускоряет катаболизм белка, приводит к уменьшению синтеза альбумина, способствует потере тощей массы тела и, возможно, прогрессированию ХПН, и, наоборот, коррекция ацидоза связана с лучшими выживаемостью и почечными исходами [35]. Недавно было показано, что назначение энтеральных щелочных пищевых добавок или диеты, богатой фруктами и овощами, было одинаково эффективным при коррекции метаболического ацидоза и некоторых из его последствий для почек [36].
При этом развитие ацидоза связано с диетой, содержащей белки животного происхождения, которая подразумевает образование массы кислот. Вегетарианские продукты, которые содержат большее количество обменных органических анионов и меньшее количество серосодержащих аминокислот, как правило, способствуют образованию щелочных метаболитов, ограничивающих развитие ацидоза.
В перекрестном исследовании с участием почти 3000 пациентов с различными стадиями ХБП было обнаружено, что доля белка растительного происхождения от общего потребления белка с пищей коррелирует с уровнями бикарбоната сыворотки независимо от стадии ХБП или общего потребления белка [37]. Благоприятный эффект строгой МБД с назначением кетоаналогов незаменимых аминокислот на метаболический ацидоз у пациентов с ХБП отчасти может объясняться сокращением потребления мяса и высоким процентом белка растительного происхождения в рационе [3, 38] .
Кардионефропротективное значение кетоаналогов незаменимых аминокислот
Одним из интересных вопросов применения МБД является вклад кетоаналогов незаменимых аминокислот в кардио-нефропротективные эффекты диетических воздействий на пациентов с ХБП.
В последнее время изучению этого вопроса посвящен ряд исследований [38–41].
Целью мета-анализа Лиу и соавт. [39] стала оценка эффективности и безопасности стандартной малобелковой белковой диеты или строгой малобелковой диеты с назначением кетоаналогов аминокислот в лечении ХБП. Представлен обзор публикаций библиотеки Cochrane, PubMed, Embase, и централизованных баз, опубликованных до апреля 2015 г. Были отобраны и включены в это исследование 7 РКИ, 1 исследование с перекрестным контролем и 1 нерандомизированное исследование. Оценивали изменения СКФ, общего азота мочи, показателей сывороточного альбумина, ПТГ, триглицеридов, холестерина, кальция, фосфора и индексов нутриционного статуса до и после лечения.
Данные мета-анализа показали, что по сравнению со стандартной белковой диетой строгая малобелковая диета в сочетании с кетоаналогами аминокислот позволяет значительно уменьшить снижение СКФ (р<0,001), развитие гиперпаратиреоза (p=0,04), артериальной гипертензии (p<0,01) и гиперфосфатемии (р<0,001).
Попытка оценить вклад кетоаналогов аминокислот с позиции кардионефропротекции была предпринята в недавно опубликованном долгосрочном российском исследовании [40]. Изучались в динамике СКФ, показатели систолического артериального давления (САД), диастолического артериального давления (ДАД), уровни гемоглобина (Hb), суточная протеинурия, основные показатели белкового, липидного, форфорно-кальциевого метаболизма в 3 группах пациентов с ХБП, наблюдавшихся у врачей общей практики на протяжении 72 месяцев. В состав групп были включены: 1-я группа – пациенты, получавшие МБД в комбинации с кетоаналогами аминокислот (Кетостерил), 2-я – пациенты, получавшие МБД без Кетостерила, 3-я группа – без диетических интервенций.
Полученные результаты показали, что темпы снижения СКФ в группе, получавших МБД в сочетании с назначением кетоаналогов аминокислот (-0,78 мл/мин/год), были значительно ниже, чем в группе со стандартной МБД (-4,9 мл/мин/год).
В конце периода наблюдения начало заместительной почечной терапии потребовалось 9,7% пациентов 1-й группы (Кетостерил), 18,1% 2-й и 40% 3-й групп.
За период наблюдения суточная протеинурия уменьшилась в группе получавших МБД+Кетостерил на 61% от исходной (р<0,05), темп снижения протеинурии составил 0,15 г/сут/год (р=0,000). Во 2-й группе пациентов суточная протеинурия также снизилась, но менее значительно – на 35,7% (р<0,05). В 3-й группе уровень суточной протеинурии вплоть до окончания наблюдения оставался без динамики.
Только группе пациентов, получавших МБД в сочетании с Кетостерилом, удалось достичь целевого уровня АД (<140/90 мм рт.ст.).
При этом содержание общего белка и альбумина в сыворотке крови по завершении наблюдения в 1-й группе имело тенденцию к росту и превышало соответствующие показатели 2-й группы (р=0,029)
Интересным представляется то, что нарушения белкового обмена отмечены к концу данного исследования в группе пациентов с ХБП, которым потребление белка не ограничивалось.
Таким образом, кардионефропртективные эффекты МБД, изучаемые в опубликованном исследовании, значительно потенцировались назначением кетоаналогов аминокислот.
Новые результаты оценки влияния кетоаналогов на показатели эффективности и безопасности МБД для пациентов с ХБП были представлены в работе румынских исследователей, опубликованной в этом году в журнале Американского общества нефрологов [41].
Было проведено одноцентровое проспективное рандомизированное контролируемое исследование безопасности и эффективности вегетарианской строгой малобелковой диеты с назначением кетоаналогов аминокислот по сравнению с обычной малобелковой диетой у пациентов с ХБП на додиализной стадии. Первичной конечной точкой было начало ЗПТ или 50%-ное снижение СКФ от начальной. 1413 взрослых пациента без сахарного диабета со стабильной СКФ 30 мл/мин на 1,73 м2, протеинурией, 1 г белка/г креатинина в моче, с хорошим состоянием питания и хорошей приверженностью диете были включены в исследование и получали обычную малобелковую диету. Через 3 месяца 207 пациентов были рандомизированы на 2 группы: группа 1 – больные, получавшие строгую малобелковую диету+кетоаналоги аминокислот (0,3 г/кг растительного белка и 1 таб./5 кг веса Кетостерила в сутки) или группа 2 – больные, продолжавшие получать стандартную малобелковую диету (0,6 г/кг белка в сутки) в течение 15 месяцев.
Начало диализной терапии в конце исследования требовалось меньшему числу пациентов группы с кетоаналогами аминокислот (11 по сравнению с 30%; р<0,001).
Скорректированный показатель числа больных, нуждавшхся в лечении – ЧБНЛ (NNT); (доверительный интервал 95%), чтобы избежать достижения комбинированной первичной конечной точки в соответствии с протоколом анализа составил 4,4 для пациентов с СКФ 30 мл/мин на 1,73 м2, но он снижался до 2,7 для пациентов с СКФ 20 мл/мин на 1,73 м2.
Показатели фосфорно-кальциевого обмена улучшались только в группе пациентов, получавших кетоаналоги аминокислот. Исходно в данной группе наблюдались более низкие уровни кальция, но более высокие фосфатов сыворотки.
В то время как в конце исследования, концентрации кальция повышались, фосфатов снижались. Противоположные вариации отмечены в контрольной группе со стандартной МБД. При этом, несмотря на то что потребность в кальцийсодержащих препаратах была одинаковой в обеих группах, дозы кальция были ниже в группе получавших кетоаналоги аминокислот. Кроме того, необходимость назначения витамина D в конце исследования была выше в контрольной группе (54 против 22%; р=0,004).
Заключение
Строгая малобелковая диета с назначением кетоаналогов незаменимых аминокислот в терапии пациентов с ХБП является доступным, безопасным и эффективным подходом с позиции кардионефропротекции, обеспечивающим коррекцию артериальной гипертонии, снижение протеинурии, сохранение уровня гемоглобина, профилактику нарушений белкового и фосфорно-кальциевого обменов, улучшение липидного профиля.
Строгая малобелковая диета с назначением кетоаналогов незаменимых аминокислот эффективно задерживает начало диализа, возможно, замедляя скорость прогрессирования почечной недостаточности и определенно за счет снижения уремической симптоматики.
Использование кетоаналогов незаменимых аминокислот, вероятно, повышает эффективность и безопасность назначения малобелковых диет пациентам с ХБП.



