Введение
Сердечно-сосудистые заболевания (ССЗ) остаются ведущей причиной снижения качества жизни, трудоспособности и смертности населения во всем мире. Важны и экономические аспекты этой проблемы, связанные с увеличением количества и продолжительности госпитализаций [1]. Формирование неблагоприятной эпидемиологической ситуации по ССЗ может быть объяснено с позиции сердечно-сосудистого континуума, современные представления о котором включают этапы патологического процесса кардиальной патологии от факторов риска к развитию и прогрессированию сердечно-сосудистых событий [2]. В условиях существования высокой распространенности факторов риска и хронических форм сердечно-сосудистой патологии реализуются и потенцируются этапы сердечно-сосудистого континуума, обусловливая развитие сердечно-сосудистых осложнений фатального и нефатального характера.
Несмотря на достигнутые успехи в диагностике и лечении острого коронарного синдрома (ОКС), прежде всего внедрении чрескожных коронарных вмешательств со стентированием артерий сердца, прогноз для таких больных остается не всегда благоприятным. К основным проявлениям неблагоприятного течения ишемии миокарда относятся не только летальные исходы, но и прогрессирующая сердечная недостаточность, рецидивы стенокардии, повторные инфаркты миокарда.
В настоящее время проблемы возможного неблагоприятного течения ишемической болезни сердца (ИБС) у пациентов с ОКС и оценка качества жизни в отдаленном периоде после ЧКВ – важные и не до конца решенные вопросами. Снижение вероятности повторных сердечно-сосудистых осложнений может быть реализовано назначением оптимальной медикаментозной терапии и модификацией имеющихся факторов риска. Наиболее изученные факторы риска неблагоприятного течения ИБС в отдаленном периоде после ОКС и реваскуляризации миокарда – это прогрессирующая дислипидемия, возраст старше 60 лет, количество имплантируемых стентов, курение, наличие сахарного диабета [3]. Поиск новых маркеров прогрессирования патологического процесса в условиях острой коронарной катастрофы актуален в современной медицине. Недостаточно внимания уделено прогнозированию риска развития сердечно-сосудистых осложнений на основании различных вариантов распределения водных сред организма в остром периоде коронарной патологии.
Целью исследования стала оценка влияния на нарушение распределения водных сред организма у больных ОКС, подвергшихся реваскуляризации миокарда, на риск развития сердечно-сосудистых осложнений с учетом наличия почечных факторов риска.
Материал и методы
В исследование были включены 120 пациентов с ОКС, из них 68 больных нестабильной стенокардией и 52 больных острым инфарктом миокарда. Из 120 больных 19 (16%) были женщинами и 101 (84%) – мужчинами. Средний возраст больных составил 57,76±0,8 года.
Критерии включения пациентов в исследование: выполнение коронароангиографии методом коронарного стентирования с последующей хирургической реваскуляризацией миокарда.
Для реализации поставленной цели всем включенным в исследование пациентам на госпитальном этапе проведена оценка традиционных факторов риска, таких как мужской пол, возраст, уровень общего холестерина (ОХС), наличие сахарного диабета, артериальной гипертензии и курения в анамнезе, а также показателя сократительной способности миокарда – величины фракции выброса левого желудочка (ФВ) по данным эхокардиоскопического исследования. Более того, произведен учет почечных факторов риска – наличия альбуминурии (АУ) в диапазоне 30–300 мг/мл и величины скорости клубочковой фильтрации (СКФ). Определение АУ осуществлено полуколичественным способом в порции мочи с помощью тест-полосок «Альбуфан». СКФ определен методом расчета по формуле CKD-EPI. Характеристика традиционных и почечных факторов риска представлена в табл. 1.
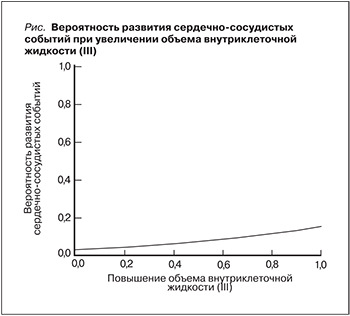
Всем включенным в исследование пациентам выполнена биоимпедансоспектрометрия с использованием 4 пар электродов, наложенных на верхние и нижние конечности. Для проведения исследования использован анализатор водных секторов организма «Диамант» (Санкт-Петербург). Обработка результатов измерений осуществлена при помощи компьютерной программы «Анализ состава тела и водного баланса». Оценены такие показатели, как объем общей воды (ООВ), объем общей жидкости (ООЖ), объем внутриклеточной жидкости (Овнутрикл.ж.), объем внеклеточной жидкости (Овнекл.ж.). Оценка распределения водных сред организма проведена в IV этапа: I этап – при первичном контакте, т.е. до проведения КАГ и стентирования коронарных артерий; II – после проведения КАГ, III – на следующие сутки после КАГ; IV этап – перед выпиской больного из стационара. Средние показатели распределения водных сред организма с учетом этапа исследования представлены в табл. 2.
 Согласно протоколу исследования, за наличие сердечно-сосудистых осложнений было принято считать развитие повторных ОКС и смерти пациентов в течение 6 месяцев после включения в исследование. Статистический анализ данных показал, что повторная коронарная катастрофа произошла у 15 (12,5%) пациентов, фатальное сердечно-сосудистое событие установлено у 1 (0,8%) больного.
Согласно протоколу исследования, за наличие сердечно-сосудистых осложнений было принято считать развитие повторных ОКС и смерти пациентов в течение 6 месяцев после включения в исследование. Статистический анализ данных показал, что повторная коронарная катастрофа произошла у 15 (12,5%) пациентов, фатальное сердечно-сосудистое событие установлено у 1 (0,8%) больного.
Статистический анализ данных проведен с помощью программного обеспечения Statistica 8,0 с использованием вычисления критерия достоверности Стьюдента, а также с помощью χ-критерия осуществлен нелинейный логистический регрессионный анализ для определения влияния исследуемых факторов. Статистически значимые различия показателей определены при значении р<0,05.
Результаты
По результатам проведенного исследования высокий уровень достоверности риска развития сердечно-сосудистых событий у пациентов с ОКС был получен при анализе величины общего холестерина (ОХС) (χ-критерий=6,99; р=0,008) и наличия курения в анамнезе (χ-критерий=4,32; р=0,03). Так, при повышении уровня ОХС более 4,5 ммоль/л вероятность развития фатальных и нефатальных сердечно-сосудистых осложнений составляет 66,6%, а у пациентов с пристрастием к курению указанный риск находился в пределах 53,4%.
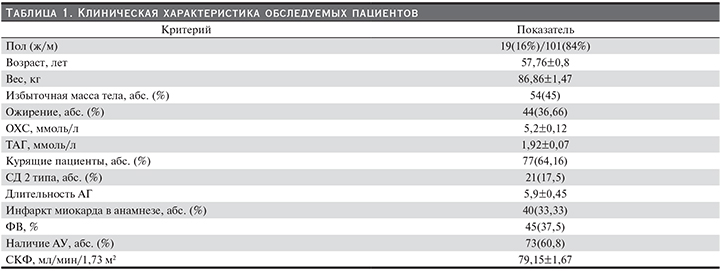
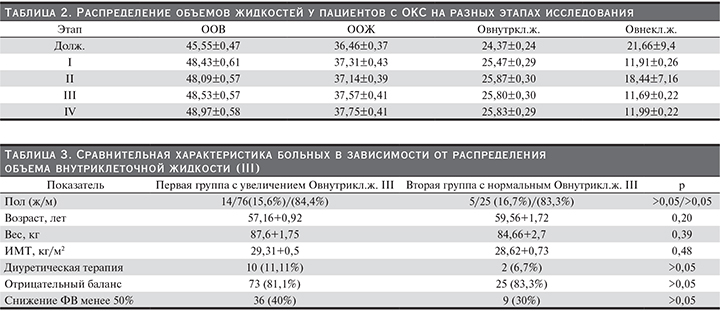
По данным проведенного исследования, на всех этапах определения баланса жидких сред организма у пациентов с ОКС наблюдалось увеличение таких показателей, как ООВ, ООЖ, Овнутрикл.ж., а также снижение Овнекл.ж. При анализе данных показателей только увеличение Овнутрикл.ж. на III этапе исследования (III) (см. рисунок) достоверно влияло на вероятность развития сердечно-сосудистых событий (χ-критерий=3,85, р=0,04). С целью определения патогенетического влияния установленного предиктора сердечно-сосудистых катастроф необходимым оказался дополнительный анализ влияния диуретической терапии на госпитальном этапе и водного баланса организма. Следует уточнить, что анализ водного баланса производился на всем протяжении внутривенного введения диуретиков. Диуретическую терапию, представленную петлевыми диуретиками, получали 12 (10%) больных, из них 10 пациентов, имевших повышение Овнутркл.ж. III, 2 человека с нормальным уровнем Овнутрикл.ж. III. Статистический анализ полученных данных не показал достоверных значений влияния применения диуретического лечения (χ-критерий= 0,53, р=0,46) и вариабельности водного баланса (χ-критерий=0,04, р=0,94) на повышение Овнутрикл.ж. на III этапе исследования. Для анализа достоверности полученных данных было принято решение выделить две группы больных, градация которых осуществлена на основании распределения Овнутрикл.ж. III. В первую группу включены пациенты с увеличенным Овнутрикл.ж. III, что составило 90 (75%) человек от всех обследуемых, во вторую группу включены больные с нормальным Овнутрикл.ж. III, что составило 30 (25%) человек. Сравнительная характеристика представлена в табл. 3. Достоверно значимых изменений при анализе влияния инфузионной и диуретической терапии, а также других показателей, способных влиять на распределение Овнутрикл.ж. III между двумя исследуемыми группами, выявлено не было (р>0,05).
Статистический анализ наличия и выраженности маркеров почечной дисфункции позволил выявить высокую встречаемость АУ. Наличие АУ было определено в 60,8% (73 пациента) случаев. Установлено, что АУ, выявленная перед проведением ЧКВ, достоверно не влияет на вероятность развития сердечно-сосудистых событий (χ-критерий=3,26; р=0,07). Однако методом логистического регрессионного анализа выявлено, что у пациентов с АУ имела место гипергидратация, обусловленная повышением внутриклеточной жидкости, в течение суток после восстановления коронарного кровотока. Установлено, что увеличение объема внутриклеточной жидкости на следующие сутки после выполнения КАГ и стентирования коронарных артерий и наличие АУ увеличивает риск развития сердечно-сосудистых осложнений (χ-критерий=6,17; р=0,04).
Согласно протоколу исследования, всем обследуемым пациентам выполнено определение насосной функции миокарда по данным эхокардиоскопического исследования. При анализе полученных данных снижение сократительной функции миокарда (фракция выброса [ФВ] менее 50%) наблюдалось в 37,5% (45 пациентов) случаев. Логистический регрессионный анализ показал, что снижение сократительной функции миокарда (ФВ менее 50%) в сочетании с увеличением объема внутриклеточной жидкости (на III этапе исследования) также приводит к риску развития сердечно-сосудистых катастроф (χ-критерий=6,93; р=0,03).
Достоверного влияния других факторов риска (наличие сахарного диабета, артериальной гипертензии, инфарктов миокарда в анамнезе) на вероятность возникновения рецидива стенокардии выявлено не было.
Обсуждение
Актуальность научно-исследовательского поиска прогностической значимости модифицируемых факторов риска развития повторных сердечно-сосудистых событий не вызывает сомнений. Выявление новых маркеров сердечно-сосудистого риска и уточнение известных предикторов острой коронарной патологии – приоритетное направление вторичной профилактики.
Известно, что повышение ОХС и наличие курения в анамнезе значительно усугубляют тяжесть течения патологического процесса ИБС. По данным многочисленных исследований установлено, что курение – одна из причин развития сердечно-сосудистых событий и смерти [4]. Увеличение уровня ОХС влияет на частоту повторных сердечно-сосудистых событий в отдаленном периоде после реваскуляризации миокарда [5].
Сердечно-сосудистая система и почки находятся в тесной взаимосвязи и путем сложных взаимодействий регулируют водно-солевой баланс [6].
О тесной связи между сердечно-сосудистым и почечным континуумом свидетельствует существование ряда клинико-лабораторных показателей, являющихся единым маркером поражения сердца и почек. Ярким примером интегрального маркера кардиоренальных повреждений служит наличие альбуминурии в диапазоне 30–300 мг/мл. По данным крупномасштабных исследований выявлена взаимосвязь между повышением уровня экскреции альбумина с мочой и резким увеличением сердечно-сосудистой заболеваемости и смертности [7]. Известен факт, согласно которому при наличии острого сердечно-сосудистого события альбуминурия является отражением единого патогенетического механизма, включающего прежде всего гемодинамический дисбаланс [8]. В результате проведенного нами исследования АУ встречалась в 60,8% (73 больных) случаев, что согласуется с общемировой концепцией кардиоренальных взаимоотношений.
Более того, развитию АУ способствует ряд клинических состояний, таких как наличие сахарного диабета, артериальной гипертензии, курение [9]. Статистический анализ проведенного нами исследования установил высокую распространенность данных факторов риска в реализации единых механизмов прогрессирования сердечно-сосудистой и почечной патологий.
Вовлечение почек в патогенетический процесс при острой форме ИБС является неотъемлемой частью патофизиологических изменений, происходящих в организме. Известно, что при развитии острой ишемии миокарда формируется гиперактивность нейрогуморальных систем, которая на начальных этапах носит компенсаторный характер, поддерживающий функцию поврежденного миокарда, в дальнейшем – патологический, потенцирующий неблагоприятный сердечно-сосудистый прогноз [10]. Чрезмерное повышение активности ренин-ангиотензин-альдостероновой системы влечет за собой такие патофизиологические процессы, как перераспределение водных сред организма с преимущественной задержкой жидкости в организме за счет альдостеронового влияния, острое прогрессирование эндотелиальной дисфункции, регуляция почечного кровотока путем вазоконстрикции сосудистой системы почек. По данным нашего исследования, только у пациентов с ОКС и АУ выявлено перераспределение объемов жидкостей, в частности увеличение внутриклеточной жидкости в течение суток после проведения ЧКВ. Очевидно, что реализация острого кардиоренального повреждения наряду с хирургической коррекцией коронарной обструкции считается единой причиной патогенетического процесса гипергидратации.
Установлено самостоятельное влияние повышения объема внутриклеточной жидкости на вероятность развития фатальных и нефатальных сердечно-сосудистых катастроф спустя 6 месяцев после развития ОКС. Необходимо отметить, что на момент включения пациентов в исследование изолированного влияния увеличения объема внутриклеточной жидкости на вероятность повторных ОКС и смерти получено не было – только в сочетании с усугубляющим патогенетическую основу ишемии миокарда фактором: наличием почечной дисфункции. Очевидно, отсутствие коррекции гипергидратации на ранних этапах ОКС приводит к прогрессированию патогенеза ИБС, прежде всего персистирующему влиянию гиперактивности нейрогуморальных систем, нарушению баланса вазоконстрикторных и вазодилататорных систем, электролитного равновесия, усугублению эндотелиальной дисфункции. Длительно существующее повышение объема внутриклеточной жидкости позволяет оценивать данный фактор как маркер неблагоприятного сердечно-сосудистого прогноза в позднем периоде после развития ОКС.
Важно отметить, что наиболее изученным влиянием фактора дисбаланса водных сред организма на прогрессирование кардиальной патологии является хроническая сердечная недостаточность. По данным мировой литературы, наличие гипергидратации у пациентов с хронической сердечной недостаточностью приводило к более тяжелому течению заболевания, сопровождающемуся частыми повторными госпитализациями [11].
В рамках проведенного исследования всем обследуемым определена сократительная способность миокарда левого желудочка. Снижение фракции выброса менее 50% многими авторами рассматривается как один из факторов риска развития сердечно-сосудистых осложнений в отдаленном периоде после ЧКВ (Marsico F., 2003; Simek S., 2003). По результатам проведенного нами исследования усугубление отдаленного прогноза фатальных и нефатальных сердечно-сосудистых осложнений реализуется при потенцирующем влиянии сократительной дисфункции миокарда и нарушении распределения водного баланса, в частности гипергидратации.
Заключение
Проведенное нами исследование позволило выявить прогностическую значимость дисбаланса водных сред организма у больных острой коронарной патологией. Дисбаланс жидкости организма может быть использован в качестве маркера и потенциально модифицируемого фактора риска развития сердечно-сосудистых событий в плане коррекции гипергидратации на госпитальном лечении больных ОКС. Более того, важно учитывать комплексное воздействие нескольких ФР (наличие АУ, снижение сократительной способности миокарда, дислипидемии, курения в анамнезе), существенно повышающих вероятность развития повторных сердечно-сосудистых катастроф.



