Анемический синдром при хронической болезни почек
Анемия является закономерным осложнением хронической болезни почек (ХБП). Снижение гемоглобина обнаруживается уже при скорости клубочковой фильтрации менее 60 мл/мин, а при ХБП 5-й стадии в отсутствие лечения анемия определяется почти у каждого больного. Начиная с 1836 г., когда Ричард Брайт впервые описал это осложнение у больных ХБП, и до настоящего времени научный и клинический интересы к различным аспектам проблемы нефрогенной анемии – механизмам развития, характеру течения, терапевтической стратегии – не ослабевают [1–5].
Нефрогенная анемия имеет многофакторное происхождение; но главная роль в ее развитии принадлежит относительному или абсолютному дефициту продукции эндогенного эритропоэтина (ЭПО). В 1906 г. P. Carnot и C. Deflander предположили, что гипоксия вызывает образование гуморального гемопоэтического фактора. В 1950 г. Reissmann представил косвенные данные в пользу эритропоэтического гормона, а в 1953 г. Erslev прямо продемонстрировал его присутствие в плазме крови животных с анемией. В 1957 г. Jacobson и соавт. по результатам экспериментальных исследований пришли к выводу, что именно почки являются источником гормона, который сейчас называется ЭПО [3]. В 1974 г. Комиссия по биологической номенклатуре Международного союза чистой и прикладной химии и Международного союза биохимиков включила ЭПО в новую номенклатуру пептидных гормонов, а в 1977 г. Miyake [6] впервые выделил эту субстанцию в небольшом количестве из мочи больных апластической анемией.
ЭПО синтезируется в основном (до 90%) в почках (интерстициальные фибробласты коркового и мозгового слоев), в меньшей степени – в печени (Купферовские клетки); органом-мишенью является костный мозг. Молекулярная масса ЭПО – 30–34 кДа, он состоит из 165 аминокислот и 4 углеводных цепей. По биологической природе ЭПО относится к группе кислых гликопротеинов, представляя собой гетерогенный протеин, который состоит из нескольких различных изоформ, образующихся в результате гликозилирования. Именно гликозилирование оказывает большое влияние на биологическую активность и стабильность ЭПО [1, 3].
ЭПО присущи все характерные для гормона признаки – он образуется в одном органе и доставляется кровью в костный мозг. Физиологическое содержание ЭПО в плазме составляет 10–15 мМЕ/мл, при уремии – во много раз ниже. К основным биологическим эффектам ЭПО относится пролиферация и дифференциация эритроидных клеток – предшественников костного мозга [1–3].
Анемический синдром, сопровождающий ХБП, становится причиной множества неблагоприятных последствий. Он ухудшает медико-социальную реабилитацию пациентов, приводя к возникновению осложнений со стороны различных органов и систем организма, ассоциируется с увеличением частоты и сроков госпитализации, стоимости лечения, а также высокой летальностью, главным образом за счет сердечно-сосудистой патологии и инфекционных заболеваний [7–9]. Нефрогенная анемия проявляется не только снижением численности эритроцитов, но и разнонаправленными размерными и морфоструктурными трансформациями красных кровяных клеток, что отражает глубокую дезорганизацию в функционировании костномозгового кроветворения [10].
В настоящее время у нефрологов нет сомнений в необходимости своевременного и адекватного терапевтического вмешательства при анемии как в додиализный период, так и на этапе диализной терапии. Лечение анемии при ХБП носит комплексный характер и предполагает воздействие на различные патогенетические механизмы, но «золотым» стандартом признаны препараты рекомбинантного человеческого ЭПО, сделавшие данное осложнение ХБП потенциально курабельным [3, 11]. Впервые ЭПО-альфа применен в клинической практике для лечения нефрогенной анемии в 1986 г., лицензирован как лекарственное средство в 1990 г. [12, 13]. Последовавшие за этими событиями рандомизированные и наблюдательные клинические исследования по оценке эффективности препаратов ЭПО продемонстрировали улучшение многих параметров, характеризующих качество жизни больных ХБП, улучшение деятельности сердечно-сосудистой системы, снижение частоты инфекционных осложнений, увеличение выживаемости, а также возможность полного исключения необходимости трансфузий эритроцитарных сред, сопряженных с высоким риском инфицирования, иммунизации и развития гемосидероза [14, 15].

В нашей стране внедрение препаратов ЭПО в клиническую практику с начала 1990-х гг. и затем вступление в действие системы Дополнительного лекарственного обеспечения (ДЛО) оказали существенное влияние на распространенность и тяжесть анемического синдрома у больных ХБП. По последним опубликованным данным Российского регистра заместительной почечной терапии, доля пациентов, начавших и продолжающих диализную терапию с уровнем гемоглобина ≥110 г/л, ежегодно увеличивается; в 2011 г. на момент включения в программу гемодиализа она составила 12,2%, к концу года на гемо- и перитонеальном диализе – 39,1 и 49,7% соответственно [16]. На первом этапе реализации программы перитонеального диализа в Московской области более половины (53,7%) пациентов перед началом лечения имели гемоглобин менее 80 г/л (медиана – 78 г/л), в последующие годы таковых была треть (34,4%, медиана – 90 г/л) [17]. Собственный многолетний опыт подтвердил высокую эффективность и безопасность ЭПО-альфа в коррекции анемии у больных ХБП на этапе диализной терапии: регистрировались повышение уровня гемоглобина, улучшение медико-социальной реабилитации, уменьшение выраженности липидного дисбаланса. Объективным свидетельством эффективности терапии ЭПО-альфа служат данные прижизненного анализа структурно-функционального состояния эритроцитов методом компьютерной фазовой морфометрии: устойчивая нормализация оптико-геометрических параметров и соотношения морфологических типов эритроцитов (нарастание макро- и снижение микроцитов), что в определенной степени служит отражением стимуляции эритропоэза и появления в кровеносном русле структурно и функционально полноценных клеток [18, 19].
Однако в целом ситуация с рациональным лечением нефрогенной анемии в нашей стране далека от своего решения. Эффективность антианемической терапии и на ранних стадиях ХБП, и в диализных центрах, и у реципиентов почечного трансплантата не одинакова, поэтому стремление к оптимизации лечебного алгоритма нефрогенной анемии будет длительно оставаться актуальной проблемой.
Индивидуальный подход к эритропоэзстимулирующей терапии: целевой уровень гемоглобина
Следует констатировать, что пик «чрезмерной увлеченности» эритропоэз-стимулирующими средствами (ЭСС) и стремления к полной нормализации уровня гемоглобина у больных ХБП миновал. Сегодня основные принципы эритропоэз-стимулирующей терапии (ЭС-терапии) этих больных – индивидуализация и персонификация. Эти принципы касаются в первую очередь определения целевых значений гемоглобина и выбора ЭСС.
Наиболее спорным вопросом на протяжении всего периода использования ЭСС оказалось определение целевого уровня гемоглобина и обеспечение поддержания его стабильности.
Хотя целая серия ранее выполненных наблюдательных исследований продемонстрировала хорошую обратную связь между уровнем гемоглобина и частотой сердечно-сосудистых событий, госпитализации и летальности; результаты не так давно опубликованных крупных рандомизированных клинических исследований (CHOIR, CREATE, TREAT) не доказали необходимости полной коррекции анемии [14, 20–24]. Отмечено, что более высокий уровень гемоглобина увеличивает у больных, страдающих ХБП, риск инсульта, артериальной гипертензии и сосудистых тромбозов [24, 25]. Поэтому обновленные версии зарубежных и национальных руководств по лечению нефрогенной анемии изменили диапазон идеального уровня гемоглобина, подчеркнув важность его индивидуального подбора (табл. 1).
Клиническая практика показывает, что длительное поддержание гемоглобина в целевом диапазоне – задача сложная. На целевой уровень гемоглобина влияют пол, возраст, первичная почечная патология, степень физической активности пациента, окружающая среда, проводимая ЭС-терапия и множество других факторов. Каждый пациент имеет свой индивидуальный целевой уровень гемоглобина, и в различных ситуациях у одного и того же пациента оптимальный гемоглобин может быть разным. Только лечащий врач может всесторонне оценить ситуацию и определить необходимый для каждого конкретного случая идеальный уровень гемоглобина.
Стойкое достижение целевого уровня гемоглобина – не единственные составляющие в индивидуальной программе ЭС-терапии. Одновременно с этим обязателен постоянный мониторинг за соотношением целевого уровня гемоглобина и дозы препарата ЭПО, необходимой для его достижения, а также строгий контроль над содержанием эндогенного железа, обеспечивающим нормальное течение эритропоэза. Установлено, что высокие дозы ЭПО, возможно указывающие на резистентность организма к ЭС-терапии, ассоциируются с неблагоприятными исходами в лечении больных ХБП: при одном и том же уровне гемоглобина смертность возрастает пропорционально увеличению дозы ЭСС [31]. Поэтому крайне важно, поддерживая уровень гемоглобина в целевом диапазоне, стремиться к использованию как можно более низких доз ЭСС, учитывая их биологическую активность и фармакокинетические особенности. Стабильности уровня гемоглобина и использованию более низких доз препаратов ЭПО также будет способствовать регулярное восполнение содержания эндогенного железа и поддержание его нормального (или максимально нормального) уровня (уровень ферритина близок к 500 мкг/л, показатель насыщения трансферрина – к 40%).
Индивидуальный подход к эритропоэз-стимулирующей терапии: выбор препарата ЭПО
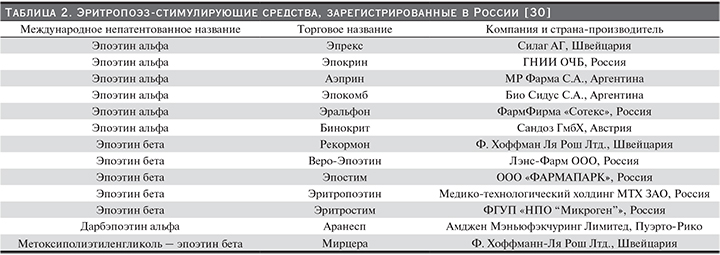
Еще одна трудность, стоящая перед клиницистом на пути построения индивидуальной программы ЭС-терапии для больного с ХБП, – выбор самого препарата ЭПО, пути его введения и определение нужной дозировки. В настоящее время в России зарегистрирован ряд ЭСС (табл. 2). Все они эффективно повышают уровень гемоглобина, и какие-либо доказательства того, что какой-то конкретный препарат превосходит другие по результатам, на сегодняшний день отсутствуют. Важные различия между ними касаются фармакокинетики, способа и частоты введения. Наличие ЭПО короткого, промежуточного и длительного действий, оригинальных препаратов и биоаналогов ЭПО, а также информация о безопасности, преимуществах и недостатках, стоимости и доступности каждого из них расширяют возможности практикующего врача в назначении того или иного ЭСС.
К преимуществу ЭПО с коротким периодом полувыведения относится хорошая управляемость действием препарата в плане постепенного титрования дозы ЭСС и быстрого реагирования на снижение или повышение уровня гемоглобина, что облегчает достижение целевого значения гемоглобина. Включение короткодействующих ЭПО в индивидуальную программу ЭС-терапии делает ее достаточно гибкой, возможно более гибкой, чем схема лечения с использованием ЭПО длительного действия.
Следующая цель, стоящая перед клиницистом при достижении адекватного целевого уровня гемоглобина на фоне ЭС-терапии, – обеспечение стабильности полученного результата и предупреждение последствий вариабельности уровня гемоглобина. Известно, что на вариабельность уровня гемоглобина влияет не только проведение ЭС-терапии, но множество других факторов – общее состояние пациента, особенности выполнения диализной процедуры и др., причем врачебный контроль за некоторыми из этих факторов очень труден. Вариабельность уровня гемоглобина, особенно при его низком содержании, связывают с неблагоприятными исходами в лечении больных ХБП, доказано ее негативное влияние на развитие сердечно-сосудистой патологии и выживаемость пациентов с ХБП [32, 33]. В отношении взаимосвязи выбора препарата ЭПО и длительности сохранения стабильного уровня гемоглобина нет единого мнения. Получены данные об одинаковой способности короткодействующих и пролонгированных ЭСС поддерживать стабильный уровень гемоглобина. Согласно же результатам других исследований, применение дарбэпоэтина альфа приводило как к большей, так и к меньшей вариабельности уровня гемоглобина, чем применение ЭПО с коротким периодом полувыведения [34–36].
В качестве недостатка ЭПО с коротким периодом полувыведения рассматривается наличие в этой группе препаратов биоаналогов. Однако появление биоаналогов ЭПО закономерно. Истечение срока патентной защиты оригинальных ЭПО, с одной стороны, ежегодный рост числа больных ХБП и увеличение продолжительности их жизни, с другой, обусловливают возрастающую потребность в ЭСС и стимулируют разработку новых версий этих препаратов. Технологический процесс производства биоаналогов ЭПО сложен и трудоемок в плане как создания структуры самой белковой молекулы ЭПО, так и обеспечения чистоты препарата. Воспроизведение биоаналога ЭПО в полной мере идентичным оригинальному препарату практически невозможно [37]. Этот факт, а также отсутствие в доступной литературе информации о полном цикле клинических испытаний по сопоставимости эталонного препарата и большинства биоаналогов ЭПО, выполненных по установленному протоколу, объясняют настороженное отношение некоторых ведущих нефрологов к этим биоаналогам ЭПО [38].
В то же время биоаналоги ЭПО обладают и некоторыми преимуществам, такими как снижение стоимости лечения, доступность, возможность перехода на использование ЭСС отечественного производства. В условиях сложившейся экономической ситуации интерес специалистов к отечественным ЭСС особенно понятен. Использование собственных биоаналогов ЭПО-альфа в России началось с конца 1990-х гг.; широкое их внедрение в деятельность диализных отделений позволило существенно улучшить результаты лечения анемии у больных ХБП [16]. Отдельные клинические наблюдательные исследования, а также многолетний опыт реальной клинической практики свидетельствуют об эффективности и безопасности отечественных биоаналогов ЭПО [39–41].
В России производится несколько биоаналогов ЭПО – ЭПО-альфа и ЭПО-бета (табл. 2); с 2008 г. для медицинского применения зарегистрирована новая лекарственная форма ЭПО-альфа (Эральфон®), разработанная учеными Государственного института особо чистых препаратов (Санкт-Петербург) и выпускаемая ЗАО «ФармФирма “Сотекс”». Эральфон® – рекомбинантный человеческий ЭПО, идентичный природному; период полувыведения при внутривенном введении составляет 5–6 часов, при подкожном – 16–24. Препарат выпускается в ампулах (1 мл) с дозой 1, 2, 4, 10 тыс. ЕД и в удобных, готовых к инъекциям (предзаполненных) шприцах с автоматическим устройством защиты иглы UltraSafe Passive® (0,3–1 мл) с дозой 1, 2, 2,5, 3, 4, 5, 6, 8, 10, 12, 20, 40 тыс. ЕД.
Одно из первых многоцентровых клиническоих исследований по сопоставимости эффективности и безопасности ЭПО-альфа (Эральфон®) с оригинальными препаратами ЭПО-альфа и ЭПО-бета выполнено в 2010 г. [39]. Исследование проведено в 5 центрах гемодиализа (ГД) с включением 51 больного, который на протяжении трех предшествовавших месяцев получал постоянную дозу оригинальных ЭСС короткого действия и имел уровень гемоглобина в пределах 105–125 г/л.
Его длительность составила 12 недель: 4 недели – период адаптации дозы и 8 недель – период оценки эффективности и безопасности. Анализ полученных данных продемонстрировал сопоставимую с оригинальными ЭСС эффективность и безопасность Эральфона®. Перевод ГД-пациентов с оригинальных ЭСС на равные дозы Эральфона® не приводил к изменению среднего уровня гемоглобина, заметной вариабельности уровня гемоглобина и изменению недельной дозы препарата – средней по всей группе и индивидуальной. Не было зарегистрировано нежелательных явлений, связанных с исследуемым ЭСС, индивидуальной непереносимости или реакций на внутривенное его введение. Авторы призвали к тщательному наблюдению за продолжающимся клиническим применением препарата с оценкой профиля его эффективности и безопасности.
Последовавшие в ближайшие несколько лет публикации предоставили противоречивые данные. Мультицентровое обсервационное исследование, базирующееся на анализе 431 медицинской карты ГД-больных, получавших ЭСС (86,6% оригинальные и 13,4% биоаналоги ЭПО-альфа), зафиксировало тенденцию к увеличению частоты нежелательных явлений (не указано, каких именно) при применении отечественных биоаналогов ЭПО-альфа, на основании чего автор делает заключение о нецелесообразности замены одних препаратов ЭПО другими. Столь категоричное заключение представляется не совсем обоснованным, поскольку опирается на небольшое по объему исследование [42].
Позже проведенное методом двумерного гель-электрофореза сопоставление физико-химических свойств Эральфона® и Эпрекса® не обнаружило их полного совпадения. Степень гликозилирования Эральфона® оказалась меньше, количество изоформ эритропоэтина, соответственно, больше; оба препарата не содержали агрегатов эритропоэтина [43]. Полученные результаты свидетельствуют о том, что биологическая активность препаратов воспроизведенного и оригинального ЭПО-альфа может различаться и такой вывод требует продолжения длительного пострегистрационного мониторинга нежелательных явлений, установления их возможной связи с применением биоаналогов. Это особенно необходимо в условиях стойкого роста биоаналогов в структуре всех сегментов потребления препаратов ЭПО (ДЛО, госпитальный и розничный коммерческий), который имеет место в последние годы [44].
Крупное одномоментно-поперечное по дизайну исследование, оценивавшее влияние ЭС-терапии оригинальными и биоаналогами ЭПО на поддержание стабильного уровня гемоглобина, качество жизни и затраты на ее применение ГД-больными, проведено П.А. Воробьевым и Л.Ю. Безмельницыной [45, 46]. В исследовании приняли участие 1395 пациентов ГД-центров из 23 регионов страны. Спектр используемых ЭСС оказался очень широк – половина больных получали оригинальные ЭПО (альфа и бета) и 34% – биоаналоги ЭПО-α; 251 (18%) больной находился на лечении Эральфоном®: у 77 – он был первым ЭСС и у 174 – в результате замены других оригинальных ЭПО и их биоаналогов. Анализ полученных результатов показал, что Эральфон®, равно как и оригинальные ЭСС, обеспечивает поддержание гемоглобина на уровне более 100 г/л и оказывает положительное влияние на качество жизни, определенное по визуально-аналоговой шкале. Кроме того, Эральфон® продемонстрировал наименьшие затраты за дополнительный год жизни с поправкой на качество жизни. Обратная конверсия с Эральфона® на другие ЭСС была выполнена только 17 больным без обсуждения причины этой замены. По мнению исследователей, анализ реальной клинической практики применения ЭСС свидетельствует в пользу эффективности и хорошей переносимости Эральфона®, что позволяет рекомендовать его для длительного лечения анемии у ГД-больных. Последующие годы активного использования Эральфона® в лечении анемии у диализных больных с соблюдением контроля безопасности препарата подтвердили справедливость сделанного заключения.
По эффективности и безопасности Эральфон® по крайней мере не уступает оригинальным ЭСС. Препарат имеет современную комфортную форму выпуска и предназначен для внутривенного и подкожного введения. Его отличает широкая линейка дозировок, что обеспечивает максимально индивидуальный подход к достижению целевого уровня гемоглобина у пациентов с додиализной и диализной стадиями ХБП за счет возможности подбора оптимальной дозы как на этапе коррекции, так и в поддерживающую фазу. Эральфон® относится к классу короткодействующих ЭСС, что расширяет управляемость действием препарата и делает схему ЭС-терапии более гибкой: позволяет быстро реагировать на изменение уровня гемоглобина, проводить коррекцию дозы при развитии ЭПО-ассоциированной артериальной гипертензии или других побочных явлений. В отдельных случаях может назначаться в пролонгированном режиме дозирования с более высокими дозами без снижения гематологического ответа, что делает возможным применение препарата всем категориям больных ХБП. Имея российское производство, Эральфон® характеризуется хорошей доступностью и оптимальной стоимостью.
Современная стратегия ЭС-терапии невозможна без включения в нее биоаналогов ЭПО. Поэтому лечащему врачу важно хорошо ориентироваться в этой категории лекарственных средств и иметь четкое представление об их терапевтической эффективности и профиле безопасности. Назначение или перевод на биоаналоги ЭПО следует проводить в индивидуальном порядке после оценки лечащим врачом всех возможных рисков таких мероприятий. По-видимому, правильной тактикой будет назначение или продолжение ЭС-терапии оригинальными препаратами тяжелой категории диализных пациентов и реципиентов почечного трансплантата с нестабильной и/или ЭПО-зависимой артериальной гипертензией, перенесших сосудистые тромбозы (в т.ч. сосудистого доступа), имеющих высокую вариабельность уровня гемоглобина и индивидуальную чувствительность к рекомбинантному ЭПО. Определенному (стабильному) контингенту пациентов с ХБП на додиализном и диализном этапах, а также после трансплантации почки при наличии свободного выбора ЭСС целесообразно назначать ЭПО среднего и длительного действий.
Такая ЭС-терапия удобна и комфортна для пациентов и медицинского персонала, приводит к сокращению дозы препарата и экономии времени.
Заключение. Подавляющее большинство больных, страдающих ХБП, имеют анемию и нуждаются в заместительной ЭС-терапии. Оптимизация ЭС-терапии на современном этапе с использованием индивидуального подхода к ее программированию будет способствовать повышению эффективности и безопасности проводимой терапии. Разработка индивидуального режима ЭС-терапии включает определение оптимального уровня гемоглобина в зависимости от возраста, сопутствующих заболеваний и физической активности пациента, поддержание достигнутого результата в течение длительного периода времени с регулярным восполнением запасов эндогенного железа, а также выбор ЭСС на основе профиля фармакокинетики с применением наименьшей возможной дозы.
Потребность в ЭСС велика и будет оставаться таковой еще долгое время. Включение биоаналогов ЭПО в современную ЭС-терапию неизбежно. Следует продолжить наблюдение за клиническим применением биоаналогов ЭПО с анализом профилей их эффективности, безопасности и мониторингом нежелательных явлений.



