Введение
Трансплантация почки (ТП) является оптимальным методом лечения пациентов с терминальной хронической почечной недостаточностью (тХПН), однако сроки функционирования ренального аллотрансплантата (РАТ) ограничены из-за развития с течением времени его прогрессирующей дисфункции, морфологической основой которой является нефросклероз. Важной причиной такой дисфункции наряду с иммунологическими факторами, прежде всего антитело-опосредованным отторжением, является хроническая нефротоксичность ингибиторов кальцинейрина (ИКН) – циклоспорина (ЦсА) и такролимуса [1, 2]. Кроме того, использование ИКН реципиентами РАТ увеличивает риск развития или усугубления артериальной гипертензии, возникновения посттрансплантационного сахарного диабета, онкологических осложнений. Несмотря на это, ИКН остаются основой современных режимов иммуносупрессии при ТП, поскольку полный отказ от применения этой группы препаратов хотя и приводит к улучшению функции РАТ, но повышает риск острого отторжения [3]. В то же время появление нового класса иммуносупрессантов – ингибиторов mTOR, особенно полусинтетического ингибитора мишени m-TOR эверолимуса, привело к разработке и внедрению режимов его использования с одновременным снижением экспозиции ИКН в ранние сроки после ТП (в т.ч. сразу после операции) у стабильных реципиентов с низким и умеренным иммунологическим риском [4–7]. Применение этих режимов способствовало улучшению функции РАТ без снижения эффективности иммуносупрессии по сравнению с использованием обычных доз ИКН в сочетании с микофенолатами. В то же время поздняя конверсия на эверолимус (более 6 месяцев после ТП) не показала отчетливого позитивного влияния на функцию РАТ, хотя в подгруппе пациентов с клиренсом креатинина более 50 мл/мин отмечено значимое повышение скорости клубочковой фильтрации (СКФ) после поздней конверсии по сравнению с контрольной группой [8].
Иммуносупрессивный эффект эверолимуса обеспечивается за счет подавления сигнала к пролиферации и клональной экспансии T-клеток, активированных интерлейкином-2 и интерлейкином-15, что отличается от механизма иммуносупрессивного действия ИКН. Кроме того, эверолимус обладает не только иммуносупрессивным, но и антипролиферативным действием, подавляя в числе других и рост гдадкомышечных клеток сосудистой стенки и эндотелиальных клеток, подавляя таким образом процессы патологического сосудистого ремоделирования [9]. У эверолимуса также отсутствуют неблагоприятные гемодинамические эффекты, свойственные высоким дозам ИКН. Учитывая указанные выше особенности препарата, комбинация эверолимуса и сниженной дозы ИКН у стабильных реципиентов РТ невысокого иммунологического риска представляет собой стратегию иммуносупрессии, позволяющую предотвращать развитие и прогрессирование дисфункции трансплантата.
Целью данного наблюдательного проспективного неинтервенционного исследования была оценка безопасности и переносимости эверолимуса взрослыми пациентами после ТП с минимальными проявлениями дисфункции РАТ. К вторичным целям относятся оценка эффективности применения эверолимуса взрослыми реципиентами РАТ, получающими поддерживающую иммуносупрессию на основе этого препарата, путем фиксации частоты острого отторжения, выживаемости пациентов и трансплантатов на протяжении 12 месяцев наблюдения, а также оценка функции трансплантата (динамика уровня сывороточного креатинина и СКФ на протяжении 12 месяцев).
Материал и методы
Было проведено 12-месячное проспективное неинтервенционное неконтролируемое мультицентровое постмаркетинговое наблюдательное исследование, спонсором которого выступала компания ООО «Новартис Фарма». Все диагностические и терапевтические вмешательства проводились только в соответствии с решениями лечащего врача и не были специально предусмотрены протоколом исследования. Сбор данных был начат 15.03.2008, закончен 31.12.2014.
Использовались следующие критерии включения: мужчины и женщины старше 18 лет; первичная ТП от умершего или живого донора; сроки 4–60 месяцев после операции; подписанное информированное согласие на участие в исследовании; пациенты, получающие Сандиммун Неорал; пациенты, которым врач уже назначил терапию Сертиканом в соответствии с инструкцией по медицинскому применению. Критерии исключения: гиперчувствительность к эверолимусу или другим ингредиентам препарата; эпизоды острого отторжения в течение последних 6 месяцев; протеинурия>1 г/сут; СКФ<40 мл/мин; любые тяжелые сопутствующие заболевания или нестабильное состояние, которые, по мнению врача, могли послужить причиной неучастия в исследовании; беременность, кормление грудью или планирование беременности в течение исследования.

В исследование были включены 45 взрослых реципиентов РАТ с низким иммунологическим риском и минимальной дисфункцией трансплантата, наблюдавшихся и получавших поддерживающую иммуносупрессивную терапию в 9 центрах различных регионов России: Москва – 2 центра (исследователи – Е.С. Столяревич, Е.И. Прокопенко, Е.О. Щербакова), Санкт-Петербург – 2 центра (И.В. Ульянкина, Т.В. Денисова), Уфа (И.Р. Курбангулов), Самара (A.A. Авдеева), Омск (С.Б. Семченко), Иркутск (O.A. Козина), Якутск (A.A. Авдеева). Завершили исследование 40 пациентов: двое преждевременно прекратили исследование на момент визита пятеро (6 месяцев) в связи с финансовыми причинами (отсутствие у центра возможности продолжить терапию эверолимусом), трое прекратили участие на момент визита 6 (12 месяцев): двое в связи с финансовыми причинами, один пациент выбыл из исследования в связи с потерей трансплантата на фоне подтвержденного биопсией острого отторжения.
Протоколом исследования не предусматривались какие-либо инвазивные вмешательства. Иммуносупрессия до момента включения пациента проводилась в соответствии с практикой, принятой в центре и состояла из ЦсА (Сандиммун Неорал®) в сочетании с микофенолатами (Майфортик или ММФ) и кортикостероидами. Эверолимус (Сертикан®) назначался в соответствии с инструкцией по медицинскому применению перорально два раза в день в стартовой дозе 1,5 мг/сут с подбором дозы до достижения целевой концентрации эверолимуса в крови 3–8 нг/мл в сочетании со снижением (~на 50%) дозы ЦсА. Препарат микофеноловой кислоты отменялся вечером накануне приема первой дозы эверолимуса. Кортикостероиды применялись в соответствии с практикой центра на протяжении всего времени проведения исследования.
Прием первой дозы эверолимуса считался первым днем участия в исследовании (День 1). Далее пациенты наблюдались в день 4–5, в день 14 и через 3, 6, и 12 месяцев. Во время визитов оценивались жалобы, проводилось физикальное обследование, выполнялся клинический и биохимический анализы крови, рассчитывалась СКФ (по формуле Кокрофта–Голта), оценивалась протеинурия, C0-концентрация эверолимуса и C0-концентрация ЦсА, регистрировались эпизоды острого отторжения, инфекционные и онкологические осложнения, другие нежелательные явления.
С0-концентрация эверолимуса и ЦсА (через 12 часов после последнего приема препарата) в сыворотке крови оценивались на протяжении 12 месяцев в соответствии с практикой центра. В 2008–2010 гг. концентрация эверолимуса в сыворотке крови определялась локально в центрах с использованием зарегистрированного в России метода флуоресцентно-поляризационного иммуноанализа (ФПИА) на широко используемых TDx-анализаторах (TDX Abbott-Seradyn Innofluor Assay). В 2012 г. была внедрена новая, более точная, методика определения концентрации эверолимуса в сыворотке крови с применением анализаторов типа Furuno CA 90 с использованием специфичных для эверолимуса наборов компании Thermo Fischer.
Острое отторжение диагностировалось в соответствии с практикой, принятой в центре. В отсутствие биопсии диагноз предполагаемого острого отторжения устанавливался на основании клинико-лабораторных проявлений. Если на фоне острого отторжения проводилась биопсия почки и лечение отторжения, эти данные фиксировались в карте наблюдения за пациентом как «острое отторжение, подтвержденное биопсией» в соответствии с критериями классификации Banff 1997–2005.
Демографические данные, исходные показатели и показатели, относящиеся к периоду наблюдения, анализировались с использованием методов описательной статистики (среднее значение, стандартная ошибка среднего, медиана, минимальное и максимальное значения, размах, число валидных случаев – для количественных переменных; число, доля, распределение – качественных переменных). Статистическое сравнение переменных между их исходным значением и значением через 12 месяцев проводилось с использованием парного t-теста с расчетом показателя статистической достоверности (p-values).
Результаты
Из 45 пациентов, включенных в исследование, 27 (60%) пациентов были мужского пола и 18 (40%) – женского. Средний возраст пациентов составил 39,6±1,5 года (диапазон – 19–59 лет). Средняя масса тела пациентов составила 68,2±2,0 кг (диапазон – 37–115 кг). Среднее время от момента ТП и до момента включения пациента в исследование составило 32,1±2,6 месяца. Большинство (n=18) пациентов были конвертированы на эверолимус в сроки 3–5 лет после трансплантации, 3 пациента – в сроки до 0,5 года после ТП, 9 больных – 0,5–1 год, 1 пациент – 1–1,5 года, 9 пациентов – 1,5–2 года, 5 больных – в сроки 2–3 года.
У подавляющего большинства (73,3%) пациентов основной причиной развития тХПН стал хронический гломерулонефрит (табл. 1). На втором и третьем местах по частоте оказались поликистоз почек (8,9%) и нефропатия неясной этиологии (6,7%).
 Только у 15 (31,1%) пациентов в анамнезе не было указаний на ранее проведенную биопсию РАТ (31,1%), в то время как 31 (68,9%) пациенту была проведена биопсия в различные сроки после трансплантации (табл. 2). Морфологические признаки хронической трансплантационной нефропатии I или II степени присутствовали у 29 из 31 (93,5%) пациента, циклоспориновой нефротоксичности – у 23 из 31 (74,2%) больного. Ни в одном из биоптатов не было признаков острого или хронического отторжения РАТ.
Только у 15 (31,1%) пациентов в анамнезе не было указаний на ранее проведенную биопсию РАТ (31,1%), в то время как 31 (68,9%) пациенту была проведена биопсия в различные сроки после трансплантации (табл. 2). Морфологические признаки хронической трансплантационной нефропатии I или II степени присутствовали у 29 из 31 (93,5%) пациента, циклоспориновой нефротоксичности – у 23 из 31 (74,2%) больного. Ни в одном из биоптатов не было признаков острого или хронического отторжения РАТ.
В течение 12 месяцев наблюдения не было зафиксировано летальных исходов. У одного пациента отмечена потеря трансплантата в связи с тяжелым острым отторжением, резистентным к терапии, пациент вернулся на программный гемодиализ. В ходе исследования острое отторжение было выявлено у 3 (6,7%) пациентов: у одного – предполагаемое острое отторжение на визите 4 (месяц 3), которое не требовало терапии (биопсия не проводилась); у одного – острое отторжение на визите 5 (месяц 6), подтвержденное биопсией (Banff IA) и потребовавшее терапии, и у одного пациента – более тяжелое острое отторжение на визите 6 (месяц 12), подтвержденное биопсией (Banff IIA) и потребовавшее терапии.
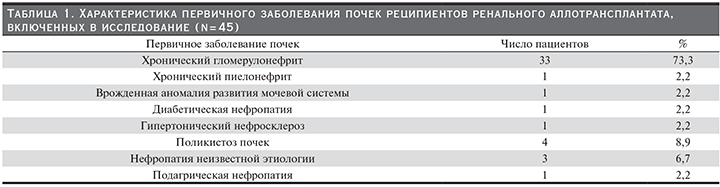
Исходный уровень креатинина в сыворотке крови (день 1) составлял в среднем 161,0±5,2 мкмоль/л, через 12 месяцев наблюдения и иммуносупрессии на основе эверолимуса оставался стабильным, без тенденции к увеличению – 160,5±8,6 мкмоль/л, p=0,69 (рис. 1).
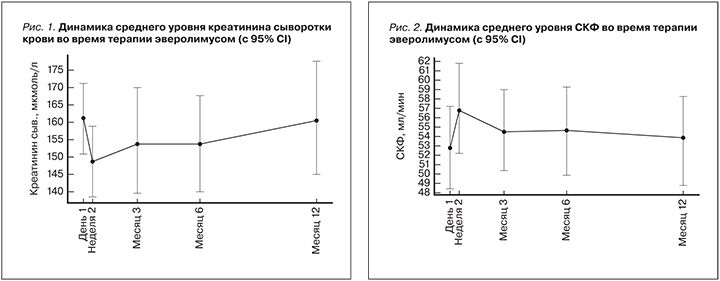
Средняя расчетная СКФ исходно (в день 1) составляла 52,8±2,1 мл/мин, а через 12 месяцев этот показатель несколько увеличился и составил 53,9±2,3 мл/мин, хотя различия не достигли уровня статистической достоверности, p=0,15 (рис. 2).
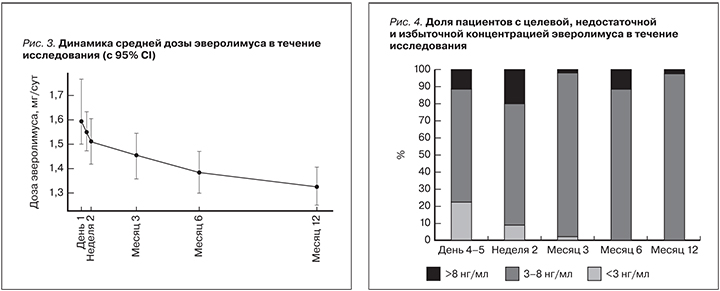
Средняя суточная доза эверолимуса исходно составляла 1,6±0,07 мг/сут, а через 12 месяцев – 1,3±0,05, т.е. за время наблюдения произошло значимое снижение дозы препарата, p=0,004 (рис. 3).
При этом у подавляющего большинства пациентов средняя концентрация эверолимуса в сыворотке крови находилась в целевом диапазоне 3–8 нг/мл (рис. 4).
На визите 2 (день 4–5) 23% пациентов имели экспозицию эверолимуса ниже целевого уровня, у 11% пациентов концентрация эверолимуса в крови превышала целевое значение. На визите 3 (неделя 2) только 9% пациентов имели концентрацию эверолимуса в крови ниже целевого уровня, а у 20% пациентов концентрация препарата в крови была выше целевого значения. На протяжении последующих этапов наблюдения через 3, 6 и 12 месяцев у подавляющего большинства больных концентрация эверолимуса находилась в пределах целевых значений: 95%, 88 и 98% пациентов соответственно.
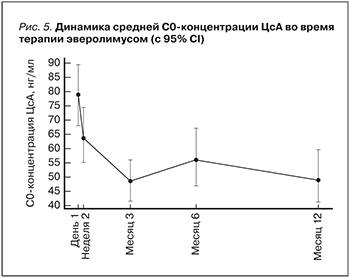
В соответствии с инструкцией эверолимус применяется в сочетании со сниженной экспозицией ЦсА. У всех пациентов суточная доза ЦсА при назначении эверолимуса снижалась приблизительно на 50% и на момент включения пациента в данное исследование средняя суточная доза ЦсА составляла 1,6±0,09 мг/кг/сут. На протяжении последующих 12 месяцев экспозиция ЦсА продолжала снижаться, и через 12 месяцев средняя суточная доза ЦсА составляла 1,1±0,09 мг/кг/сут. Разница между исходной суточной дозой ЦсА и суточной дозой через 12 месяцев составила 0,4±0,08 мг/кг/сут (p=0,05). Средняя С0-концентрация ЦсА также снизилась с 79,0±5,6 нг/мл в день 4–5 после назначения эверолимуса до 49,0±4,5 нг/мл через 12 месяцев его применения. Разница между исходной С0-концентрацией ЦсА и концентрацией на момент окончания исследования оказалась статистически достоверной, p<0,001 (рис. 5).
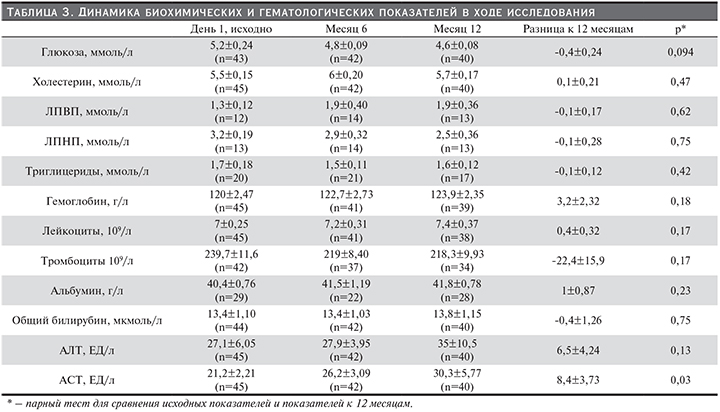
Во время исследования не было выявлено достоверных изменений в динамике средних значений основных гематологических параметров и биохимических показателей сыворотки крови, за исключением некоторого увеличения среднего значения АСТ, оставшегося, однако, в пределах нормальных значений (табл. 3). Отмечена тенденция к снижению среднего уровня глюкозы крови с 5,2±0,24 ммоль/л в начале исследования до 4,6±0,08 ммоль/л через 12 месяцев (p=0,094), что вполне логично, учитывая значимое снижение к моменту окончания исследования экспозиции ЦсА, обладающего диабетогенным действием.
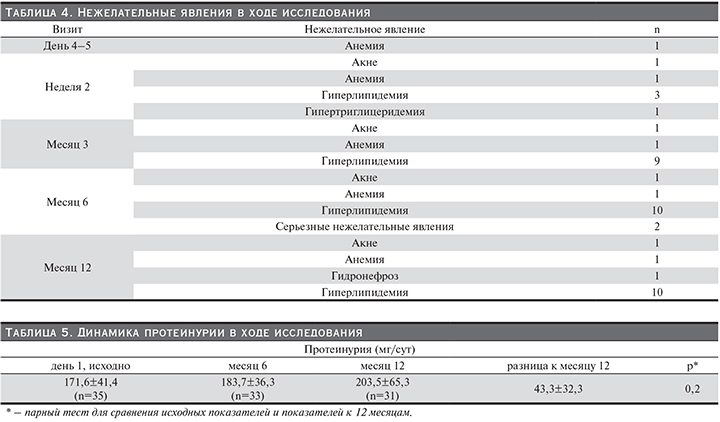
 В течение 12 месяцев наблюдения нежелательные явления были отмечены у 44,5% пациентов (у 20 из 45). У 8 пациентов отмечено более двух нежелательных явлений. Все нежелательные явления, зафиксированные в картах индивидуального наблюдения за пациентами, представлены в табл. 4. Чаще всего наблюдалась гиперлипидемия, но уровень общего холестерина и холестерина ЛПНП удавалось корригировать назначением липидснижающих препаратов.
В течение 12 месяцев наблюдения нежелательные явления были отмечены у 44,5% пациентов (у 20 из 45). У 8 пациентов отмечено более двух нежелательных явлений. Все нежелательные явления, зафиксированные в картах индивидуального наблюдения за пациентами, представлены в табл. 4. Чаще всего наблюдалась гиперлипидемия, но уровень общего холестерина и холестерина ЛПНП удавалось корригировать назначением липидснижающих препаратов.
В ходе исследования было зафиксировано два серьезных нежелательных явления. У одного пациента развилась инфекция, вызванная вирусом Эпштейна–Барр (верифицированная с помощью определения ДНК вируса в крови), что потребовало дополнительной госпитализации и противовирусной терапии. Лечащий врач расценил это нежелательное явление как не имеющее прямой связи с эверолимусом. Еще у одного пациента развилась мочевая инфекция на фоне почечно-клеточной карциномы с последующим развитием гидронефроза и выраженным снижением функции РАТ.
В исследовании не было пациентов, которые прекратили бы наблюдение в связи с отменой препарата, обусловленной выраженными отклонениями в лабораторных показателях.
Важным показателем состояния РАТ является суточная протеинурия. К 12 месяцам наблюдения не было отмечено значимого роста суточной протеинурии по сравнению с исходным уровнем (табл. 5).
В процессе наблюдения не было обнаружено значимых изменений среднего уровня диастолического АД (исходно он составлял 82,6±1,2, через 12 месяцев – 82,1±1,3 мм рт.ст., p=0,39), а среднее значение систолического АД достоверно снизилось со 131,4±1,7 мм рт.ст. в начале наблюдения до 127,1±1,8 в финале исследования, p=0,01 (рис. 6).
В конце исследования на визите 6 (через 12 месяцев лечения эверолимусом) исследователи оценили его переносимость как «хорошо» у 35 (77,8%) пациентов, у остальных 10 (22,2%) больных – как «удовлетворительно». Пациентов с оценкой переносимости «плохо» не было.
Обсуждение и выводы
Результаты, полученные в ходе данной проспективной наблюдательной программы у реципиентов РАТ с минимальной дисфункцией трансплантата, не связанной с отторжением, показали, что применение эверолимуса в рутинной клинической практике в сочетании со сниженной экспозицией ЦсА у пациентов невысокого иммунологического риска не ухудшало общей эффективности терапии (отмечена 100%-ная выживаемость пациентов через 12 месяцев, только один больной потерял трансплантат к этому сроку наблюдения).
У пациентов, получавших эверолимус, отмечена стабилизация функции трансплантированной почки на фоне контроля нефротоксичности основного компонента иммуносупрессии ЦсА за счет снижения его дозы и концентрации в крови. Через 12 месяцев средний уровень расчетной СКФ на 2 мл/мин превысил исходный уровень, однако это повышение оказалось статистически недостоверным (p=0,15), по-видимому, в связи с поздней конверсией на эверолимус. Назначение эверолимуса с одновременным снижением экспозиции ЦсА не сопровождалось снижением общего уровня иммуносупрессии. Через 12 месяцев экспозиция циклоспорина была дополнительно снижена на ~17% (p=0,05), однако общая частота случаев острого отторжения оставалась на низком уровне (6,7%).
В течение 12 месяцев наблюдения не было отмечено случаев отмены эверолимуса в связи с какими-либо неблагоприятными изменениями лабораторных показателей, включая протеинурию и неконтролируемую гиперлипидемию. Зафиксировано два случая серьезных нежелательных явлений, не связанных, по мнению лечащего врача, с применением эверолимуса. Не было выявлено изменений гематологических показателей, свидетельствовавших о возможной токсичности эверолимуса для костного мозга.
Представляется важным, что к моменту окончания исследования наблюдалось снижение уровня глюкозы крови с тенденцией к статистической достоверности, а также достоверное снижение среднего уровня систолического АД. Это может благоприятно сказаться на выживаемости пациентов в случае сохранения данного эффекта в дальнейшем, поскольку известно, что сахарный диабет и артериальная гипертензия являются важнейшим фактором риска сердечно-сосудистых осложнений у реципиентов РАТ [10].
Результаты данного наблюдательного исследования согласуются с таковыми, полученными в ходе клинического испытания фазы IIIb ASCERTAIN [8], в котором реципиентов РАТ, длительно (в среднем 5,6 года) получавших поддерживающую иммуносупрессию на основе полной дозы ИКН, конвертировали на эверолимус с минимизацией или элиминацией ИКН. По данным этого исследования, не было получено статистически значимых преимуществ такой поздней конверсии на эверолимус. В нашем исследовании мы также не получили статистически достоверного улучшения функции трансплантата у реципиентов РАТ с невысоким иммунологическим риском, конвертированных на эверолимус в среднем через 32,1±2,6 месяца стандартной иммуносупрессии на основе полных доз ЦсА. При этом результаты нашего исследования показали и отсутствие существенного снижения функции трансплантированной почки на протяжении 12 месяцев наблюдения, что позволяет сделать вывод о стабилизации функции трансплантата за счет снижения экспозиции нефротоксичного компонента иммуносупрессии в схеме с эверолимусом и антипролиферативного эффекта эверолимуса.
Таким образом, применение режима иммуносупрессии на основе эверолимуса в сочетании с кортикостероидами и сниженной экспозицией ИКН в течение 12 месяцев было эффективным и безопасным для пациентов после ТП с невысоким иммунологическим риском и минимальной дисфункцией трансплантата. Вероятно, применение такого иммуносупрессивного режима в отсутствие признаков отторжения трансплантата может способствовать контролю естественного течения хронической трансплантационной нефропатии и торможению ее прогрессирования, однако это должно быть доказано в рамках сравнительных рандомизированных клинических испытаний с достаточно большими сроками наблюдения.

