Вирус гепатита С относится к основным этиологическим факторам смешанной криоглобулинемии, а HCV-ассоциированный криоглобулиемический васкулит (КВ) считается классической моделью вирус-индуцированного васкулита [1]. Тяжелые формы КВ, протекающие с поражением почек, легких, могут выходить на первый план в клинической картине хронической HCV-инфекции и определять жизненный прогноз больного еще до развития цирроза печени и его осложнений [2, 3]. Лечение HCV-ассоциированного васкулита представляется сложной задачей и включает как этиотропную, так и патогенетическую терапию. Тактика лечения зависит от активности васкулита. При угрожающих жизни состояниях, а именно в случаях развития быстропрогрессирующего гломерулонефрита, поражения легких, быстрый эффект могут быть достигнут применением иммуносупрессивной терапии и ритуксимабом, плазмоферезом с последующим назначением противовирусной терапии (ПВТ). Основная цель лечения HCV-ассоциированного васкулита – полная ремиссии, т.е. отсутствие РНК вируса гепатита С и криоглобулинов [4].
Этиотропное лечение в виде ПВТ остается крайне важным аспектом в лечении васкулита. Классическая комбинированная терапия интерферонами и рибавирином обладала более низкой эффективностью для пациентов с НСV-ассоциированным КВ, чем при гепатите С в целом [5]. Элиминация вируса чаще наблюдалась при нетяжелых проявлениях васкулита (сосудистая пурпура, артралгии, слабость). Наиболее резистентные к ПВТ – это невропатии и поражения почек [6]. Кроме того, ПВТ на основе интерферона могла приводить к обострениям васкулита, а жизнеугрожающие формы васкулита являлись противопоказанием к ПВТ [7, 8]. В связи с чем полная ремиссия васкулита достигалась редко. Появление новых противовирусных препаратов с их высокой эффективностью и безопасностью, по-видимому, могут в значительной степени улучшать результаты лечения васкулита. Однако в настоящее время еще не накоплено достаточного опыта по применению препаратов прямого действия (ППД) в отношении пациентов с тяжелым поражением почек. В литературе представлены отдельные клинические случаи и малочисленные клинические исследования без рандомизации и контрольной группы [9–12]. Протоколы большинства исследований содержали софосбувир, ограничением которого служило снижение скорости клубочковой фильтрации (СКФ) более 30 мм/мин, что может лимитировать его применение пациентами с поражением почек [13]. Одной из схем, не зависящей от функции почек, считается совместное назначение асунапревира и даклатасвира. Асунапревир и даклатасвир продемонстрировали высокую эффективность и прекрасный профиль безопасности в отношении как пациентов с нормальной функцией почек, так больных терминальной хронической почечной недостаточностью [14–17]. Однако данные о применении асунапревира даклатасвира при HCV-ассоциированном криоглобулинемческом васкулите крайне скудны. Приводим собственный опыт успешной эрадикации вируса гепатита С асунапревиром и даклатасвиром у пациента с КВ, леченного высокодозной патогенетической терапией и плазмоферезом (см. рисунок).
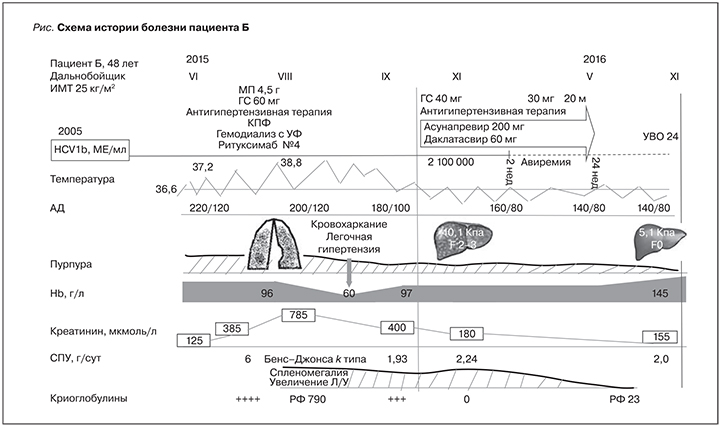
Пациент Б. 1967 г.р., водитель, отец пятерых детей, поступил с жалобами на общую слабость, быструю утомляемость, боли в коленных суставах, высыпания на нижних конечностях.
Ранее считал себя здоровым, вел активный образ жизни, работал. Около 10 лет назад диагностирован хронический гепатит С, генотип 1в. Неоднократно обследовался перед проведением противовирусной терапии (ПВТ) на основе интерферона. C учетом низкой биохимической активности (трансамназы не более 1,2–1,5 нормы), минимальной степенью фиброза F0 по METAVIR, верифицированной по данным эластометрии и фибротеста, и наличием неблагоприятного предиктора эрадикации вируса (аллель Т гена интерлейкина 28В), от ПВТ решено было воздержаться.
В 2011 г. стал отмечать немотивированную слабость, повышение температуры до субфебрильных цифр, появление артралгий в крупных суставах. Через год впервые появилась рецидивирующая мелкоточечная сыпь на нижних конечностях, преимущественно на голенях, возникавшая после физических нагрузок и переохлаждений, проходившая самостоятельно. В июне 2015 г. ухудшение состояния в виде нарастающей слабости, головных болей, что послужило поводом для госпитализации в терапевтическое отделение. Там было выявлено повышение АД до 200/120 мм рт.ст. и быстропрогрессирующая почечная недостаточность с нарастанием креатинина с 125 до 385 мкмоль/л в течение нескольких дней, что послужило поводом для перевода во 2-е нефрологическое отделение ГКБ № 52.
При поступлении состояние средней тяжести. Рост – 179 см, вес – 81 кг. ИМТ – 25 кг/м2. Температура тела – 37,20С. Кожные покровы бледной окраски. На коже голеней геморрагическая сыпь различного срока давности. Пастозность голеней. В легких дыхание жесткое, крепитация в нижних отделах легких с обоих сторон, ЧД – 18 в минуту. Границы сердца не расширены, тоны сердца приглушены, ритмичны, шумы не выслушиваются. АД – 180/90 мм рт.ст., акцент II тона над аортой. Пульс напряженный, ритмичный, 88 уд./мин. Живот мягкий, безболезненный, печень выступает на 2 см ниже реберной дуги, пальпировался нижний полюс селезенки. Перкуторно асцит не определяется. Отеков нет. Стул оформленный, 1 раз в сутки, без патологических примесей. Моча обычного цвета. Диурез до 1800 мл в сутки.
При лабораторном обследовании: лейкоциты – 9,7×10^9/л; тромбоциты – 195×10^9/л; СОЭ – 24 мм/ч; нормохромная нормоцитарная анемия: гемоглобин – Hb 96 г/л. Снижение общего белка за счет альбумина на фоне нормального уровня трансаминаз, отсутствие холестаза: общий белок – 62 г/л, альбумин –29,8 г/л; АСТ – 13,3 ЕД/л; АЛТ – 10,6 ЕД/л; ЩФ – 92,4 ЕД/л; ГГТ – 43,3 – ЕД/л.
Обращало на себя внимание значительное нарушение азотовыделительной функции почек (креатинин – 785 мкмоль/л, СКФ – 7 мл/мин (CKD-EPI), мочевина – 5,1 ммоль/л, калий – 5,1 ммоль/л), что потребовало сеансов заместительной почечной терапии. Активный нефритический синдром (в общем анализе мочи: уд. вес – 1014; лейкоциты – 35,1 кл. в мкл; эритроциты – 30,6 кл. в мкл, белок – 2,3; суточная протеинурия достигала 6 г/сут).
Иммунологическое исследование выявило криоглобулинемию ++++, снижение гемолитической активности комплемента С4 2 (10–40 мг/дл), С3 – 114 (90–170 мг/дл) и несколько измененный спектр иммуноглобулинов (IgM – 188 [130–170 мг/дл]), IgA – 145 (210–290 мг/дл, IgG – 799 [1200–1400 мг/дл]).
Ревматоидный фактор – 790 г/л.
УЗИ почек: увеличение размеров почек, признаки острой нефропатии.
На КТ органов брюшной полости и грудной клетки признаки гепатоспленомегалии, портальной гипертензии (расширение воротной вены от 14 мм). Лимфоаденопатия забрюшинных, внутригрудных, гепатогастральны, подмышечных узлов. Интерстициальные изменения в нижних отделах легких с двух сторон.
Персистирующая криоглобулинемия, увеличение селезенки и лимфатических узлов требовали исключения лимфопролиферативного заболевания. Проведена трепанобиопсия, данных за лимфопролиферативное заболевание не получено. Иммунохимическое исследование белков сыворотки крови и мочи выявило моноклональную секрецию белка Бенс–Джонса типа.
Примерно через неделю повышение температуры до 38,80С и появляются жалобы на кровохарканье со снижением гемоглобина до 60 г/л, что расценивается как легочное кровотечение в рамках КВ. Повторно проводится КТ грудной клетки, на которой данных за пневмонию не получено. Верифицирован фиброзирующий альвеолит в виде очагово-сливного интерстициального процесса в легких с обеих сторон по типу матового стекла.
Таким образом, имел место не вызывающий сомнений криоглобулинемический васкулит, ассоциированный с HCV-инфекцией с поражением почек (быстропрогрессирующий гломерулонефрит с острой почечной недостаточностью, нефротически нефритическими синдромами [СКФ – 17 мм/мин), легких (фиброзирующий альвеолит с состоявшимся легочным кровотечением], кожи (пурпура). Артериальная гипертония 3-й ст. Анемия.
В связи с тяжестью состояния (гемоглобин – 63 г/л) и характерной клинической картиной от биопсии почки решено было воздержаться.
С учетом тяжелого васкулита с жизнеугрожающими состояниями, такими как быстропрогрессирующий гломерулонефрит и легочный васкулит с кровотечением, начата патогенетическая пульс-терапия глюкокортикостероидами (метилпреднизолон в суммарной дозе 4,5 г/сут, преднизолон 60 мг в сутки внутрь).
С учетом высокого риска гепатотоксичности цитостатиков начата биологическая терапия препаратом ритуксимабом суммарно 2 г в сочетании с иммуноглобулином человека (сумарно 40 г).
В связи с выраженной криоглобулинемией и легочным кровотечением проведены сеансы плазмообмена с объемом замещения до 2 литров (плазмаферез № 8). Заместительная почечная терапия: сеансы гемодиализа с ультрафильтрацией. Для снижения АД получал 5-компонентную анигипертензивную терапию моксонидином, нифедипином, доксазозином, карведилолом, лозартаном. С целью профилактики оппортунистических инфекций – ко-тримоксазол 480 мг/сут. Для коррекции анемия препараты эритропоэтина до 18 тыс. в неделю.
На фоне высокодозной патогенетической терапии глюкокортикостериодами и ритуксимабом достигнута максимально возможная стабилизация состояния: уровень азотемии был стабилен, креатинин в пределах 400 мкмоль/л, тенденция к регрессу протеинурии (СПУ – 1,93), нарастание альбумина до 34,7 г/л, отмечено повышение уровня гемоглобина (Hb – 97 г/л) и некоторое снижение криоглобулинов до 3+++. Показаний к продолжению заместительной почечной терапии не было. Через 41 день от момента поступления пациент выписывается с настоятельными рекомендациями провести ПВТ хронической HCV-инфекции.
Назначение ПВТ на основе интерферона и рибавирина не представлялось возможным с учетом активного системного процесса и явления азотемии. Снижение СКФ значительно затрудняет дозирование рибавирина и повышает риск развития анемии [18]. Кроме того, лимитирующими факторами в достижении эрадикации вируса гепатита С стал генотип 1в и аллель Т гена интерлейкина 28В. Успех терапии на основе интерферона при данных факторах не превышает 20–30% [19]. В связи с чем от интерферонсодержащих схем решено было воздержаться. Большинство препаратов ППД имеет не только высокую эффективность, хороший профиль безопасности, но и печеночный метаболизм, что позволяет их использовать пациентам с хронической болезнью почек. Одной из таких схем служит совместное использование асунапревира и даклатасвира в течение 24 недель. Одним из противопоказаний к применению данной схемы является декомпенсированный цирроз печени (ЦП) и ЦП более 7 баллов по системе Чайлд–Таркот–Пью [20, 21]. Так, при ЦП концентрация асунапревира повышается в 76,5 раз, что может проявляться гепатотоксичностью и приводить к декомпенсации цирроза [22]. В связи с чем было крайне важно определить стадию заболевания печени. У данного пациента определить по клинико-лабораторным показателям наличие и тяжесть ЦП было затруднительно. Спленомегалия в рамках криоглобулинемии могла маскировать портальную гипертензию. Низкий уровень альбумина на фоне потери белка с мочой не позволял оценить белково-синтетическую функцию печени, а оценить печеночную энцефалопатию у пациента с уремией сложно. Цирроз печени был исключен посредством эластометрии, на которой средний показатель жесткости печени составил 10,1 кПа, что соответствует степени фиброза F2-3 по METAVIR.
Особенностью протоколов, содержащих ППД, является потенциал мутаций лекарственной резистентности. Наличие первичных мутаций лекарственной резистентности снижает эффективность терапии. Так, при наличии мутаций терапевтическая неудача наблюдается у 53%, в отсутствие мутации УВО достигает 97% [23]. При проведении секвенирования вируса гепатита С не было выявлено мутации резистентности к асунапревиру и даклатасвиру.
В середине ноября 2015 г. в условиях консультативно-диагностического нефрологического отделения ГКБ № 52 начинается ПВТ асунапревиром 100 мг 2 раза в день и даклатасвиром 60 мг в сутки. Планируемая длительность терапии – 24 недели. На момент старта ПВТ креатинин – 241,3 мкмоль/л, СКФ – 26 мм/мин (CDK-EPI), альбумин – 25 г/л, СПУ – 2,24, гемоглобин – 97 г/л. Вирусная нагрузка – 2,1 млн МЕ/мл. Хотелось бы отметить, что перед началом ПВТ криоглобулины не определялись. Пациент продолжал ежедневный прием преднизолона 40 мг в сутки с последующим медленным снижением, ко-тримоксазола и омепразола. Артериальное давление контролировалось на уровне 160/90 мм рт.ст. с помощью 5-компонентной антигипертензивной терапии. Все сопутствующие препараты не относились к строго запрещенным к совместному использованию с асунапревиром и даклатасвиром. Переносимость удовлетворительная, жалоб пациент не предъявлял. Через 2 недели ПВТ достигается авиремия. На всем протяжении противовирусного лечения функция почек была стабильной, уровень креатинина на конец ПВТ – 180 мкмоль/л, СКФ – 38 мм/мин (CDK-EPI). Протеинурия не нарастала и составляла 2,0 г/сут, криоглобулины не выявляются. Отмечено повышение гемоглобина до 136 г/л без поддержки препаратами эритропоэтина. АД контролируемое. Во время ПВТ новых кожных высыпаний не отмечено. Примерно через 3 месяца приема асунапревира и даклатасвира больной вернулся к работе. Пациент достиг устойчивого вирусологического ответа. Через 6 месяцев после окончания ПВТ зафиксировано уменьшение жесткости печени до 5,1 кПа (степень фиброза – F0 по METAVIR). При контрольном УЗИ брюшной полости данных за увеличение селезенки не получено. Креатинин – 155178 мкмоль/л, СКФ – 45 мм/мин (CDK-EPI). Криоглобулины не определяются.
В настоящее время пациент хорошо себя чувствует, ведет активный образ жизни, работает. Продолжает наблюдаться.
Таким образом, у пациента с хроническим гепатитом С тяжесть состояния была обусловлена системными проявлениями в виде т.н. HCV-синдрома, который включал тяжелый КВ с высоким уровнем криоглобулинемии. КВ у данного больного имел катастрафическое течение с развитием быстропрогрессирующего гломерулонефрита и диализопотребной почечной недостаточности. Пик заболевания осложнился легочным кровотечением на фоне фиброзирующего альвеолита. Несмотря на отсутствие морфологического диагноза, яркая клиническая картина и быстрое развитие угрожающих жизни состояний потребовали высокодозной патогенетической терапии (глюкокортикостероиды и ритуксимаб) совместно с каскадным плазмаферезом. После стабилизации состояния пациент незамедлительно прошел курс ПВТ хронической HCV-инфекции с использованием современных пероральных противовирусных препаратов с формированием устойчивого вирусологического ответа. Больным была достигнута полная ремиссия криоглобулинемического васкулита в виде эрадикации вируса и криоглобулинов.
Больная с похожим на наш клинический случай катастрофическим течением криоглобулинемического васкулита с угрожающим жизни нефритом получила асунапревир и даклатасвир по программе раннего доступа, проведенной в Российской Федерации в 2014 г. [24]. У этой больной также зафиксирована полная ремиссия криоглобулинемического васкулита, и на этом фоне отмечено улучшение функции почек. В зарубежной литературе мы встретили одно описание применения асунапревира и даклатасвира больной HCV-ассоциированным КВ с кожной пурпурой, артралгиями и с поражением почек в виде мембранопролиферативного гломерулонефрита с мочевым синдромом [25]. Во время ПВТ и после эрадикаци вируса гепатита С имело место улучшение функции почек, уменьшение протеинурии, однако криоглобулимения сохранялась. У данной больной васкулит имел нетяжелое течение, протеинурия контролировалась глюкокортиростеродами, а течение нефрита не требовало применения ритуксимаба или высоких доз иммуносупрессии.
Таким образом, применение современных препаратов, влияющих на различные звенья патогенез HCV-ассоциированного криоглобулинемического васкулита в сочетании с новыми пероральными противовирусными средствами, позволит улучшить результаты лечения васкулита и в значительной степени изменить жизненный прогноз пациентов.



