У 20–30% больных с впервые установленным диагнозом множественной миеломы (ММ) выявляется миеломная нефропатия с формированием почечной недостаточности (ПН), у 10% из них развивается диализзависимая ПН [1, 2]. Только 15–25% больных, находящихся на гемодиализе, удается улучшить функцию почек на фоне лечения [1–3]. Возможность улучшения функции почек зависит от своевременности диагностики и начала химиотерапии, скорости достижения и глубины гематологического ответа. Трансплантация аутологичных гемопоэтических стволовых клеток (ауто-ТГСК) в первой ремиссии заболевания улучшает безрецидивную выживаемость больных ММ [3–5]. Диализзависимая ПН не является противопоказанием к выполнению ауто-ТГСК [1–5].
В качестве примера успешного лечения ММ, осложненной ПН, представлены два клинических случая.
Клинический случай 1
Пациентка М. 1970 года рождения (46 лет). Из анамнеза известно, что в январе 2016 г. проведена процедура введения ботокса, после чего появилась выраженная слабость, артериальная гипертензия до 160 и 100 мм рт.ст. С жалобами на одышку, головокружение, уменьшение количества мочи до 500 мл в сутки, болезненность в мышцах конечностей, на повышение артериального давления 05.02.2016 госпитализирована в клинику г. Самары. По результатам проведенного обследования выявлены нормохромная анемия 2-й ст. (гемоглобин – 81 г/л), ускорение СОЭ до 52 мм/ч, протеинурия (1,5 г/л), почечная недостаточность (мочевина – 18,7 ммоль/л, креатинин – 733 мкмоль/л), СКФ – 5 мл/мин. 01.03.2016 выполнена биопсия почки, по результатам гистологического исследования выявлена болезнь отложения легких цепей.
По данным остеосцинтиграфии (01.03.2016), выявлены очаговые изменения 1-й, 4, 6, 7-й ребер слева и 9-го ребра справа, тела грудины, остистых отростков Th10 и L4. При иммунохимическом исследовании сыворотки крови (04.03.2016) выявлен повышенный уровень свободных легких цепей (СЛЦ) Ig k до 801,88 с изменением соотношения k/λ до 39.333. В миелограмме (09.01.2016) количество плазматических клеток составило 2,8%.
В связи с развитием острой почечной недостаточности пациентке начат программный гемодиализ. Сформирована артериовенозная фистула в области правого предплечья.
Для дальнейшего обследования и определения тактики лечения в марте 2016 г. пациентка обратилась в ГКБ № 52. Для оценки состояния костного мозга выполнена трепанобиопсия подвздошной кости. При гистологическом исследовании от 23.03.2016 выявлено обширное разрастание плотно лежащих атипичных плазматических клеток, соответствующее развернутой картине поражения костного мозга при миеломе. Проведенное стандартное цитогенетическое исследование и флуоресцентная гибридизация in situ (FISH) клеток костного мозга не выявили хромосомных нарушений.
Таким образом, на основании данных обследования установлен диагноз «множественная миелома, протекающая с секрецией белка Бенс-Джонса-k IIIВ-ст. (по Durue-Salmon) с остеструкциями в ребрах, грудине, позвонках. Анемия. Миеломная нефропатия. ТХПН. Программный гемодиализ».
Пациентке с июня по октябрь 2016 г. в Самаре проведено 8 курсов ХТ по программе VCD (бортезомиб, циклофосфамид, дексаметазон) на фоне программного гемодиализа (3 раза в неделю). При контрольном иммунохимическом исследовании в ноябре 2016 г.: секреция СЛЦ k 113,91 мг/л (снижение уровня секреции на 85%). В связи с недостаточным ответом пациентка переведена на 2-ю линию терапии: с декабря по январь 2017 г. проведено 2 курса RD (леналидомид 5 мг в сутки, дексаметазон).
В феврале 2017 г. была госпитализирована в ГКБ 52 для обследования и решения вопроса о проведении мобилизации и сбора периферических гемопоэтических стволовых клеток крови (ГСКК).
По результатам обследования в общем анализе крови: гемоглобин 115,0 г/л; тромбоциты 288,0×109/л; лейкоциты 4,7×109/л; в биохимическом анализе крови: мочевина 8,3 ммоль/л; креатинин 315,00 мкмоль/л; СКФ 14 мл/ мин. Диурез сохранен. По данным гистологического исследования трепанобиоптата подвздошной кости, не выявлены признаки специфического поражения при миеломе. При иммунохимическом исследовании белков сыворотки и мочи от 16.02.2017: уровень иммуноглобулинов в пределах нормы.
В сыворотке увеличено количество СЛЦ обоих типов с дисбалансом соотношения k/λ. Небольшая канальцевая протеинурия. Убедительных данных за наличие моноклональной секреции в настоящее время не получено.
По данным дополнительного обследования хронических очагов инфекции не выявлено.
Учитывая достижение полной иммунохимической ремиссия заболевания, решено провести мобилизацию и сбор периферических ГСКК. Учитывая достижение минимального почечного ответа, частоту проведения гемодиализа решено уменьшить до 2 сеансов в неделю.
16.03.2017 введен циклофосфамид 4 г/м2. На фоне развития миелотоксического агранулоцитоза начата стимуляция гранулоцитопоэза филграстимом из расчета 5 мкг/кг в течение 5 дней. На пятый день введения филграстима (31.03.2017) проведен сеанс лейкоцитафереза, заготовлено 0,8×106 СD34+-клеток/ кг. Период миелотоксического агранулоцитоза осложнился развитием язвенно-некротического стоматита 3-й ст., орофарингеального кандидоза.
В связи с недостаточным для выполнения трансплантации аутологичных ГСК (ауто-ТГСК) объемом CD34-позитивных клеток в апреле 2017 г. повторно проведена мобилизация периферических ГСКК на фоне стабильного кроветворения. 21.04.2017 выполнен сеанс лейкоцитафереза в условиях ГБУЗ ГКБ № 52, заготовлено 7,4 СD34-позитивных клеток на 1 кг массы тела пациентки.
По результатам контрольного иммунохимического исследования белков сыворотки от 24.05.2017: незначительно увеличено количество свободных легких цепей иммуноглобулинов (СЛЦ k 43,4 мг/л, СЛЦ l 34,4 мг/л, k/l СЛЦ 1,26) обоих типов, соотношение их не изменено. Моноклональной секреции в сыворотке не выявлено. Снижен уровень иммуноглобулина М.
 14.06.2017 больная госпитализирована для обследования и проведения курса высокодозной консолидации с поддержкой ауто-ТГСК. По результатам обследования в анализе крови цитопении не выявлено, в биохимическом анализе крови мочевина 19,3 ммоль/л; креатинин 358,40 мкмоль/л; (СКФ 14 мл/мин), в общем анализе мочи протеинурии нет. Диурез сохранен. Хронических очагов инфекции по данным дополнительного обследование (компьютерная томография органов грудной клетки, УЗИ органов брюшной полости, почек, бактериологическое исследование мочи, мазков из зева, носа, исследование крови на вирусы герпес-группы) не выявлено.
14.06.2017 больная госпитализирована для обследования и проведения курса высокодозной консолидации с поддержкой ауто-ТГСК. По результатам обследования в анализе крови цитопении не выявлено, в биохимическом анализе крови мочевина 19,3 ммоль/л; креатинин 358,40 мкмоль/л; (СКФ 14 мл/мин), в общем анализе мочи протеинурии нет. Диурез сохранен. Хронических очагов инфекции по данным дополнительного обследование (компьютерная томография органов грудной клетки, УЗИ органов брюшной полости, почек, бактериологическое исследование мочи, мазков из зева, носа, исследование крови на вирусы герпес-группы) не выявлено.
Учитывая сохранение полной ремиссии заболевания, пациентке решено провести курс высокодозной консолидации с поддержкой ауто-СКК. Кондиционирование проводилось с применением мелфалана в дозе 140 мг/м2 , бендамустина 200 мг/м2 на фоне инфузионной, антикоагулянтной, антиэметической терапии. В -5,-4,- 2, 0 дни кондиционирования проведены сеансы гемодиализа.
26.06.2017 произведено переливание 4,5×106/кг СD34-позитивных клеток крови.
Учитывая стабильный уровень азотемии (мочевина 13,7 ммоль/л, креатинин 255,5 мкмоль/л), отсутствие электролитных нарушений, от проведения сеансов гемодиализа в период агранулоцитоза решено воздержаться.
С целью профилактики инфекционных осложнений на фоне вторичного иммунодефицита в посттрансплантационном периоде введено 300 мл пентаглобина.
Миелотоксический агранулоцитоз продолжался 9 дней, с +4 по +12 дни после аутоТГСК, осложнился развитием инфекционных осложнений: язвенно-некротического мукозита 4-й степени, некротической энтеропатии, орофарингеального кандидоза, герпесвирусной инфекции промежности.
На фоне проведения антимикробной терапии (цефоперазон/сульбактам, метронидазол, флуконазол, амфотерицин В внутрь, ацикловир) инфекционные осложнения регрессировали. В связи с развитием тромбоцитопении 4-й степени проводилась заместительная гемотрансфузионная терапия концентратом тромбоцитов, суммарно 2 дозы.
За время посттрансплантационного периода сеансы гемодиализа не проводились.
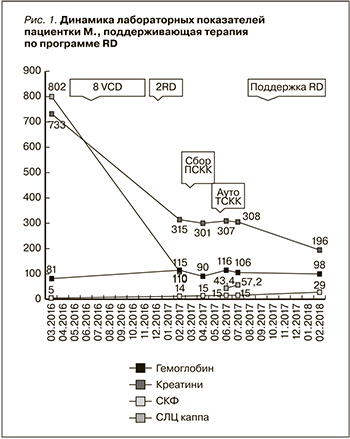
От проведения 2-го курса высокодозной консолидации с поддержкой аутоТСКК пациентка отказалась. В настоящее время больной проводится поддерживающая терапия по программе RD (леналидомид 10 мг через день, дексаметазон). Сохраняется иммунохимическая ремиссия заболевания. На фоне курсовой терапии имеет место развитие анемии 1-й ст. (гемоглобин 98 г/л), тромбоцитопении 4-й ст. (транзиторное снижение уровня тромбоцитов до 24 тыс.). Имеет место протеинурия до 0,19 г/л, в биохимическом анализе крови мочевина 9,1 ммоль/л, креатинин 196,0 мкмоль/л, СКФ 29 мл/мин. Сеансы гемодиализа не проводятся, рис. 1.
Клинический случай 2
Пациентка В. 1962 года рождения (54 года). С конца августа 2016 г. появились жалобы на слабость, головокружение, тошноту после приема пищи, учащенное сердцебиение, быструю утомляемость. Амбулаторно выявлены изменения в анализах крови и мочи (повышение уровня общего белка в сыворотки крови до 106,6 г/л, креатинин до 257 мкмоль/л, снижение уровня гемоглобина до 70 г/л, ускорение СОЭ до 82 мм/ч, протеинурия до 0,5 г/л). В сентябре 2016 г. отмечено нарастание уровня креатинина до 1065 мкмоль/л, мочевины до 26,9 ммоль/л, калия до 5,6 ммоль/л. В связи с развитием ОПН госпитализирована в ГКБ № 52. В отделении нефрореанимации установлен трехпросветный центральный венозный катетер в правую внутреннюю яремную вену, начаты сеансы гемодиализа. Переведена в отделение гематологии для дообследования в связи с подозрением на парапротеинемический гемобластоз.
При обследовании выявлена нормохромная анемия (в общем анализе крови: гемоглобин 74,0 г/л; эритроциты 2,40 1012/л, цветовой показатель 0,93 ЕД; тромбоциты 357,0×109/л; лейкоциты 8,5×109/л). В биохимическом анализе крови: мочевина 26,9 ммоль/л; креатинин 1055,70 мкмоль/л; калий 5,60 ммоль/л; общий белок 93,3 г/л; альбумин 25,7 г/л. По данным рентгенологического исследования костей скелета очагов остеодеструкции не выявлено. В миелограмме от 14.09.2016 плазматические клетки составили 12%, при молекулярно-генетическом исследовании методом FISH в 22% клеток обнаружена транслокация t (4;14). По данным иммунохимического исследование белков сыворотки крови и мочи от 15.09.2016 выявлена моноклональная секреция IgА l (48,0 г/л) и белка Бенс-Джонса l (выделение с мочой 0,26 г/сутки). β2 -микроглобулин 18 мг/л.
На основании данных обследования установлен диагноз «множественная миелома с секрецией IgА l (48,0 г/л) и белка Бенс-Джонса l, IIIВ-ст. (по Durie-Salmon), III по ISS. Анемия. Миеломная нефропатия, ХПН, диализпотребная форма».
С 15.09.2016 по 25.12.2016 пациентке проведено 5 курсов химиотерапии по программе VCD (бортезомиб, дексаметазон, циклофосфамид). После 2 курсов достигнута очень хорошая частичная ремиссия заболевания (иммунохимическое исследование белков сыворотки и мочи от 07.11.2016: следовая моноклональная секреция IgА l, белок Бенс-Джонса не выявлен), частичный почечный ответ (снижение уровня креатинина до 175 мкмоль/л, СКФ до 28 мл/мин). Начиная со второго курса полихимиотерапии (октябрь 2016 г.) сеансы гемодиализа не проводились.
После 4 курсов достигнута полная ремиссия заболевания: при иммунохимическом исследование белков сыворотки и мочи от 08.12.2017 моноклональной секреции не выявлено.
Учитывая диагноз, возраст пациентки, неблагоприятный прогноз, данные молекулярно-генетичееского исследования, достижение полной ремиссии заболевания, было принято решение о проведении высокодозного курса консолидации с поддержкой ауто-ТГСК. По результатам предварительного обследования в январе 2017 г. в гемограмме гемоглобин 110 г/л, эритроциты 3,57×1012/л, лейкоциты 4,2×109/л, тромбоциты 194×109/л, СОЭ 12 мм/ч. В биохимическом анализе крови общий белок 70,3 г/л, альбумин 45,2 г/л, мочевина 10,1 ммоль/л, креатинин 163 мкмоль/л, калий 4,0 ммоль/л, ЛДГ 192,5 ЕД/л.
В общем анализе мочи протеинурия не определяется. При гистологическом исследовании трепанобиоптата подвздошной кости не выявлены признаки специфического поражения при миеломе.
15.01.2016 г. введен циклофосфамид 4 г/м2 (суммарно 7 г) на фоне инфузионной, антиэметической, антикоагулянтной терапии, введения уромитексана. Период миелотоксического агранулоцитоза осложнился развитием фебрильной нейтропении без выявленного очага инфекции. Проводилась антимикробная терапия (цефепим, амикацин, флуконазол) с эффектом.
На фоне восстановления показателей крови 31.01.2017, 01.02.2017 и 02.02.2017 проведены мобилизация и сбор ГСКК. Суммарно заготовлено 5,3×106/кг CD34-позитивных клеток.
По данным контрольного обследования в марте 2017 г.: в гемограмме гемоглобин 103 г/л, эритроциты 3,24×1012/л, лейкоциты 3,7×109/л, тромбоциты 189×109/л, СОЭ 18 мм/ч. В биохимическом анализе крови мочевина 10,5 ммоль/л, креатинин 159,4 мкмоль/л (СКФ 31 мл/мин). В общем анализе мочи протеинурии нет. По результатам иммунохимического исследования белков сыворотки и мочи от 14.03.2018 сохраняется иммунохимическая ремиссия заболевания (патологической секреции не выявлено, СЛЦ k 8,36 мг/л, СЛЦ l15,6 мг/л, k/l 0,53).
Учитывая сохранение ремиссии заболевания, отсутствие очагов хронической инфекции, принято решение о проведении курса высокодозной консолидации с поддержкой ауто-ГСКК. С 17.02.2017 по 19.02.2018 проведено кондиционирование в режиме мелфалан в суммарной дозе 200 мг/м2, бендамустин 200 мг/м2 на фоне инфузионной, антикоагулянтной и антиэметической терапии.
20.03.2017 выполнена трансфузия ауто-ГСКК (суммарно перелито 5,3×106/кг CD34-позитивных клеток). Осложнений не было. С целью профилактики инфекционных осложнений на фоне вторичного иммунодефицита в посттрансплантационном периоде дважды выполнено введение 20 г иммуноглобулина. Миелотоксический агранулоцитоз продолжался 21 день. Посттрансплантационный период осложнился развитием язвенно-некротичексого мукозита 4-й ст., орофарингеального кандидоза, некротической энтеропатии тяжелого течения. Проводилась антибактериальная, противогрибковая терапия (тациллин, амикацином, флуконазол, метронидазол, меропенем, кансидас, ванкомицин, клацид, сульфасалазин, линезолидом, амфолип, вориконазол, тигациклин, проводилась терапия поливалентным бактериофагом. В связи с развитием тромбоцитопении 4-й степени проводилась заместительная гемотрансфузионная терапия концентратом тромбоцитов, суммарно 8 доз. Показатели азотемии оставались стабильными, диурез сохранен. На фоне проводимой терапии отмечено восстановление показателей периферической крови, разрешение очагов инфекции.
По результатам иммунохимического исследования сыворотки крови от 29.05.2017: следовая секреция IgA l. Олигоклональная гаммапатия на фоне увеличения IgG. Вторичная гипогаммаглобулинемия. С июня 2017 г. пациентке начата поддерживающая терапия бортезомибом 1,3 мг/м2 1 раз в 2 недели.
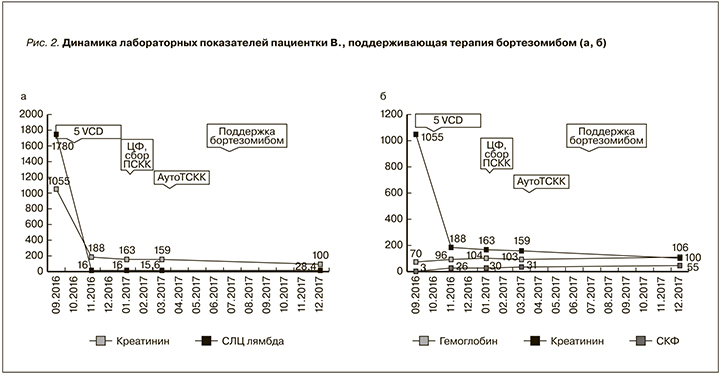
В настоящее время состояние пациентки остается удовлетворительным. Лабораторно: гемоглобин 106 г/л, лейкоциты 5,3×109/л, тромбоциты 176×109/л, мочевина 9,0 ммоль/л, креатинин 100 мкмоль/л, СКФ 55 мл/мин. По данным иммунохимического исследования белков сыворотки крови и мочи от 20.22.2017: следовая олигоклональная гаммапатия, СЛЦ l 28,4 мг/л, СЛЦ k 21,7 мг/л, k/l 0,76. В настоящее время продолжается поддерживающая терапия бортезомибом, рис. 2, 3.
Выводы. Таким образом, на диагностическом этапе раннее выполнение иммунохимического исследования белков сыворотки и мочи у пациентов с впервые выявленной почечной недостаточностью, протеинурией позволило бы диагностировать миеломную болезнь и избежать необходимости проведения пункционной биопсии почки. Раннее начало специфической терапии при ММ, а также своевременный переход на терапию 2-й линии позволяют достигать почечного ответа пациентов с миеломной нефропатией.
Регулярный контроль иммунохимического исследования белков сыворотки и мочи (после каждых 2 курсов) необходим для оценки эффективности проводимого лечения и своевременной коррекции терапии. Выполнение высокодозной консолидации с применением высоких доз мелфалана в сочетании с бендамустином и с последующей поддержкой аутологичными ГСКК способствует улучшению почечной функции, что позволяет отказаться от проведения программного гемодиализа части больных и существенно улучшить качество жизни пациентов.



