Введение
Хроническая болезнь почек (ХБП) является независимым фактором риска развития сердечно-сосудистой патологии и смерти, что обусловливает ее высокую медико-социальную значимость [1]. В ближайшее время ожидается рост числа пациентов с ХБП, т.к. увеличивается доля лиц с ожирением, гипертонической болезнью (ГБ), ишемической болезнью сердца (ИБС) и сахарным диабетом (СД) [2–5]. Диагностические критерии ХБП: признаки почечного повреждения, выявленные при лабораторном или инструментальном исследовании, и/или снижение скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2, которые прослеживаются в течение 3 и более месяцев независимо от их характера и этиологии [6]. Вместе с тем наиболее точным показателем, отражающим функциональное состояние почек, является СКФ, которая может рассчитываться по формулам, основанным на сывороточном уровне эндогенных маркеров, таких как креатинин и цистатин С сыворотки крови [6]. Несмотря на прямой известный маркер ренальной функции, исследование концентрации креатинина сыворотки крови является недостаточно корректным методом оценки ввиду зависимости от многих факторов [6, 7]. Поэтому были разработаны формулы для расчета СКФ на основании цистатина С [8, 9]. Опубликованы данные, свидетельствующие о превосходстве цистатина С в отношении оценки СКФ, особенно при нормальной и незначительно сниженной СКФ [10, 11]. Таким образом, в качестве альтернативного маркера функционального состояния почек, кардио- и цереброваскулярного риска в последние годы рассматривается цистатин С [12, 13]. Еще в 2011 г. C.A. Peralta et al. сделали вывод, согласно которому СКФ, расчитанная на основе цистатина С, позволяет выявлять ХБП в 2 раза чаще, чем СКФ по креатинину [14].
В известной программе NHANES III (Third National Healthand Nutrition Examination Survey) показаны результаты определения цистатина С у 2990 лиц старше 40 лет с нормальной СКФ по MDRD (Modification of Diet in Renal Disease Study), что дало возможность авторам сделать следующий вывод: цистатин С является альтернативным креатинину предиктором дисфункции почек, достаточно тесно связанным с долгосрочным прогнозом летальности от сердечно-сосудистой патологии даже в отсутствие таковой в общей популяции с нормальной функцией почек [15]. Ранее у взрослых широко использовалась формула Cokcroft–Gault для расчета клиренса креатинина [16]. Общим недостатком этих формул является их неточность при нормальных или незначительно сниженных значениях СКФ. Учитывая изложенные выше данные и принимая во внимание важность ранней диагностики ренальной дисфункции, в 2009 г. была предложена новая формула CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) для расчета СКФ [17], в которой используются те же параметры, что и в формуле MDRD [18].
Цель исследования: изучить возможности использования различных методик расчета СКФ с определением частоты встречаемости ренальной дисфункции в зависимости от нозологического типа социально значимых заболеваний.
Материал и методы
Было проведено обследование 728 пациентов: 330 (45,3%) мужчин и 398 (54,7%) женщин в возрасте от 16 до 98 лет (средний возраст – 50,5±14,2 года). Пациенты прошли обследование в клинических отделениях кафедр факультетской терапии КГМА им. И.К. Ахунбаева и терапии № 2 КРСУ им. Б.Н. Ельцина (Бишкек). Исследование было одобрено Комитетом по вопросам этики КГМА им. И.К. Ахунбаева. Клиническая характеристика обследованных лиц представлена в табл.1.
Общеклиническое обследование: измерение артериального давления (АД) проводили на обеих руках в положении пациента сидя по методу Короткова. Расчитывалось пульсовое и среднее АД, определялся индекс массы тела (ИМТ) по формуле: ИМТ=масса тела (кг)/рост2(м2). Выполнялся подсчет частоты сердечных сокращений (ЧСС). В зависимости от показателя ИМТ выделяли избыточную массу тела – при ИМТ 25–29,9 кг/м2, ожирение I степени – при ИМТ 30–34,9 кг/м2; ожирение II степени – при ИМТ 35–39,9 кг/м2; ожирение III степени – при ИМТ 40 кг/м2 и более [19]. Лабораторная часть исследования включала оценку концентрации цистатина С и креатинина сыворотки крови. Референтное верхнее значение цистатина С сыворотки крови составило 0,99 мг/л. В данное исследование пациенты, страдавшие диффузным токсическим зобом, лихорадкой, принимавшие иммуносупрессивные и глюкокортикоидные препараты, а также лица, находившиеся на гемодиализе, включены не были. Расчет СКФ выполняли по формулам CKD-EPI, MDRD – с учетом концентрации креатинина в сыворотке крови, F.J. Hoek – СКФ (мл/мин/1,73 м2)=80,35/цистатин C (мг/л) – 4,3, а также определение клиренса креатинина по формуле Кокрофта–Голта (мл/мин). На основе расчетной СКФ (рСКФ) оценивали тяжесть ренальной дисфункции. Статистический анализ полученных данных осуществлен при помощи программного пакета «Statisticа 10,0». Все количественные переменные представлены в виде средней (M)±стандартное отклонение (SD), медианы и квартилей [Ме (Q25;Q75)]. Значимость различий между группами оценивалась с помощью t-критерия Стьюдента (для переменных с нормальным распределением) и теста Манна–Уитни (для переменных с непараметрическим распределением) [20]. Корреляционный анализ проведен по критерию Пирсона – для переменных с нормальным распределением и коэффициент Спирмена (для переменных с непараметрическим распределением). Для всех видов анализа статистически значимым считалось значение p<0,05.
Результаты
В поперечное эпидемиологическое исследование были включены 728 пациентов общетерапевтического профиля. Результаты исследования показаны в табл. 1–4. Среди обследованных лиц наиболее часто отмечались избыточная масса тела (33,5%), ожирение (30,2%), ГБ (54,1%), ИБС (20,7%) и коморбидные заболевания (21,7%). В представленной работе группа пациентов, страдавших подагрой (находившихся на уратснижающей терапии), бронхиальной астмой, поликистозом почек, хроническим вирусным гепатитом (В и С), СД 1 типа, фибрилляцией предсердий и имевших единственную почку, была малочисленной (табл.1). Стоит заметить, что в проведенном исследовании также принимали участия лица пожилого возраста (24,8%). Ограничениями нашего исследования были одномоментный характер исследования и отсутствие определения альбуминурии. Средние уровни систолического и диастолического АД равнялись 133±21 и 84±11 мм рт.ст. соответственно (табл.1). Показатель ИМТ составил 27,7±5,75 кг/м2, пульсовой АД – 49±16, среднее АД – 44±7 мм рт.ст.
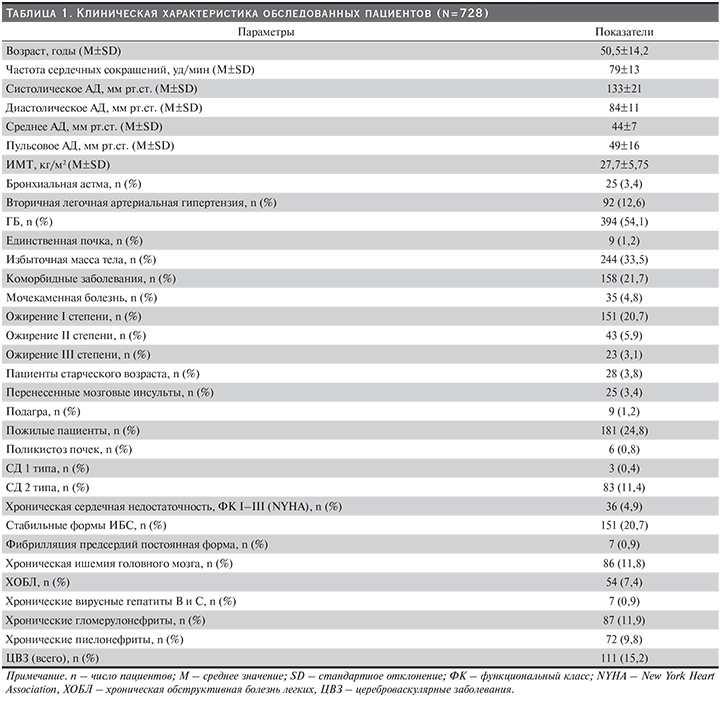
Общепризнанно, что распространенность ХБП сопоставима с такими социально значимыми заболеваниями, как ожирение, ГБ, СД и ИБС. Признаки повреждения почек и/или снижения СКФ выявляют как минимум у каждого десятого представителя общей популяции. В клинической практике за нормальные показатели функции почек принимается значение СКФ более 90 мл/мин. Среди обследованных нами пациентов снижение рСКФ в диапазоне 90–60 мл/мин по формуле CKD-EPI отмечено у 214 (29,3%), у 267 (36,6%) – по MDRD, у 177 (24,3%) – по формуле Cokcroft–Gault и у 519 (71,2%) – по формуле F.J. Hoek (табл. 2). Тогда как рСКФ менее 60 мл/мин выявлена у 155 (21,2%) по формуле CKD-EPI, у 183 (25,1%) – по MDRD, у 147 (20,1%) – по формуле Cokcroft–Gault и у 351 (48,2%) – по формуле F.J. Hoek. Очевидно, что в нашем исследовании с использованием расчетной формулы F.J. Hoek и MDRD признаки ренальной дисфункции выявлялись чаще (табл. 2).
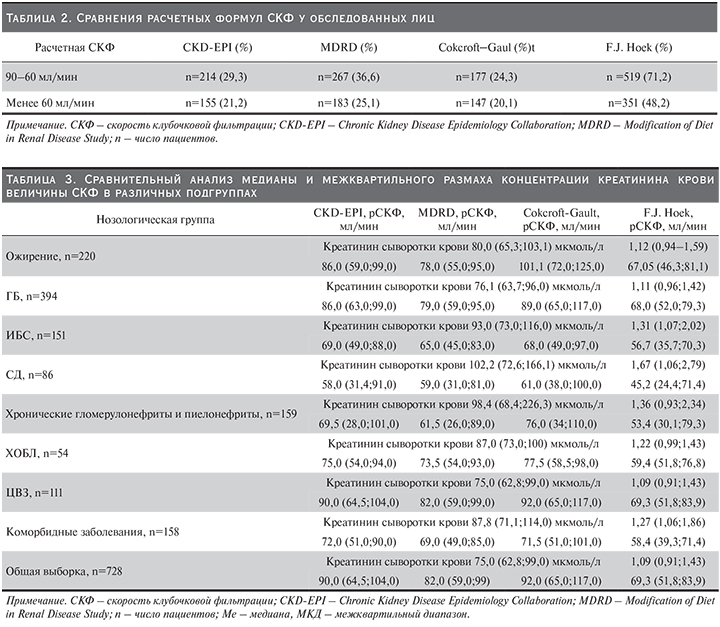
Учтя большое разнообразие нозологических форм, включенных в наше исследование, а также превалирование социально значимых заболеваний в этиологии ренальной дисфункции в общей популяции, мы сочли возможным остановиться лишь на нозологических единицах, наиболее часто приводящих к ХБП. Таким образом, из общего числа обследованных (n=728) лиц было выделено 9 подгрупп (табл. 3). В каждой подгруппе оценивали медиану и межквартильный диапазон рСКФ по креатинину и цистатину С сыворотки крови. Так, в подгруппе 1 лиц с ожирением (n=220) при содержании креатинина сыворотки крови рСКФ составила 80,0 (65,3;103,1) мкмоль/л; были получены более низкие значения СКФ (78,0 мл/мин), рассчитанные по формуле MDRD, по сравнению CKD-EPI и Cokcroft–Gault (86,0 и 101,1 мл/мин соответственно). В той же когорте содержание цистатина С сыворотки крови составило 1,12 мг/л, рСКФ – 67,0 мл/мин. Сходные данные выявлены и в подгруппе 2 лиц с ГБ (n=394), т.е. низкие значения рСКФ отмечались по формулам MDRD (рСКФ – 79,0 мл/мин) и F.J. Hoek (рСКФ – 68,0 мл/мин). В подгруппу 3 вошли пациенты, страдавшие стабильной формой ИБС (n=151). Сравнительный анализ показал, что каких-либо различий по уровню рСКФ с использованием формул CKD-EPI, MDRD и Cokcroft–Gault в указанной подгруппе пациентов получено не было (р>0,05). Однако СКФ по формуле F.J. Hoek оказалась достоверно сниженной (р<0,05). К тому же медиана рСКФ у лиц с ИБС по сравнению с подгруппами 1 (ожирение) и 2 (ГБ) различалась существенно (р<0,05).
В целом по представленным четырем формулам клинически значимое снижение рСКФ регистрировалось в подгруппе 4 лиц с СД (n=86). Причем медиана рСКФ по формулам CKD-EPI, MDRD и Cokcroft–Gault была равнозначной (р>0,05). Как видно из табл. 3, медиана и межквартильный диапазон рСКФ по F.J. Hoek оказались заметно сниженными: 45,2 (24,4;71,4). Что же касается пациентов, страдавших ХГН или ХП, – подгруппа 5 (n=159), высокая рСКФ отмечена по формуле Cokcroft–Gault (76,0 мл/мин) по сравнению с расчетом по формуле CKD-EPI, MDRD и F.J. Hoek. Напротив, сниженная рСКФ была получена по F.J. Hoek. В наиболее малочисленной подгруппе 6 (n=54), т.е. у пациентов с ХОБЛ, показатели СКФ, рассчитанные по CKD-EPI, MDRD и Cokcroft–Gault, были равнозначными (р>0,05). Ощутимый спад рСКФ выявлен при расчете по формуле F.J. Hoek (59,0 мл/мин).
В подгруппе 7 лиц с ЦВЗ (n=111) величина рСКФ по формуле CKD-EPI и Cokcroft–Gault была схожей (табл. 3). Сравнительно сниженный показатель рСКФ имел место при расчете по формуле F.J. Hoek.
Существенное влияние на развитие и прогрессирование ХБП в той или иной популяции может оказать сочетание двух и более заболеваний. Так, среди лиц с коморбидными заболеваниями – подгруппа 8 (n=158) – значение рСКФ по CKD-EPI, MDRD и Cokcroft–Gault не различалось (р>0,05). Однако как и в предыдущих подгруппах, рСКФ с использованием методик F.J. Hoek оказалась весьма сниженной (табл. 3). Итак, в общей группе 9 (n=728) медиана рСКФ при расчете по соответствующим формулам была следующей: CKD-EPI – 90,0 мл/мин; MDRD – 82,0; Cokcroft–Gault – 92,0; F.J. Hoek – 69,3 мл/мин, при этом концентрация креатинина сыворотки крови составила 75,0 (62,8;99,0) мкмоль/л.
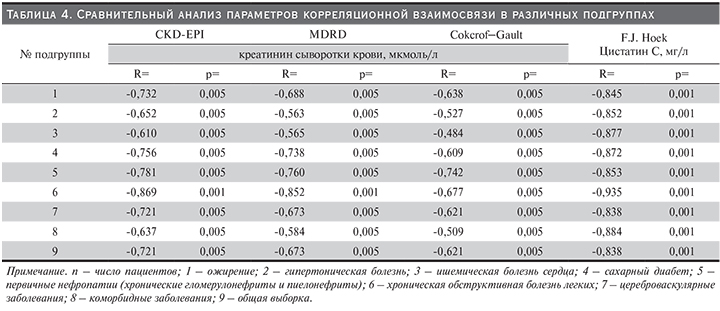
Для определения показателей рСКФ, имевших наибольшее диагностическое значение в отношении раннего выявления в представленной выборке маркеров ренальной дисфункции, нами был проведен корреляционный анализ в разных подгруппах с включением формулы CKD-EPI, MDRD, Cokcroft–Gault и F.J. Hoek (табл. 4). Так, СКФ, рассчитанная на основе креатинина сыворотки крови по CKD-EPI, дала статистически высокозначимую связь в подгруппе лиц, страдавших первичными нефропатиями (R=-0,781; р=0,001) и ХОБЛ (R=-0,756; р=0,001). Аналогичная высокозначимая корреляционная взаимосвязь при использовании уравнения MDRD наблюдалась в подгруппе пациентов с ХОБЛ (R=-0,852; р=0,001). По сравнению с другими подгруппами коэффициент корреляции между креатинином сыворотки крови и рСКФ по формуле Cokcroft–Gault при ИБС оказался не столь сильным (R=-0,484; р=0,005). Примечательно, что СКФ, рассчитанная с использованием методики F.J. Hoek во всех представленных подгруппах, продемонстрировала сильную корреляционную взаимосвязь (табл. 4). Важно подчеркнуть, что связь СКФ, рассчитанная по методике F.J. Hoek, оказалась более сильной в подгруппе пациентов, страдавших ХОБЛ (R=-0,935; р=0,001).
Обсуждение
Признаки повреждения почек и/или снижение СКФ выявляют как минимум у каждого десятого представителя общей популяции [21]. Важно отметить, что сопоставимые цифры были получены как в индустриальных странах с высоким уровнем жизни, так и в развивающихся странах со средним и низким доходом населения. Проблема ХБП для нашей страны остается не менее острой [22]. Вместе с тем данные о распространенности ХБП в Кыргызстане с использованием различных маркеров почечной дисфункции не изучены. Расчетные методики различных маркеров почечной дисфункции позволяют выявлять доклиническое поражение почек. На сегодняшний день в общеклинической практике для расчета СКФ используют методики по Cokcroft–Gault, формулы MDRD и CKD-EPI [16–18]. Однако опыт применения различных методик и формул для оценки СКФ показывает неоднозначность их интерпретации у разных категорий пациентов. На точность расчетов могут влиять возраст, пол, масса тела, этническая принадлежность, концентрация креатинина крови и т.д. [7–9, 11]. В настоящее время приоритет отдается методике расчета СКФ по формуле CKD-EPI [18]. Так, в недавно проведенном исследовании было показано [23], что у лиц с ГБ показатели СКФ, рассчитанные по MDRD и CKD-EPI, были занижены по сравнению с результатом пробы Реберга–Тареева на 15,5 и 10,0% соответственно, а по сравнению с рассчетами СКФ по формуле Cokcroft–Gault на 16,0 и 10,4%. Этот факт подтверждается и нашими данными, т.е. в подгруппе лиц с ГБ медиана СКФ, вычисленная по MDRD и по F.J. Hoek, оказалась сниженной (табл. 3). Формула MDRD получена в клиническом исследовании Modification of Diet in Renal Disease в 1999 г. [17]. Она показывает недостаточную точность расчетов в области значений 60–90 мл/мин/1,73 м2, в связи с чем нередко применяется ее модификация – формула MDPvD [24]. Расчет СКФ по формуле CKD-EPI рекомендуется к применению как наиболее оптимальный в амбулаторной и клинической практике при скрининге с целью оценки СКФ [25–27]. В этом направлении необходимо отметить, что в эпидемиологическом исследовании ЭССЕ-РФ, в котором принимали участие 15 570 человек из 10 городов России, снижение СКФ менее 60 мл/мин/1,73 м2, рассчитанное на основании формулы CKD-EPI, было выявлено у 1,1% [27]. Тогда как замедление СКФ менее 90 мл/мин/1,73 м2 практически отмечалось у 76,8% женщин и 23,2% мужчин.
В проведенном нами исследовании снижение СКФ менее 90 мл/мин/1,73 м2 выявлено у 29,3% по формуле CKD-EPI, 36,6% – по MDRD и 71,2% – по методике F.J. Hoek (табл. 2).
В.В. Кулаков и соавт. (2017) проанализировали маркеры ренальной дисфункции у 319 пациентов, страдавших АГ и СД, где функция почек оценивалась на основании расчета СКФ по формуле CKD-EPI. Авторами был сделан вывод о том, что снижение СКФ менее 60 мл/мин/1,73 м2 выявлено у 127 (40%) пациентов, при этом у большинства из них наблюдали умеренно сниженную и существенно сниженную СКФ [28]. По данным J.M. Hougardy et al. (2014), методика рСКФ по CKD-EPI может оказаться неточной для пожилых людей и лиц с ожирением. Формула Cokcroft–Gault была опубликована в 1976 г., однако ее широкому использованию препятствует возраст исследуемых лиц, тем не менее она применяется в клинической практике до настоящего времени [29].
Формула Cokcroft–Gault все еще остается методом выбора для расчета СКФ при решении вопроса о дозировках вводимых препаратов, а также при диагностике поражения почек при ГБ [30].
Повышение уровня систолического АД достоверно ассоциируется с увеличением риска тяжелой ренальной дисфункции [31]. И.Р. Поповой и соавт. (2012) было продемонстрировано, что для лиц с ожирением при расчете СКФ по формуле Cockroft–Gault характерна высокая СКФ [32]. К тому же выявлена прямая корреляционная зависимость между значением ИМТ и СКФ, рассчитанной по формуле Cockroft–Gault.
В этом исследовании расчет СКФ по формуле MDRD позволил выделить большую группу пациентов (23%) с выраженной и средней степеями снижения СКФ (менее 60 мл/мин/1,73 м2).
По мнению исследователей, обе формулы позволяют выявлять незначительные нарушения функции почек даже при нормальном уровне креатинина сыворотки крови [32]. Но расчеты по формуле MDRD предпочтительны для лиц с ожирением, т.к. позволяют выделять большее число пациентов, требующих специального обследования, коррекции терапии и динамического наблюдения. Сходные данные были получены и в нашем исследовании (табл. 3), т.е. медиана рСКФ по MDRD была существенно ниже по сравнению с формулой Cockroft–Gault: 78,0 (55,0;95,0) мл/мин против 101,1 (72,0;125,0) (р<0,05). В более ранних исследованиях продемонстрировано, что наиболее достоверным способом определения СКФ является формула MDRD, которая в свою очередь остается единственным показателем остаточной функции почек на старте почечной заместительной терапии, влияющей на выживаемость пациентов на гемодиализе [33]. Однако выбор оптимальной формулы для вычисления рСКФ обсуждается и в наши дни [34–36]. Точность оценки ренальной функции на основе содержания цистатина С у пожилых людей была получена в недавно проведенном исследовании [37]. Признается, что уровень цистатин С в сыворотке является весьма чувствительным маркером выявления ХБП на ранней стадии заболевания [38, 39–42]. Это положение полностью согласуется и с нашими результатами исследования (табл. 4), где высокозначимая статистическая связь была отмечена между содержанием цистатина С крови и рСКФ, особенно в подгруппе лиц с ХОБЛ. Стоит отметить, что гипоксемия, оксидативный стресс, хроническое воспаление и генерализованная эндотелиальная дисфункция при ХОБЛ служат доказанным системным проявлением заболевания, ведущим к формированию ХБП [43]. Поэтому актуальным вопросом своевременной диагностики является поиск наиболее информативных предикторов риска развития ренальной дисфункции при ХОБЛ [44]. Клиническое значение оценки содержания цистатина С сыворотки крови и ее взаимосвязь с клинико-лабораторными параметрами при ХБП опубликованы в ранее проведенных нами исследованиях [13, 40].
В работе Е.В. Болотовой и соавт. (2015) показано, что расчет СКФ на основе сывороточного цистатина С предпочтителен для пациентов ХОБЛ, т.к. содержание цистатина С в сыворотке крови не зависит от состояния мышечной ткани, пола, режима питания и антропометрических показателей [45]. Предполагается, что повышение уровня цистатина С сыворотки крови служит маркером тяжести воспаления при ХОБЛ [46, 47]. В работе Н.А. Ярковой и соавт. (2013) также было продемонстрировано снижение рСКФ по MDRD и F.J. Hoek у лиц с ренальной дисфункцией по сравнению с расчетами СКФ с использованием формулы Cokcroft–Gault [48]. Повышенное содержание цистатина C в сыворотке крови в подавляющем большинстве случаев свидетельствует о снижении СКФ [49]. Этот факт нашел подтверждение и в нашем исследовании (табл. 3), где прирост показателя цистатина С сопровождался торможением рСКФ.
Известно, что при наличии ренальных нарушений концентрация цистатина C в сыворотке крови увеличивается примерно в 2 раза. Повышенное содержание цистатина С в сыворотке крови также является серьезным прогностическим фактором риска смерти и возникновения сердечно-сосудистых осложнений у пожилых людей. H.S. Kilbride et al. (2013) установили, что уравнение CKD-EPI оказалось менее предвзятым и было более точным, чем формула MDRD [50]. Предпологается, что наилучшее соответствие между истинной и расчитанной СКФ обеспечивало бы именно седьмой вариант уравнений MDRD [51]. Однако (MDRD7) не нашел широкой поддержки в клинической практике из-за трудности расчета СКФ, т.к. в этом уравнении для вычисления СКФ помимо концентрации креатинина требовались мочевина и альбумины сыворотки крови. В связи с этим в 2000 г. была разработана краткая формула MDRD, где из лабораторных показателей используется только концентрация креатинина сыворотки крови [52].
В дальнейшем был выдвинут ряд положений касательно уравнения MDRD. Так, расчет СКФ по формуле MDRD занижает истинные значения СКФ, особенно при высоких значениях данного параметра [53, 54]. Ни одно из уравнений не продемонстрировало идеального измерения СКФ. Все это побудило исследователей и ученых создать новые способы определения расчетной СКФ. В недавно проведенном исследовании В.Н. Каретниковой и соавт. (2016) установлено, что для оценки риска развития сердечно-сосудистых осложнений в отдаленном постинфарктном периоде наибольшая прогностическая значимость отмечена для формулы CKD-EPI у пациентов без СД 2 типа и для формулы F.J. Hoek (по уровню цистатина С) у больных СД [55]. По данным популяционных трайлов, распространенность ренальной дисфункции в отсутствие сердечно-сосудистой патологии и СД составляет 6,8%, при наличии ГБ – 15,2%, а при сочетании ГБ и СД возрастает до 43% [56]. Высокая распространенность сниженной СКФ в реальной практике свидетельствует о значимости проблемы и необходимости раннего внедрения кардионефро- и цереброваскулярных протективных вмещательств.
Выводы
У пациентов с социально значимыми заболеваниями распространенность снижения СКФ менее 90 мл/мин по методике F.J. Hoek составила 71,2% и 36,6% – по уравнению MDRD. Снижение СКФ менее 60 мл/мин выявлено у 48,2% обследуемых нами лиц по F.J. Hoek и по уравнению MDRD – у 25,1%. Частота встречаемости ренальной дисфункции по формулам CKD-EPI и Cokcroft–Gault были равнозначными – 29,3; 21,2% и 24,3; 20,1% соответственно.
Полученные нами данные подтверждают необходимость оценки функционального состояния почек с использованием формул F.J. Hoek, при этом цистатин С является более чувствительным лабораторным маркером поражения почек при ХОБЛ.



