Введение
Онкологические и сердечно-сосудистые заболевания (ССЗ) – одна из важнейших проблем медицины, что обусловлено высокой заболеваемостью и смертностью [1, 2]. В то же время, несмотря на рост онкологической заболеваемости, наблюдается увеличение выживаемости пациентов этой группы в результате создания новых методов ранней диагностики и лечения онкологических больных [3]. Проведение агрессивной противоопухолевой терапии приводит к увеличению риска развития и прогрессирования ССЗ, в частности ишемической болезни сердца, острого коронарного синдрома (ОКС) [4].
Пациенты с ОКС имеют повышенный риск развития острого повреждения почек (ОПП), частота которого может доходить до 33%, что способно значительно ухудшить прогноз нестабильной стенокардии и инфаркта миокарда (ИМ) [5]. При этом имеется большая вероятность выявления уже имеющейся патологии почек у онкологических больных вследствие нефротоксичного действия противоопухолевой химио- и/или лучевой терапии, паранеопластических процессов, а также непосредственного (механического) воздействия опухоли или опухолевой инфильтрации [6], что также увеличивает риск развития ОПП [7].
ОПП, индуцированное введением рентгеноконтрастных препаратов (РКП), контраст-индуцированное ОПП (КИ-ОПП) является осложнением селективной коронарографии (СКГ), в т.ч. и у пациентов с ОКС [8]. По данным литературы, частота КИ-ОПП после проведения чрескожного коронарного вмешательства (ЧКВ) колеблется в широком диапазоне от 3 до 30%, что может быть обусловлено отличительными особенностями пациентов исследуемых выборок, а также различными критериями диагностики КИ-ОПП [9, 10]. В настоящее время концентрация сывороточного креатинина (сКр) является общепринятым критерием диагностики ОПП. В то же время этот маркер имеет ряд недостатков: зависимость от возраста, пола, расы, массы тела, повышение уровня креатинина в крови через 24–48 часов после воздействия повреждающего фактора. В связи с этим продолжается поиск новых эффективных биомаркеров с целью ранней диагностики ОПП. Одним из таких маркеров служит KIM-1 (kidney injury molecule, молекула почечного повреждения), который ранее в ряде работ показал себя как эффективный биомаркер для диагностики ОПП, в т.ч. КИ-ОПП у пациентов с ОКС (n=193) [8,11]. Однако роль KIM-1 в качестве биомаркера ОПП у больных ОКС и онкологическими заболеваниями (ОЗ) ранее не исследовалась.
Цель исследования: изучить диагностическое и прогностическое значение уровней KIM-1 в моче у пациентов с ОКС и ОЗ.
Материал и методы
Исследование проводили на базе ГБУЗ НО «НОКБ им. Н.А. Семашко» (Нижний Новгород). В исследование включили 87 пациентов: 30 (34,5%) женщин, 57 (65,5%) мужчин. Средний возраст составил 69,2±8,3 года. Мужчины были младше женщин (66,1±8,5 и 75,0±5,8; р=0,005). Пациентов распределили в две группы: 1) основная группа: ОКС в сочетании с ОЗ (ОКС+ОЗ; n=40); 2) группа сравнения: ОКС без ОЗ (ОКС-ОЗ; n=47). Критерии включения: ОКС с/без подъема сегмента ST, ОЗ (активное и/или в анамнезе давностью до 10 лет). Критерии исключения: беременность, лактация; тяжелая печеночная и/или дыхательная недостаточность; раковая кахексия; психические расстройства; отказ пациента подписать добровольное информированное согласие. Диагностику и лечение больных ОКС проводили согласно действующим клиническим рекомендациям [12, 13].
Активное ОЗ выявили у 15 (37,5%) больных, ОЗ в анамнезе (1–5 лет) – у 9 (22,5%), ОЗ в анамнезе (5–10 лет) – у 16 (40%). Наиболее частые локализации ОЗ: молочные железы, легкие, предстательная железа, мочевой пузырь и толстый кишечник (суммарно 70,0%). У 24 (61,5%) больных были ранние (Т1-2) стадии ОЗ по системе TNM, у 15 (38,5%) – поздние (Т3-4). У 1 (2,5%) больного было онкогематологическое заболевание. У 17 (42,5%) выявили N1–N3-стадии, М1 – у 7 (17,5%) пациентов. Ранее лечение ОЗ было проведено 37 (92,5%) больным, остальные не получали специфического лечения вследствие впервые диагностированной злокачественной опухоли при текущей госпитализации.
Диагноз ОПП устанавливали в соответствии с клиническими рекомендациями [14]. ОПП диагностировали по уровню сКр: 1) с использованием «базального» сКр, соответствующего расчетной скорости клубочковой фильтрации (рСКФ) 75 мл/мин/1,73 м2, который сравнивали с сКр в момент госпитализации (ОПП по «базальному» креатинину); 2) за исходный сКр считали сКр в момент госпитализации с дальнейшей его оценкой в динамике в течение 1–7 суток (ОПП по динамике); 3) ОПП на фоне ХБП диагностировали при наличии у больного ХБП; 4) олиго-/анурический тип ОПП устанавливали при темпе диуреза <0,5 мл/кг/ч в течение 6 часов и более. Однако показание к катетеризации мочевого пузыря было только у пяти пациентов с ОЗ и у троих без ОЗ, в связи с этим почасовой диурез как критерий ОПП был учтен в отношении только этих больных. КИ-ОПП диагностировали при увеличении сКр≥26,5 мкмоль/л на протяжении 48 часов или при увеличении сКр≥1,5 раз от базального или исходного сКр в течение 7 дней при исключении других причин [15].
СКГ была проведена 79 (90,8%) пациентам: в первые 2 часа от момента поступления в стационар 50 (57,5%) больным, в период от 2 до 24 часов – 29 (42,5%). Восьми (9,2%) пациентам СКГ не проводили по причине отказа от исследования. Больные обеих групп были сопоставимыми по частоте проведения СКГ: n=35 (87,5%) и n=44 (93,6%), р=0,462, реперфузионному лечению: n=30 (75,0%) и n=38 (80,9%), р=0,691, в частности первичному ЧКВ: n=24 (60,0%) и n=35 (74,5%), р=0,150, и фармако-инвазивному подходу: n=5 (12,5%) и n=3 (6,4%), р=0,326. Одному (2,5%) пациенту основной группы проводили тромболитическую терапию без ЧКВ.
За первые сутки поступления в стационар всем пациентам проводили забор 10 мл средней порции утренней мочи в пробирки «BD Vacutainer». Пробирки с мочой доставляли в централизованную лабораторию «АВК-Мед» (Нижний Новгород), где подвергали их центрифугированию при 3000 об/мин в течение 5 минут, затем образцы мочи разливали по аликвотам и замораживали при температуре -20 ⁰С. Срок хранения проб не превышал 10 месяцев. После чего исследуемые образцы подвергали одновременной разморозке и единовременному анализу с целью определения уровня KIM-1 (пг/мл) при помощи тест-системы «ENZoLife Scientifiс КIM-1 ELISA» (США) методом иммуноферментного анализа.
Статистический анализ проводили при помощи программы IBM SPSS Statistics 23 и MedCalc 18.9.1. Правильность распределения количественного признака оценивали с использованием критерия Шапиро–Уилка (n<50) и Колмогорова–Смирнова (n>50). В случае нормального распределения количественные данные представляли в виде среднего значения и стандартного отклонения (М±SD), при распределении, отличном от нормального, представляли в виде медианы (Ме) и квартилей (Q25–Q75). При нормальном распределении количественного признака для сравнения двух групп использовали t-критерий Стьюдента для независимых выборок, при распределении признака, отличном от нормального, – U-критерий Манна–Уитни. С целью сравнения качественных признаков применяли χ²-критерий. При ожидаемых явлениях меньше 5 применяли точный критерий Фишера, в интервале 5–10 – χ²-критерий с поправкой на непрерывность Йетса. С целью установления диагностической значимости и выявления оптимального соотношения показателей чувствительности и специфичности применяли ROC-анализ с построением ROC-кривой и указанием площади под кривой – AUC. Значимость различий считали при р менее 0,05 [16].
Результаты
Пациенты обеих групп были сопоставимыми по полу и возрасту. Больные основной группы чаще имели в анамнезе стабильную стенокардию (р=0,015), большинство пациентов II и III функциональных классов – хроническую сердечную недостаточность (р=0,032) (чаще I и IIА стадии), неалкогольную жировую болезнь печени (р=0,032), хронический пиелонефрит (р=0,002), диабетическую болезнь почек (р=0,040). Также у больных ОКС и ОЗ был выше индекс коморбидности Charlson – 8 (6;10) и 5 (4;6); р<0,001.
Пациенты были сопоставимыми по параметрам гемодинамики при поступлении в стационар, структуре ОКС, продолжительности госпитализации. В стационаре у больных основной группы чаще регистрировали раннюю постинфарктную стенокардию (р=0,003), реже – фибрилляцию предсердий (р=0,021). У 5 (12,5%) и 2 (4,3%) пациентов соответственно наступил летальный исход (р=0,240). Основными причинами смерти стали ИМ (n=3 и n=2; p=1,0), ИМ в сочетании с прогрессированием ОЗ (основная группа) (n=2).
 У больных основной группы чаще диагностировали ХБП: 36 (90,0%) и 34 (72,3%) пациента (p=0,038). У большинства (80,0%) пациентов регистрировали ХБП С1–С3а-стадий.
У больных основной группы чаще диагностировали ХБП: 36 (90,0%) и 34 (72,3%) пациента (p=0,038). У большинства (80,0%) пациентов регистрировали ХБП С1–С3а-стадий.
По данным исследования, определение уровня KIM-1 допустимо как в свежевыпущенной моче, так и после проведения заморозки (без существенных потерь концентрации биомаркера при заморозке мочи и хранении до 5 лет) [17]. В зависимости от метода определения и фирмы производителя реактивов референсные значения KIM-1 в моче могут колебаться в широких пределах (147–2120 пг/мл) [18, 19]. В исследовании [20] изучен уровень KIM-1 в моче здоровых добровольцев (n=36) с Ме 0,7 (0,3–1,1) нг/мл («ENZoLife Scientifiс КIM-1 ELISA», США).
В нашем исследовании Ме KIM-1 в моче больных ОКС (n=87) составила 725,6 (420,0–1087,5) пг/мл. Пациенты группы ОКС+ОЗ имели более высокий уровень KIM-1: 921,0 (425,1–1314,8) и 658,0 (345,6–921,4) пг/мл (р=0,011), что также превышало референсные значения, полученные при обследовании здоровых [20].
Риск развития КИ-ОПП оценивали по шкале R. Mehran (n=79; см. рис. 1) [15]. Пациенты с КИ-ОПП (n=16; см. таблицу) чаще имели высокий и очень высокий риск по шкале R. Mehran в отличие от больных без КИ-ОПП (n=63): 50 и 27% соответственно (р=0,038).
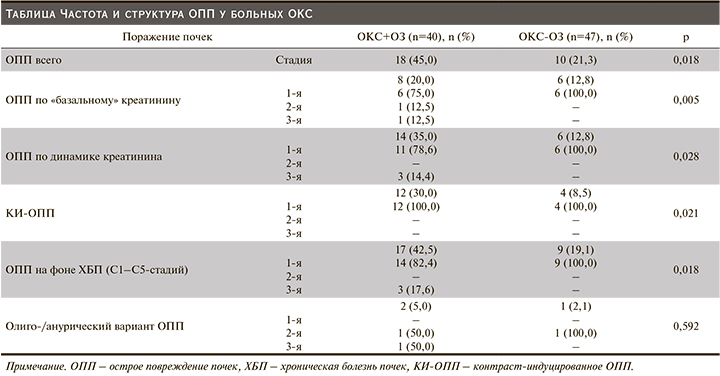
Была изучена частота и структура ОПП (см. таблицу).
У пациентов основной группы ОПП диагностировали чаще, в т.ч. ОПП по «базальному» креатинину, ОПП по динамике уровня креатинина, ОПП на фоне ХБП, в т.ч. КИ-ОПП. ОПП по уровню креатинина устанавливали преимущественно 1-й стадии, по темпу диуреза – 2-й и 3-й.
КИ-ОПП в обеих группах чаще иагностировали на 2–3-и сутки после проведения СКГ/ЧКВ. КИ-ОПП развилось на фоне введения неионного низкоосмолярного РКП йогексола с Ме объема 175 (150–300) и 200 (163–200) мл соответственно (р=0,953). Индекс КИ-ОПП ([объем контраста мл/СКФCKD-EPI мл/мин/1,73 м2) составил 2,82±0,87 и 3,13±1,3 соответственно (р=0,611) [21].
Согласно рекомендациям Американского колледжа радиологии и Национального фонда почек, для профилактики развития КИ-ОПП пациентам с рСКФ менее 30 мл/мин/1,73 м2 показана профилактическая гидратационная терапия 0,9%-ным раствором хлорида натрия со скоростью 1–3 мл/кг/ч в течение 1 часа до и 3–12 часов после СКГ, а при рСКФ от 30 до 45 мл/мин/1,73 м2 при наличии дополнительных факторов риска [22]. В то же время вопрос о проведении профилактической гидратационной терапии больных ОКС остается открытым, т.к. в исследовании [23] получено увеличение риска смерти от сердечной недостаточности (СН) у пациентов с высоким риском ее развития. По данным авторов [24], целесообразно снижение скорости гидратации у пациентов с СН до 0,5 мл/кг/ч. В нашем исследовании показания к проведению профилактической гидратационной терапии были лишь у одного пациента.
У пациентов с ОПП (n=28) в отличие от больных без ОПП (n=59) уровень KIM-1 был выше: 999,3 (478,7–1303,3) и 668,2 (365,5–955,6) пг/мл (р=0,023)]. Статистически значимые различия уровня KIM-1 у больных разными стадиями ОПП не выявлены.
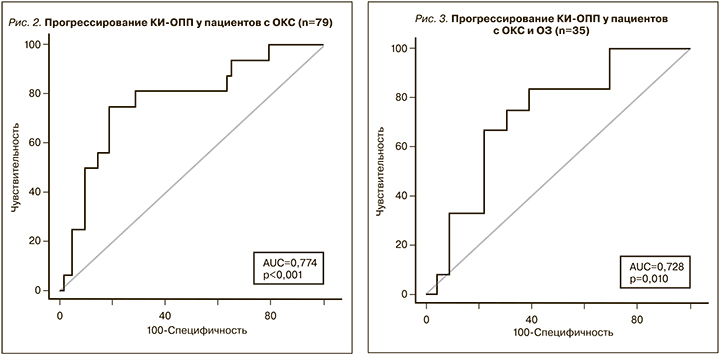
Нами был проведен ROC-анализ для определения значимости уровней KIM-1 в моче с целью диагностики различных вариантов ОПП. По данным ROC-анализа, выявлено, что при уровне KIM-1 в моче >888,43 пг/мл выше риск развития ОПП у пациентов с ОКС (AUC – 0,652; 95% ДИ: 0,542–0,751; р=0,020), а при уровне KIM-1 >993,48 пг/мл – ОПП по динамике уровня креатинина (AUC – 0,684; 95% ДИ: 0,577–0,780; р=0,015), однако диагностическая значимость не превышала общепринятого уровня (AUC>0,70). В то же время уровень KIM-1 в моче >1047,23 пг/мл позволял прогнозировать развитие КИ-ОПП у больных ОКС после проведения СКГ (n=79) (AUC – 0,774; 95% ДИ: 0,666–0,860; р<0,001) с чувствительностью 75,0%, специфичностью 80,95%, диагностической эффективностью 77,98%; а также у пациентов с ОКС и ОЗ после процедуры СКГ (n=35) (AUC – 0,728; 95% ДИ: 0,552–0,864; р=0,010) с чувствительностью 66,67%, специфичностью 78,26%, диагностической эффективностью 69,47% и точкой отсечения >1221,49 пг/мл (рис. 2, 3). Уровень KIM-1 в моче больных группы ОКС-ОЗ для диагностики ОПП в нашей выборке, по данным ROC-анализа, был статистически не значим.
Обсуждение
ОПП является серьезной патологией, развивающейся вследствие воздействия различных экстраренальных и ренальных повреждающих факторов, в т.ч. при ОКС [14]. Несмотря на новые терапевтические стратегии, ОПП у пациентов в критическом состоянии остается трудной проблемой для клинициста вследствие высокой смертности (28–90%) [25]. В нашем исследовании ОПП, в т.ч. КИ-ОПП, чаще развивалось у больных ОКС и ОЗ. Наиболее вероятной причиной послужила высокая распространенность уже имеющейся патологии почек у больных ОЗ с развитием ХБП [6]. Известно, что ХБП значительно увеличивает риск развития ОПП [14].
Одним из перспективных биомаркеров для ранней диагностики ОПП, включая КИ-ОПП, является KIM-1, отражающий преимущественно ишемическое или токсическое повреждение проксимальных канальцев нефрона, что происходит в т.ч. при воздействии РКП [8]. В нашем исследовании уровень KIM-1 у пациентов с ОПП был выше, однако площадь под кривой AUC была ниже общепринятой и меньше, чем в проведенном мета-анализе: 0,86 (0,83–0,89) [26]. По нашим данным, KIM-1, определенный в первые сутки госпитализации, у больных группы ОКС+ОЗ показал себя как ранний биомаркер КИ-ОПП в отличие от сКр, увеличение которого происходило в основном на 2–3-и сутки после проведения СКГ/ЧКВ. По данным литературы, повышение уровня KIM-1 в моче выявляли до увеличения концентрации сКр, что позволяло считать его ранним биомаркером КИ-ОПП [26, 27]. В недавно проведенном мета-анализе также была продемонстрирована хорошая диагностическая и прогностическая значимость KIM-1 в моче для раннего выявления КИ-ОПП: AUC – 0,88 (95% ДИ: 0,84–0,90)] с точкой отсечения от 48 до 6330 пг/мл [26].
Выводы
В ходе нашего исследования изучена роль KIM-1 в диагностике ОПП у пациентов с ОКС и ОЗ. Наибольшую значимость KIM-1 показал в качестве раннего биомаркера КИ-ОПП, что может иметь большое значение для своевременного выявления данной патологии и изменения лечебно-диагностической тактики с целью улучшения ближайшего и отдаленного прогноза.



