Хроническая болезнь почек (ХБП) на сегодняшний день признана «тихой эпидемией», поскольку распространенность данного заболевания неуклонно растет. Согласно мировой статистике, ХБП страдает около 15% населения. [1] Среди основных причин ХБП выделяют гломерулонефриты, которые приводят к развитию терминальной почечной недостаточности у трудоспособного населения [2].
В патогенезе гломерулонефритов задействованы клубочки, канальцы, в которых развиваются воспалительный процесс и некроз с образованием рубцовой ткани, а также сосудистый компартмент [3]. Ключевым фактором сосудистого ремоделирования служит эндотелиальный сосудистый фактор роста А (VEGF-А), депонирующийся в межклеточном пространстве. Экспрессия VEGF-A осуществляется подоцитами, эпителиальными клетками, гладкомышечными клетками сосудов, макрофагами [4–6]. Выделяют три вида рецепторов VEGF-А: VEGFR-1, VEGFR-2 и VEGFR-3 [7]. Взаимодействие VEGF-A с VEGFR-2 приводит к увеличению проницаемости кровеносных сосудов, к пролиферации эндотелиальных клеток, а также способствует накоплению экстрацеллюлярного матрикса [5]. При длительно существующей ишемии происходит накопление VEGF-А, что доказывает положительную обратную связь между ишемией и синтезом VEGF-А, что способствует развитию необратимых изменений в почечной ткани [8].
Цель исследования: изучение влияния VEGF-А на развитие ТИФ и вероятность достижения полной ремиссии у пациентов с первичными хроническими гломерулонефритами.
Материалы и методы. В исследовании приняли участие 75 человек в возрасте от 18 до 75 лет с диагнозом «первичный хронический гломерулонефрит в стадии обострения» и показаниями к проведению морфологического исследования почек. Пациенты с иными заболевания почек в исследование не включались. Среди исследуемых были 52 представителя мужского пола и 23 – женского. Всем участникам проводилось обследование, включившее оценку клинико-лабораторных показателей, проводились инструментальные методы исследования, в т.ч. пункционная нефробиопсия. Дополнительно срезы биоптатов окрашивались специфическим маркированным антителом к VEGF-А для определения его экспрессии в ткани почек. Для морфологической оценки биоптатов применялся цифровой микроскоп «Leica DMD108». Скорость клубочковой фильтрации рассчитывалась по формуле СKD-EPI (Chronic Kidney Disease Epidemiology Collaboration, 2011). Ранжирование стадий ХБП проводилось согласно классификации Kidney Disease: Improving Global Outcomes, 2002. Достижение полной ремиссии больными с нефротическим синдромом определялось по уровню суточной протеинурии (менее 0,2 г/сут.) и сывороточному альбумину (более 40 г/л). У пациентов с нефритическим синдромом полная ремиссия основного заболевания оценивалась по уровню белка в моче и отсутствию эритроцитов. Статистический анализ данных выполнялся с использованием программ Mic. Off. Excel-2016 (MicrosoftCorp., USA) и Statistica-10.0 (StatSoft Inc., USA). С помощью критерия Колмогорова–Смирнова оценивалась нормальность распределения признаков, при ненормальном распределении определялись медиана, интерквартильный размах. Непараметрический критерий Манна–Уитни использовался для оценки различий между двумя независимыми выборками, χ2 критерий – для неколичественных показателей. Для изучения взаимосвязи двух переменных применялся коэффициент корреляции Спирмена. При помощи логистического регрессионного анализа определялась вероятность развития события. Нулевую гипотезу отвергали при р<0,05.
Результаты. Средний возраст участников составил 36,7±12,3 года. Продолжительность заболевания почек – 3,0 [1,0; 5,0] года. Средний уровень креатинина крови – 81,0 [71,0; 105,0] мкмоль/л, мочевины – 5,9 [4,6; 7,9] ммоль/л, общего белка – 65,0 [53,0 70,0] г/л, альбумина – 37,8 [28,3; 42,0], суточной протеинурии – 2,6 [0,4;7,13] г/л. Средняя СКФ – 87,3±31,2 мл/мин/1,73 м2. Нефротический синдром выявлен у 53,3% участников, нефритический – у 46,7%. ХБП 1-й стадии зарегистрирована у 41 человека, 2-й – у 22, стадии-3А – у 12. Артериальная гипертензия наблюдалась в 65,3% случаев.
Согласно проведенному анализу статистических данных, одной из наиболее распространенных морфологических форм гломерулонефритов оказалась IgA-нефропатия, т.к. выявлена у 42 (56%) пациентов. Фокально-сегментарный гломерулосклероз и мембранозная нефропатия наблюдались в 18,7 и 17,3% случаев соответственно. Наиболее редкие формы: болезнь минимальных изменений – 5,3%, IgM-нефропатия – 2,7%. Изучение встречаемости различных морфологических признаков позволило выявить утолщение стенок капилляров у 49,3% пациентов, утолщение базальной мембраны капилляров в 54,7%. Проявления ТИФ выявлены у 76% пациентов. ТИФ 1-го ранга (менее 25% канальцев с признаками атрофии в биоптате и наличие воспалительных клеточных инфильтратов) зарегистрирован в 58,7% случаев, ТИФ 2-го ранга (от 26 до 50% атрофированных канальцев и наличие диффузной воспалительной клеточной инфильтрации) в 12,5% , ТИФ 3-го ранга (более 50% канальцев с атрофией и диффузной воспалительной клеточной инфильтрацией) наблюдался у 5,3% исследуемых.
Экспрессия фактора VEGF А в почечной ткани оценивалась в системе 3 баллов, где 0 баллов – отсутствие экспрессии, 1 – слабая экспрессия, 2 – умеренная, 3 балла – интенсивное окрашивание. Согласно рис. 1, максимальная экспрессия фактора наблюдается в проксимальном отделе канальцев во всех 75 биоптатах.
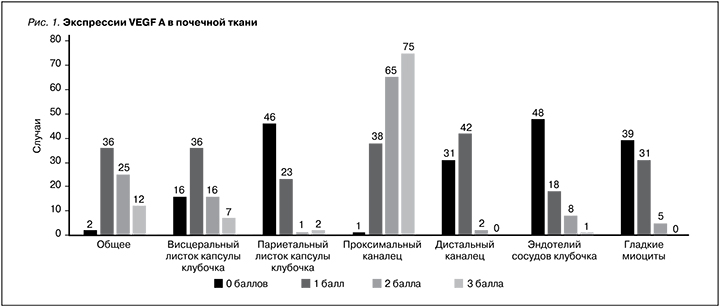
Корреляционный анализ между экспрессией VEGF-А в почечной ткани и морфологическими параметрами биоптатов позволил зарегистрировать достоверную связь VEGF-А с некрозом подоцитов (r – 0,26; р<0,05). Прямо пропорцио-нальная связь выявлена при изучении влияния VEGF-А на выраженность ТИФ (r – 0,26; р<0,05). Аналогичные корреляции выявлены с наличием фиброзно-клеточных полулуний (r – 0,28; р<0,05), а также с развитием фиброза интимы сосудов мелкого калибра (r – 0,32; р<0,05).
Проведение логистического регрессионного анализа (рис. 2) позволило определить вероятность развития ТИФ в зависимости от экспрессии VEGF-A в наружном листке капсулы Шумлянского–Боумена, представленном эпителиальными клетками. Согласно результатам анализа, в отсутствие экспрессии VEGF-A вероятность развития ТИФ составила 70%, при минимальной экспрессии – 85, при умеренной – 93, при выраженной – 98%. Методом регрессионного анализа оценивалась вероятность достижения стадии полной ремиссии хронических гломерулонефритов в зависимости от экспрессии VEGF-A в наружном листке капсулы.

На рис. 3 продемонстрирована вероятность достижения ремиссии при минимальной экспрессии VEGF-А и составила 34%, что на 22% больше, чем при выраженной экспрессии. Известно, что париетальные эпителиальные клетки участвуют в формировании полулуний и спаек в клубочках, а также в развитии центрального сегментарного гломерулосклероза, что неизбежно ведет к прогрессированию ХБП [9].
Обсуждение
Ремоделирование клубочков, включающее повреждение подоцитов, расширение клубочков, наличие воспалительных клеток, пролиферации эндотелиальных и эпителиальных клеток, препятствует оттоку ультрафильтрата, богатого белковыми структурами, в просвет канальцев. Направление меняется в сторону интерстициальной ткани, в результате чего ультрафильтрат распространяется вниз – между эпителием проксимальных канальцев и базальной мембраной, что приводит к развитию атрофии [10]. VEGF-А защищает эндотелиальные клетки и подоциты от апоптоза, однако в условиях гипоксии, изменения метаболизма клеток, а также влияния провоспалительных цитокинов и факторов роста, например TGFb-1 (трансформирующий фактор роста бета 1), происходит активация р38МАРК (р38 митоген-активированная протеинкиназа), что способствует апоптозу эндотелиальных клеток и подоцитов [11, 12].
Протеинурия и HIF1 – факторы, индуцируемые гипоксией 1-альфа, активируют эпителий проксимальных канальцев на выработку VEGF-А в ответ на повреждение, что следует рассматривать как компенсаторную реакцию.
Однако чрезмерная и неконтролируемая секреция VEGF-А может приводить к образованию нефункциональных сосудов, способствующих воспалению, активации макрофагов и фиброзу [13]. Согласно двунаправленной связи между эпителиальными клетками канальцев и эндотелиальными клетками капилляров, повреждение эпителиальных клеток способствует разрежению перитубулярных капилляров, что впоследствии усиливает гипоксическое повреждение клеток канальцев [14]. VEGF-A участвует в ремоделировании межклеточного матрикса за счет индукции факторов: активатора плазминогена, ингибитора активатора плазминогена-1 и интерстициальной коллагеназы [12]. Также VEGF-А активирует синтез моноцитарного хемотаксического протеина-1 в эндотелиальных и гладкомышечных клетках, что ведет к прогрессированию фибротических изменений межуточной ткани [15].
Заключение
В ходе проведенного исследования зарегистрирована выраженная экспрессия VEGF-А в проксимальном отделе канальцев, поскольку именно данный участок нефрона подвергается белковой перегрузке с последующим развитием атрофии канальцев. Дисрегуляция экспрессии VEGF-А в почечной ткани ведет к развитию ТИФ и снижению вероятности достижения стадии полной ремиссии у больных первичными хроническими гломерулонефритами. Выявленные корреляции VEGF-А с различными патоморфологическими элементами в биоптатах позволяют оценивать данный маркер не только как фактор, отвечающий за процессы адаптации сосудистой ткани, но и как патологический маркер, чрезмерная экспрессия которого приводит к развитию необратимых изменений.



