Введение
В настоящее время общепризнан факт преждевременного развития атеросклероза (АС) у больных системной красной волчанкой (СКВ). Установлено, что сердечно-сосудистые заболевания занимают одно из первых мест среди причин смерти больных СКВ [1–3]. В связи с этим проводится активное изучение факторов риска АС у больных СКВ, определение которых позволило бы выявлять среди пациенток группы наиболее высокого риска развития АС, нуждающихся в проведении скринирующих исследований. Последнее особенно важно, поскольку при СКВ показана высокая частота субклинического АС [4]. Факторы риска преждевременного АС у больных СКВ принято делить на традиционные, имеющие место в общей популяции, и нетрадиционные, связанные собственно с развитием СКВ. В качестве нетрадиционных факторов предложено рассматривать терапию глюкокортикостероидами (ГКС), длительность и активность заболевания, что связывают с персистированием хронического воспаления. В последнее десятилетие активно обсуждается роль антител к фосфолипидам (АФЛ) в ускоренном атерогенезе.
Значение такого фактора риска, как хроническая почечная недостаточность (ХПН), не вызывает сомнений, тогда как значение волчаночного нефрита (ВН) в целом остается неясным. В немногочисленных работах, включивших оценку ВН как фактор риска раннего АС при СКВ, получены противоречивые данные [5, 6]. В то же время имеются факты, позволяющие предположить, что при ВН атеросклеротическое поражение сосудов должно быть особенно выраженным. У пациенток с ВН по сравнению с больными СКВ без поражения почек повышены уровни окисленных ЛПНП [7], а при развитии нефротического синдрома (НС) – и липопротеина (а) [8], влияние которых на атерогенез доказано исследованиями в общей популяции. Показано значение НС как независимого фактора риска развития раннего АС у больных СКВ [9]. Кроме того, при ВН отмечена большая распространенность кардиоваскулярных факторов риска [10].
 Целью нашего исследования было комплексное изучение факторов риска развития раннего АС у больных СКВ, в т. ч. с поражением почек (ВН) и АФС.
Целью нашего исследования было комплексное изучение факторов риска развития раннего АС у больных СКВ, в т. ч. с поражением почек (ВН) и АФС.
Материал и методы
Пациентки
В исследование были включены 70 женщин, больных СКВ, наблюдавшихся в клинике нефрологии им. И.М. Тареева Университетской клинической больницы № 3 ГБОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздрава России.
Ранним (или преждевременным) развитием сердечно-сосудистой патологии у женщин, по результатам Framingham Heart Study, принято считать ее появление до 65 лет. Поскольку наше исследование касалось развития субклинического АС, мы определили максимальный возраст обследуемых пациенток, равным 55 годам. Кроме того, в работу не включали больных в возрасте менее 30 лет или с длительностью СКВ менее года.
Диагноз СКВ устанавливали в соответствии с критериями Американской ревматологической ассоциации (пересмотр 1997 г.). ВН диагностировали у 34 пациенток на основании выявления у них протеинурии свыше 0,5г/сут, эритроцитурии более 5 в поле зрения, данных нефробиопсии. В исследование не включены больные с ХПН (уровень креатинина – более 2 мг/дл в течение 6 месяцев). Диагноз АФС устанавливали согласно международным диагностическим критериям АФС (Sapporo, 1998).
Факторы риска
Анализировали влияние традиционных и нетрадиционных факторов риска сердечно-сосудистых заболеваний у больных СКВ. В качестве нетрадиционных факторов учитывали:
- клинические: длительность заболевания, его активность, определенную с помощью индекса SLEDAI [11], количество обострений СКВ, наличие ВН, НС, АФС, терапию ГКС (ее длительность, средняя суточная доза и кумулятивная преднизолона [ПЗ]), цитостатиками;
- лабораторные: уровень комплемента в начале заболевания и на момент исследования, уровень креатинина крови и скорость клубочковой фильтрации (СКФ), уровень СРБ на момент исследования. Антитела к кардиолипину классов IgM и IgG определяли твердофазным иммуноферментным методом, ВА – коагулологическими методами. Исходя из значений СКФ, определяли стадию хронической болезни почек (ХБП) по классификации K/DOQI, 2002.
Характеристики пациенток
Средний возраст пациенток составил 45 ± 6 лет (от 32 до 55 лет). Распространенность традиционных факторов риска АС у обследованных больных СКВ представлена в табл. 1.
Показатели, характеризующие течение, основные клинико-лабораторные параметры СКВ и проводимую терапию обследованных пациенток, приведены в табл. 2.
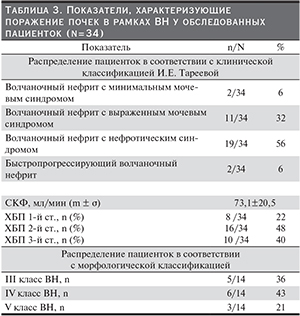
ВН был выявлен у 34 (49 % от общего числа больных) пациенток и верифицирован морфологически у 14 (41,2 %) . У большинства больных отмечены пролиферативные формы ВН (III и IV классов). Течение ВН у больных, которым нефробиопсия не проводилась, охарактеризовано в соответствии с классификацией И.Е. Тареевой. Клинико-морфологическая характеристика ВН представлена в табл. 3.
Диагностика атеросклероза
С целью диагностики АС проведено дуплексное сканирование сонных артерий и МСКТ с оценкой коронарного кальциноза.
 Дуплексное сканирование сонных артерий осуществлено всем больным. Исследование проведено на аппарате Toshiba Nemio (Япония) с линейным датчиком 6–12МГц. Определена толщина КИМ сонных артерий в 3 точках: 1-я точка – в общей сонной артерии на 10 мм дистальнее луковицы, 2-я – на 10 мм краниальнее от начала бифуркации, 3-я точка – во внутренней сонной артерии на 10 мм краниальнее от места разветвления сонных артерий. Признаками атеросклеротического поражения сонных артерий считали увеличение толщины КИМ более 0,9 мм [12–14] или обнаружение атеросклеротических бляшек (локальное увеличение толщины КИМ, равное 2 мм или более [15–17]). В результате проведенных шести измерений (три точки с обеих сторон) получили среднюю (mКИМ – средняя арифметическая из всех полученных величин толщины КИМ) и максимальную (maxКИМ – максимальная из них) толщину КИМ сонных артерий каждой пациентки.
Дуплексное сканирование сонных артерий осуществлено всем больным. Исследование проведено на аппарате Toshiba Nemio (Япония) с линейным датчиком 6–12МГц. Определена толщина КИМ сонных артерий в 3 точках: 1-я точка – в общей сонной артерии на 10 мм дистальнее луковицы, 2-я – на 10 мм краниальнее от начала бифуркации, 3-я точка – во внутренней сонной артерии на 10 мм краниальнее от места разветвления сонных артерий. Признаками атеросклеротического поражения сонных артерий считали увеличение толщины КИМ более 0,9 мм [12–14] или обнаружение атеросклеротических бляшек (локальное увеличение толщины КИМ, равное 2 мм или более [15–17]). В результате проведенных шести измерений (три точки с обеих сторон) получили среднюю (mКИМ – средняя арифметическая из всех полученных величин толщины КИМ) и максимальную (maxКИМ – максимальная из них) толщину КИМ сонных артерий каждой пациентки.
МСКТ выполнена 41 больной. Исследование проводилось на 4-м спиральном компьютерном томографе TOSHIBA Aquilion. Подсчет кальциевого индекса (КИ) проведен по методике Agatston [18]. Суммарный показатель КИ сравнивали с возрастной нормой. В соответствии с рекомендациями клиники Mayo по величине суммарного КИ определена степень риска развития ИБС [19].
Статистический анализ
Сделан анализ связи перечисленных факторов риска с развитием АС. При статистической обработке непрерывных показателей рассчитано среднее значение по группе и 95 % доверительный интервал, достоверность различий средних оценена методом Mann–Whitney. При сравнении частотных показателей для оценки достоверности использован точный критерий Fisher. Достоверными считали различия при р 0,05. При уровне р больше 0,05, но меньше 0,1 считали, что имеется тенденция к достоверности. Многофакторный анализ проведен с помощью метода логистической регрессии. Статистическую обработку данных выполняли с помощью пакета программ SPSS 11,5.
Результаты
Развитие АС отмечено у 36 (51%) больных в возрасте от 35 до 55 лет (средний возраст – 47,5 ± 5,3 года). У 20 из этих пациенток диагностирован ВН. Таким образом, в нашей популяции больных АС развился у 59 % пациенток с ВН.
Утолщение КИМ сонных артерий (внутренних, в области бифуркации или внутренних) отмечено у 35 (50 %) пациенток в возрасте от 35 до 55 лет (средний возраст – 47,6 ± 5,2 года). Средняя толщина КИМ (mКИМ) составила 0,73 ± 0,11 мм (от 0,55 до 1,12 мм), а средняя максимальная (maxКИМ) – 0,96 ± 0,30 мм (от 0,6 до 2,0 мм). 95-й перцентиль толщины КИМ общих сонных артерий был равен 0,9 мм, в области их бифуркаций – 1,3 мм, внутренних сонных артерий – 0,9 мм. Атеросклеротические бляшки выявлены у 13 (18,6 %) пациенток, из них у 9 – одна бляшка и у 4 – по две. Гемодинамически значимых стенозов не обнаружено. У 8 (19,5%) пациенток из 41, которым была проведена МСКТ, в отсутствие клинических признаков ИБС выявлен коронарный кальциноз (превышение возрастной нормы кальциевого индекса). Средний возраст больных коронарным кальцинозом составил 48,9 ± 4,1 года (от 42 до 54). Показатели кальциевого индекса 4 из них находились в диапазоне от 11 до 100 ЕД, что соответствует умеренному риску развития ИБС, 4 – в диапазоне 101–400 ЕД, что соответствует высокому риску развития ИБС.
Факторы риска
Традиционные факторы риска
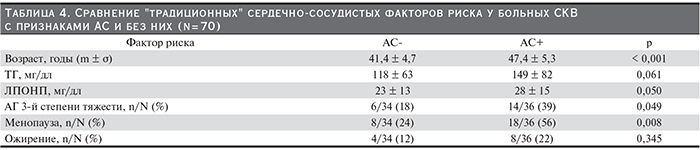
В нашем исследовании значимыми традиционными факторами риска оказались возраст, дислипидемия (увеличение уровней ТГ и ЛПОНП), тяжелая артериальная гипертензия (АГ), менопауза (табл. 4) и курение (индекс курения пачка – годы прямо коррелировал с индексом коронарного кальциноза: r = 0,380, p = 0,014). Частота АС при СКВ существенно возрастала у пациенток старше 40 лет (61,1 против 18,8 %, р = 0,004).
Нетрадиционные факторы риска
Активность СКВ
Не выявлено связи частоты развития АС с длительностью заболевания, индексом SLEDAI, гематологическими проявлениями. Однако активность СКВ, по-видимому, может вносить свой вклад в ускорение атерогенеза: пациентки с гиперлипидемией имели более высокий индекс SLEDAI (21,2 ± 9,4 против 18,7 ± 9,9; р = 0,049) по сравнению с больными без липидных нарушений.
СРБ
Однократно измеренный уровень СРБ у больных с признаками раннего АС и без них существенно не различался (0,1 [0,0; 0,4] мг/дл против 0,2 [0,1; 0,5] мг/дл, р = 0,551).
Антифосфолипидные антитела и антифосфолипидный синдром
Первоначальный анализ не выявил связи между АФЛ, АФС и АС. Однако при проведении дополнительного сравнения частот выявления АФЛ и АФС с учетом возраста пациенток, менопаузального статуса, индекса курения и степени АГ оказалось, что признаки АС у пациенток с АФС выявлялись в 6 раз чаще, чем без него (66,7 против 11,1 %, р = 0,05). Достоверной связи АС с наличием АФЛ в отсутствие клинических проявлений АФС обнаружено не было. Кроме того, выявлена связь АФЛ и АФС с нарушением обмена липидов – при гиперлипидемии частота АФЛ и АФС была выше, чем в ее отсутствие (56 против 36 %; р = 0,018, и 47 против 19 % соответственно, р < 0,001).

Гиперфибриногенемия
У пациенток с признаками раннего АС был достоверно выше уровень фибриногена плазмы крови (3,68 [3,15; 4,23] против 2,91 [2,46; 3,45] мг/дл, р = 0,008).
Волчаночный нефрит
Прямой связи между ВН в целом и ранним АС не обнаружено. Развитие АС также не зависело от наличия НС в анамнезе и уровня протеинурии. Не выявлено и связи между уровнем липидов и НС во время его ремиссии.
Частота традиционных факторов риска при ВН была выше, чем в его отсутствие: отмечена большая частота гиперлипидемии (84 против 54 %, р < 0,001) и АГ (82 против 54 %, р < 0,001).
Терапия ГКС
Связи между лечением ГКС и АС не выявлено, однако у пациенток, получавших более длительное или более интенсивное лечение ГКС, нарушения липидного обмена встречались чаще (табл. 5). Существенное увеличение частоты гиперлипидемии возникало при длительности терапии ПЗ более года (49 против 13 %, р < 0,001).
Не отмечено влияния на развитие АС терапии цитостатиками, равно как и описанного в литературе антиатерогенного эффекта аминохинолиновых препаратов.
Многофакторный анализ
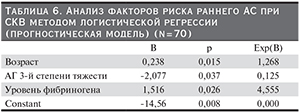
При многофакторном анализе значимыми оказались возраст, наличие тяжелой АГ, уровень фибриногена сыворотки крови (табл. 6).
 Обсуждение
Обсуждение
Распространенность субклинического АС при СКВ
Признаки АС были выявлены нами у 36 (51 %) пациенток. Сравнение собственных данных частоты выявления бляшек и утолщения КИМ с данными литературы затруднительно, поскольку критерии отбора пациенток и диагностики сосудистых изменений существенно различаются.
Наиболее близкой по дизайну к нашему исследованию является работа Doria и соавт. [20], в которой пациенткам проводилось дуплексное сканирование сонных артерий. Частота выявления бляшек оказалась практически равной таковой, полученной нами, в то время как частота утолщения КИМ была почти в 2 раза меньше. Существенно меньшие показатели толщины КИМ и частоты ее утолщения у пациенток в работе Doria связаны, по-видимому, с меньшим (в среднем на 10 лет) возрастом пациенток, чем в нашем исследовании. В то же время нами были использованы более жесткие критерии диагностики атеросклеротических бляшек (утолщение КИМ более или равное 2,0 мм против 1,3 мм в исследовании Doria), что в конечном итоге привело к получению сходных данных.
Частота коронарного кальциноза у больных СКВ в исследованиях других авторов составляет 28–43 % [4, 21, 22], что превышает полученную нами. Последнее объясняется, по-видимому, включением в описанные исследования пациенток с ХПН, в т. ч. получавших лечение гемодиализом.
Таким образом, наши данные согласуются с литературными и подтверждают факт преждевременного развития АС при СКВ.
Факторы риска АС при СКВ
Наше исследование подтвердило значимость для развития АС при СКВ таких традиционных факторов, как возраст, гиперлипидемия, АГ, менопауза и курение. Связи с ожирением выявлено не было, по-видимому, вследствие того, что у большинства больных оно было выражено минимально.
Необходимо отметить, что значимость традиционных факторов риска в развитии АС настолько высока, что затрудняет оценку вклада нетрадиционных факторов, скрывая их значение. К сожалению, в настоящий момент практически невозможно провести исследование, в которое включило бы пациенток, не имеющих таких существенных факторов риска, как курение и менопаузальный статус.
По результатам нашего исследования частота АС возрастала у пациенток старше 40 лет, что позволяет рекомендовать проведение скринирующих исследований начиная с этого возраста.
Мы не выявили связи между иммуновоспалительной активностью СКВ и развитием АС. В то же время ее влияние было отмечено в отношении гиперлипидемии. Существование подобной зависимости подтверждают данные Howite и соавт. [23], которые показали снижение активности липопротеинлипазы у больных СКВ под влиянием провоспалительных цитокинов – интерферонов и интерлейкина-1.
Мы не обнаружили связи между однократно измеренным уровнем СРБ и развитием АС, однако ранее нами был оценен показатель, отражающий динамику уровня СРБ – частоту его повышения (отношение количества анализов с повышенным уровнем СРБ ко всем проведенным) [24]. При этом была выявлена связь, статистически значимая при одно- и многофакторном анализе. Эти результаты согласуются с данными ряда исследований, в которых показано значение СРБ как независимого фактора риска сердечно-сосудистых заболеваний в общей популяции [25, 26] и у больных СКВ [6, 27, 28]. Таким образом, полученные нами результаты позволяют заключить, что уровень СРБ может использоваться для прогнозирования развития преждевременного АС при СКВ, однако необходимо его исследование в динамике. Какая именно частота повышения уровня СРБ является показанием к проведению скринирующих исследований, в настоящий момент определить затруднительно ввиду недостаточности статистического материала.
По данным нашего исследования отмечена связь развития АС с наличием АФС, а гиперлипидемии – и с АФЛ, и с АФС. Проатерогенное действие АФЛ, продемонстрированное в исследованиях in vitro, связано с их способностью активировать эндотелиальные клетки [29, 30] и перекрестно реагировать с окисленными липопротеинами низкой плотности [31, 32].
В экспериментальных исследованиях на мышах установлена связь между наличием АФЛ, а именно антител к бета-2-гликопротеину-I, и появлением атеросклеротических бляшек [33]. Однако другие аналогичные исследования эту связь не подтвердили – введение мышам АКЛ IgG уменьшало частоту появления бляшек [34]. Неоднозначные результаты получены также в исследованиях, изучавших связь раннего АС с АФЛ [6, 28, 35, 36].
С учетом противоречивости данных литературы о роли АФЛ можно предположить, что с ранним развитием АС у больных СКВ связано именно наличие АФС со свойственными ему тромбозами, а не циркуляция АФЛ. Это предположение подтверждается выявленной нами значимостью уровня фибриногена как фактора риска АС. На это указывают и данные других исследований больных первичным АФС (диагностированным на основании выявления АФЛ и соответствующих клинических симптомов заболевания), в которых частота развития АС среди пациенток была существенно выше, чем у здоровых лиц [37–39].
Уровень фибриногена в нашем исследовании оказался единственным нетрадиционным фактором, напрямую связанным с развитием АС. Помимо этого выявлена его значимость при многофакторном анализе. По-видимому, уровень фибриногена оказался показателем, суммирующим действие остальных нетрадиционных факторов, связанных как с иммуновоспалительной активностью, так и с нарушениями свертывания крови в рамках АФС. Данные о его связи с АС получены также в общепопуляционных исследованиях [40, 41] и при СКВ [6, 28, 42].
Наличие ВН, по нашим данным, не было связано с развитием АС, но влияло на частоту гиперлипидемии. С нашей точки зрения, большую частоту гиперлипидемии при ВН по сравнению с больными СКВ без поражения почек нельзя объяснить влиянием НС per se, поскольку у большинства больных с ремиссией НС уровень липидов возвращался к норме. Возможной причиной повышения частоты гиперлипидемии у пациенток с ВН, скорее всего, может быть высокая активность СКВ и обусловленная этим более интенсивная терапия стероидами по сравнению с больными без поражения почек.
В нашем исследовании терапия ГКС была связана с развитием гиперлипидемии. Эта зависимость показана также другими исследованиями [6, 43]. Так, Petri и соавт. [43] обнаружили появление гиперлипидемии при суточной дозе ПЗ более 10 мг.
В то же время в исследовании MacGregor и соавт. [44] применение ПЗ в дозе менее 10 мг/сут не влияло на изменение липидного спектра. Имеются и другие работы, в которых такую зависимость установить не удалось. Так, в исследовании Roman и соавт. [14] пациентки, в сосудах которых были обнаружены атеросклеротические бляшки, получали меньшие дозы ПЗ, чем не имевшие таковых. Возможной причиной отсутствия связи между АС и лечением ГКС в названном исследовании, по-видимому, можно считать сравнительно низкую среднюю суточную дозу ПЗ – 6,9 ± 6,8 мг/сут – в группе пациенток с признаками АС и 11,9 ± 6,9 мг/сут без них.
Заключение
Таким образом, полученные нами данные свидетельствуют: развитие раннего АС при СКВ может быть результатом сочетанного воздействия традиционных и нетрадиционных факторов риска АС, взаимно усиливающих друг друга. Всем больным СКВ необходим строгий контроль модифицируемых традиционных факторов риска: оптимизация уровня физической нагрузки, отказ от курения, нормализация артериального давления, снижение веса. Необходима диетическая и/или медикаментозная коррекция гиперлипидемии. Пациенткам, имеющим высокий риск развития АС, показано проведение скринирующего обследования для выявления субклинического АС. В первую очередь это относится к больным старше 40 лет с АГ и гиперфибриногенемией. Принимая во внимание роль активности СКВ и терапии ГКС в развитии раннего АС, необходимо стремиться к достижению полной ремиссии заболевания минимально возможными дозами стероидов.



