Сердечно-сосудистые заболевания являются главной причиной летальности среди пациентов с ХБП [1]. Хотя традиционные факторы риска вносят свой вклад в исходы лечения [1], поиск и определение веса других специфических факторов остаются важной задачей науки и практики общественного здравоохранения [2]. Опубликовано немного работ по распространенности минеральных и костных нарушений среди пациентов с ХБП в российской популяции, еще в меньшей степени затронуты вопросы их влияния на прогноз [3–8]. Настоящая работа представляет анализ сравнительного влияния биохимических показателей минеральных и костных нарушений на прогноз для пациентов, находящихся на гемодиализе, в проспективном шестилетнем наблюдении.
В 2009 г. на смену рекомендациям KDOQI-2003 по метаболизму кости и патологии скелета при хронической болезни почек [9] пришли рекомендации KDIGO по минеральным и костным нарушениям при хронической болезни почек (МКН-ХБП) [10]. Перевод на русский язык рекомендаций KDOQI подготовлен и опубликован Российским диализным обществом (РДО) [11], а на основе рекомендаций KDIGO специальной рабочей группой под эгидой РДО созданы Национальные рекомендации по МКН-ХБП [12, 13]. Построенные на более строгих принципах доказательной медицины, чем ее предшественницы [14, 9], Рекомендации KDIGO, с одной стороны, несколько либерализовали требования к коррекции вторичного гиперпаратиреоза и кальциемии, с другой – ужесточили требования к уровню фосфатемии (табл. 1).
Настоящее проспективное наблюдение охватывает период (2006–2012), когда в качестве целевых параметров были приняты в основном рекомендованные KDOQI уровни, тем более что и после публикации Рекомендаций KDIGO осталось много неопределенностей, изложенных в комментариях европейских и национальных обществ [15–17, 13].
Материал и методы
В проспективное наблюдательное исследование с 2006 г. были включены 245 пациентов, получавших лечение гемодиализов в одном центре – городской Мариинской больнице Санкт-Петербурга (70 пациентов, лечившихся 01.01.2006 и 175 новых пациентов, принятых на диализ с этой даты). Выбыли из наблюдения 92 пациента, переведенных в другие центры и на трансплантацию, 90 пациентов оставались на лечении на момент окончания исследования – 31.12.2012. Умерли 63 пациента; среднегодовая летальность составила 8 % и значимо не различалась по календарным годам.
Гемодиализ проведен преимущественно в трехразовом режиме (доля пациентов с более частыми сеансами не превышала 5 %) на диализаторах с синтетической мембраной LOPS18 (28 %), LOPS20 (41 %), HIPS18 (16 %), HIPS20 (11 %) и HF100(4 %); структура используемых диализаторов по годам менялась статистически незначимо (χ2, р > 0,5) и их доли в структуре значимых трендов не демонстрировали (p > 0,2). Обеспеченный Kt/V составил 1,41 ± 0,28 за все время наблюдения и демонстрировал тенденцию к очень медленному росту (+0,03 ± 0,08 за год). При ежемесячном контроле доля пациентов с Kt/V < 1,2 составляла 9–14 %. Длительность сеансов колебалась от 4,0 до 4,5 часов. Доля гемодиафильтрации среди общего числа проведенных сеансов постепенно увеличивалась с 16 до 23 %; объем замещения при гемодиафильтрации составил 18 ± 3 л/сеанс. При ежеквартальном контроле воды из системы распределения LAL-тест не выявил присутствия эндотоксинов (предел измерения – 0,25 EU/мл). Использовался диализирующий раствор с содержанием кальция 1,5 ммоль/л. Уровень бикарбоната в диализирующем растворе составил 32 ÷ 38 ммоль/л и подбирался индивидуально для достижения уровня стандартных бикарбонатов перед вторым сеансом диализа в неделю 22–24 ммоль/л; бикарбонатный компонент диализирующего раствора готовился из сухого концентрата B.
Результаты
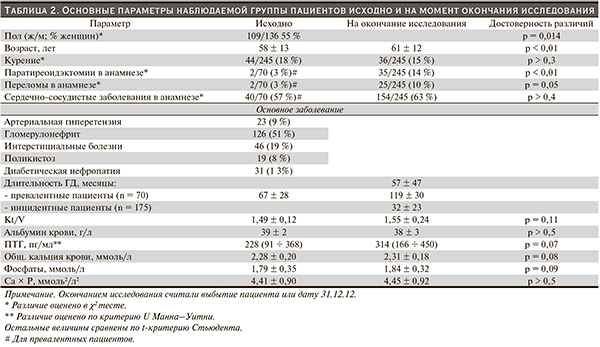
В табл. 2 представлены исходные характеристики пациентов и соответствующие параметры на момент окончания наблюдения: результаты последнего планового обследования перед выбытием пациента (для биохимических данных – ежемесячно, для ПТГ – ежеквартально).
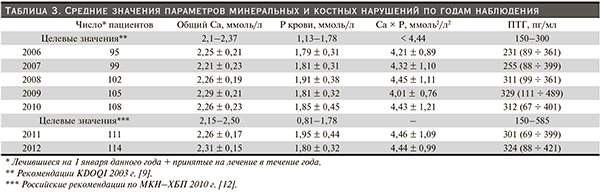
В табл. 3 отражены принятые в диализном центре целевые значения параметров МКН-ХБП и их средние величины за период наблюдения по годам; данные по паратгормону представлены в виде медианы и квартилей, поскольку распределение величин ПТГ существенно отличалось от нормального. За время наблюдения значимой динамики кальциемии в наблюдаемой популяции отмечено не было. Доли пациентов с гипо- и гиперкальциемией не превысили 16 и 11 % соответственно (в ретроспективной оценке по целевым диапазонам 2010 г.) и не обнаруживали стабильной тенденции за период наблюдения. Аналогично фосфатемия не демонстрировала определенной динамики за время наблюдения (единственное отклонение – 2008 г.: уровень фосфатов – 1,91 ± 0,39 v. 1,82 ± 0,32 [р = 0,05] в другие периоды [р = 0,02]; оно не имело клинических или технологических объяснений и, возможно, было лабораторным артефактом). Доля пациентов с гипо- и гиперфосфатемией не превысила 8 и 56 % соответственно.
Исходно 32 % пациентов получили терапию альфакальцидолом в дозе 0,25 мкг/сут. К окончанию наблюдения 52 % постоянно в течение года получали активные формы витамина D (альфакальцидол per os, парикальцитол в/в или per os – дозы пересчитывались на эквивалент альфакальцидола), 25 % пациентов не получали D3, 27 % получали его часть года. Медиана недельной эквивалентной дозы составила 1,75 мкг (ИР – 1,62 ÷ 2,42 мкг). За время наблюдения 16 пациентам выполнены курсы инъекций активных форм витамина D в паращитовидные железы, 34 пациентам – паратиреоидэктомия. Около 16 % в 2011–2012 гг. получали цинакалцет с медианой суточной дозы 60 мг (ИР – 30 ÷ 90 мг); ранее терапию цинакалцетом получали несколько пациентов в рамках клинических исследований. Выраженность гиперпаратиреоза по крайней мере не нарастала: медиана индивидуальных трендов ПТГ в расчете за год составила -27 пг/мл/год (ИР: -77 ÷ +18 пг/мл/год). Преимущественно исходно снижались высокие уровни ПТГ: для диапазона выше 600 пг/мл среднее изменение составило -220 пг/мл/г., для 600–300 пг/мл – -101 пг/мл/г., для диапазона менее 150 пг/мл – -2 пг/мл/г. (для тренда по этим подгруппам р < 0,001) (табл. 4).
Высокая исходная фосфатемия (статистически погранично связанная с ПТГ: r = 0,31, p = 0,08) демонстрировала хоть и благоприятную, но недостаточную динамику: медиана индивидуальных трендов (в пересчете на год) составила -0,27 ммоль/л/г. (ИР: -0,61 ÷ +0,28 пг/мл/г.). Большинство пациентов получали кальцийсодержащие фосфат-связывающие препараты (ФСП) (в средней дозе 1,6 г/сут), только 14 % пациентов постоянно получали севеламер (в средней дозе 4,8 г/сут; еще 11 % пациентов принимали севеламер непостоянно); 8 % пациентов к терапии курсами добавлялись алюминийсодержащие ФСП.
Результаты регрессионного анализа выживаемости пациентов в зависимости от исследуемых параметров представлены в табл. 5. Средний уровень фосфатов включен в анализ как категориальная величина для демонстрации значимости превышения определенных пределов.
В качестве диапазонов категорий уровней фосфатов в анализе Кокса использованы:
- целевой диапазон KDOQI-2003 (1,13–1,78 ммоль/л), ниже и выше его;
- целевой диапазон KDIGO-2009 (0,81–1,45 ммоль/л), ниже и выше его;
- ниже и выше верхней границы целевого диапазона KDOQI-2003 (1,78 ммоль/л);
- ниже и выше верхней границы целевого диапазона KDIGO-2009 (1,45 ммоль/л);
- по границам квартилей уровней фосфатов в группе (1,52–1,75–2,08 ммоль/л);
- по границам тертилей уровней фосфатов в группе (1,59–1,95 ммоль/л).
С точки зрения значимости для прогноза в нашей группе наблюдения наибольшее значение имело разделение пациентов с уровнями фосфатов по тертилям: менее 1,59 ммоль/л, 1,59–1,95 и более 1,95 ммоль/л (рис. 1).
По сравнению с группой пациентов с наименьшим уровнем фосфатов группа пациентов с фосфатами в среднем диапазоне характеризовалась увеличением риска летальности на 57 %, а в диапазоне более 1,95 ммоль/л – более чем в 8 раз. По сравнению с этим влиянием на выживаемость эффект повышения Kt/V на 0,1 давал снижение риска только на 10 % (хотя и статистически значимое). Кальциемия не вошла в модель регрессионного анализа в качестве значимой переменной, но имело значение взаимодействие уровней кальция и фосфатов.
При включении в модель регрессионного анализа уровня паратгормона в качестве непрерывной величины получена его обратная связь с риском летальности: в наблюдаемой группе пациентов повышение уровня паратгормона на 100 пг/мл связано со снижением летальности на 23 %. Для объяснения этой неожиданной связи в дополнительном анализе уровень паратгормона был включен в модель в качестве категориальной величины. Значение различия в выборе критерия для распределения по категориям представлено на рис. 2. Подгруппа с низким уровнем ПТГ (ниже 150 пг/мл [KDOQI-2003 (9)] и ниже 130 пг/мл [KDIGO-2009 (10)] соответственно) характеризовалась наиболее низкой выживаемостью. Подгруппа с уровнем ПТГ в пределах целевого диапазона KDIGO демонстрировала лучшую, чем подгруппа с более высоким уровнем ПТГ, выживаемость. При этом разделение подгрупп по верхнему пределу целевого диапазона KDOQI (150–300 и более 300 пг/мл) не давало различий в выживаемости. В регрессионном анализе Кокса получены риски, связанные с выходом за целевой диапазон по KDIGO: превышение паратгормона величины 585 пг/мл дает рост риска на 29 % (интерквартильный размах [ИР]: 12 ÷ 47 %); уровень ПТГ ниже 130 пг/мл – на 69 % (ИР: 40 ÷ 99 %). При анализе рисков выхода из целевого диапазона по KDOQI оказалось, что уровни ПТГ ниже 150 пг/мл связаны с увеличением риска на 67 % (ИР: 33 ÷ 102 %), а уровни ПТГ выше 300 пг/мл не связаны с повышением риска летальности (относительный риск: 0,99 (ДИ: 0,61 ÷ 1,38). В моделях риски скорректированы по возрасту, дозе диализа, фосфатемии (категориальная величина). Внесенные в первоначальные модели уровни кальция и диагноз в окончательную модель не вошли.
Обсуждение
 В наблюдательном проспективном когортном исследовании, включившем превалентных пациентов на дату начала исследования (2006) и всех инцидентных пациентов (2006–2012) одного диализного центра, продемонстрирована высокая распространенность гиперфосфатемии и ее существенное влияние на прогноз для жизни пациентов, по значимости превышающее влияние гиперпаратиреоза и обеспеченной дозы диализа. Примерно такое же соотношение эффектов гиперфосфатемии и гиперпаратиреоза показано в наблюдательном исследовании DOPPS [18]: достоверный 20–30 %-ный рост рисков общей и сердечно-сосудистой летальности начинался с уровня ПТГ более 600 пг/мл, тогда как полутора–трехкратный рост рисков – при повышении фосфатемии выше 1,95 ммоль/л. В мета-анализе 47 когортных исследований (более 327 тыс. пациентов) относительный риск повышения фосфатов на 0,3 ммоль/л несет достоверное повышение риска на 18 % (а при расчете по трем адекватно скорректированным моделям – суммарно 4651 пациент – на 35 %), тогда как повышение уровня ПТГ на 100 пг/мл и повышение кальциемии на 0,25 ммоль/л связаны со статистически пограничным ростом риска на 1 и 8 % соответственно [19]. По нашему мнению, величины, имеющие, скорее всего, ненормальное распределение и J-образный характер влияния на выживаемость, следует включать в регрессионный анализ Кокса в качестве категориальных величин, что лучше характеризует нелинейные зависимости (рис. 1 и 2). Проблемой на относительно небольших выборках остается выбор границ для категорий анализируемых переменных.
В наблюдательном проспективном когортном исследовании, включившем превалентных пациентов на дату начала исследования (2006) и всех инцидентных пациентов (2006–2012) одного диализного центра, продемонстрирована высокая распространенность гиперфосфатемии и ее существенное влияние на прогноз для жизни пациентов, по значимости превышающее влияние гиперпаратиреоза и обеспеченной дозы диализа. Примерно такое же соотношение эффектов гиперфосфатемии и гиперпаратиреоза показано в наблюдательном исследовании DOPPS [18]: достоверный 20–30 %-ный рост рисков общей и сердечно-сосудистой летальности начинался с уровня ПТГ более 600 пг/мл, тогда как полутора–трехкратный рост рисков – при повышении фосфатемии выше 1,95 ммоль/л. В мета-анализе 47 когортных исследований (более 327 тыс. пациентов) относительный риск повышения фосфатов на 0,3 ммоль/л несет достоверное повышение риска на 18 % (а при расчете по трем адекватно скорректированным моделям – суммарно 4651 пациент – на 35 %), тогда как повышение уровня ПТГ на 100 пг/мл и повышение кальциемии на 0,25 ммоль/л связаны со статистически пограничным ростом риска на 1 и 8 % соответственно [19]. По нашему мнению, величины, имеющие, скорее всего, ненормальное распределение и J-образный характер влияния на выживаемость, следует включать в регрессионный анализ Кокса в качестве категориальных величин, что лучше характеризует нелинейные зависимости (рис. 1 и 2). Проблемой на относительно небольших выборках остается выбор границ для категорий анализируемых переменных.
С 2010 г. (по который собраны исследования в мета-анализе S.C. Palmer [19]) вышло крупное исследование, параллельно анализирующее риски отклонений от целевых диапазонов параметров МКН-ХБП – ARO [20]. В группе 7970 пациентов со средним сроком наблюдения 20 месяцев риски летальности в зависимой от времени модели по сравнению с диапазоном ПТГ 150–300 пг/мл составили: для уровней ПТГ выше 600 пг/мл – 1,53, а для уровней 300–600 пг/мл – только 1,28; при этом в диапазоне ниже целевого статистически значимым риск становился при ПТГ ниже 75 пг/мл. В нашем исследовании уровень ПТГ имел значение лишь при превышении 585 пг/мл, а объединение диапазонов 300–600 и более 600 пг/мл привело к утрате значимости верхней границы целевого диапазона (300 пг/мл). Возможно, объяснением различий является значительно более высокий уровень фосфатов среди наших пациентов: 1,8 ± 0,35 v. 1,4 ± 0,4 ммоль/л в ARO в большинстве подгрупп (и только при ПТГ более 600 пг/мл уровень фосфатов составил 1,7 ммоль/л).
Исследование N. Tangri (2011) представляет по данным Почечного регистра Великобритании анализ влияния параметров МКН-ХБП на инцидентных пациентов, которых в нашем исследовании также было большинство (71 %) [21].
В этом исследовании увеличение рисков гиперкальциемии не достигло статистической значимости (а гиперпаратиреоз – ПТГ более 300 пг/мл – не демонстрировал даже такой тенденции); при этом увеличение рисков несла гипофосфатемия (на 22 %), тогда как уровни фосфатов выше 1,77 ммоль/л были связаны с почти достоверным снижением риска: 0,74 (ДИ: 0,53 ÷ 1,03).
Различные исследования не вполне сопоставимы еще и потому, что оценивают значения анализируемых параметров за разные периоды: исходно [18], в среднем за первые три [20] месяца или год [21] наблюдения, либо за 6 месяцев перед исходом в исследовании [22]. При этом чем за больший начальный период оцениваются параметры, тем в меньшей степени имеет значение превышение паратгормоном уровня 300 пг/мл и тем большее значение имеет уровень фосфатов. Возможно, это связано с тем, что в ходе исследования проводится более успешная коррекция исходного гиперпаратиреоза, чем гиперфосфатемии. В нашем наблюдении мы оценивали параметры за период наблюдения до 4 лет, параллельно анализируя индивидуальные тренды. Наши оценки рисков фосфатемии близки результатам исследования, использовавшего в качестве уровня фосфатемии средние данные за 6 последних месяцев лечения (перед смертью или окончанием исследования) [22]: по сравнению с «нормальным» диапазоном (0,97–1,61 ммоль/л) «мягкая» гиперфосфатемия (1,62–2,10 ммоль/л) давала увеличение риска на 94 %, тяжелая фосфатемия – почти в 4 раза; как непрерывная величина фосфатемия давала увеличение риска на 26 % на каждые 0,3 ммоль/л.
В совсем недавно вышедшем мета-анализе, включившем по более строгим критериям меньшее число работ (но включая последние), чем предыдущий [19], сделана ставка на выявление J-эффекта: сравнение высоких и низких значений параметров с целевым диапазоном. Диапазоны высоких значений фосфатов (> 1,77 ммоль/л), кальция (> 2,37 ммоль/л) и паратгормона (> 300–600 пг/мл) связаны с достоверно большим риском: соответственно на 20, 10 и 11 %. Пребывание в диапазоне низких значений давало неоднозначные оценки при высокой гетерогенности результатов исследований [23].
Борьба с гиперфосфатемией должна вестись по четырем основным направлениям: ограничение поступления фосфатов с пищей, особенно фосфатов как добавок/консервантов [24], интенсификация диализных режимов, использование фосфат-связывающих препаратов (ФСП), а также коррекция ГПТ, когда при его высокой выраженности гиперфосфатемия становится вторичной. К сожалению, на сегодняшний день ни одно из этих направлений не имеет оптимальных решений.
Значительно снизить потребление фосфатов нельзя, поскольку в пищевых продуктах они неразрывно связаны с белками, а ограничение потребления белков (по крайней мере на гемодиализе и особенно на перитонеальном диализе) с высокой вероятностью приводит к белково-энергетической недостаточности. Недавний реанализ исследования HEMO продемонстрировал прямую независимую связь рисков летальности со степенью назначенного ограничения потребления фосфатов [25]. Существует возможность выбирать продукты с относительно низким фосфорно-кальциевым коэффициентом. Категорически должны быть исключены продукты и напитки с фосфатсодержащими добавками/консервантами [26, 27].
Проблемой для удаления фосфатов на сеансе диализа является их преимущественно внутриклеточное расположение и низкая скорость межсекторального перемещения – существенно ниже, чем, например, у ß2 микроглобулина: 30 v. 82 мл/мин [28]. Это приводит к выраженному эффекту отскока [29] и делает интенсификацию короткого сеанса диализа (4 часа) малоэффективной в части удаления фосфатов [30]. Это нашло подтверждение в недавно опубликованном рандомизированном исследовании по гемодиафильтрации ESHOL [31], где ГДФ-on-line со средним объемом замещения в 23 литра за сеанс не дала снижения фосфатов по сравнению с гемодиализом. Эффективным решением могло бы стать удлинение сеансов или – еще лучше – увеличение частоты [32], но на этом пути стоят организационные ограничения.
Основным средством, препятствующим всасыванию фосфатов из кишечника, долгое время являлись соли кальция: по сложившейся практике: ацетат – в Америке, карбонат – в Европе. Быстро выяснилось, что во многих ситуациях (фактически охватывающих большинство пациентов на диализе) эта терапия ускоряет сердечно-сосудистую кальцификацию [10], которая несомненно является крайне неблагоприятным фактором для прогноза [33].
В недавних обзорах представлены убедительные данные о сопоставимой эффективности трех основных бескальциевых ФСП [34, 44]: севеламера, лантана карбоната и магния карбоната, по сравнению с солями кальция. Лишь одно исследование напрямую сравнивает севеламер и лантана карбонат, находя их сопоставимыми по эффективности в условиях достаточной приверженности лечению [36].
При сопоставимой эффективности в снижении гиперфосфатемии бескальциевые ФСП убедительно демонстрируют более высокую безопасность, предотвращая риски гиперкальциемии и сосудистой кальцификации. По-видимому, именно этими свойствами опосредовано снижение рисков летальности, продемонстрированное в недавнем мета-анализе. S.A. Jamal et al. [35]: в 11 рандомизировнных исследованиях с числом пациентов 4622 показано снижение риска летальности на 22 % в группе получавших бескальциевые ФСП по сравнению с группой получавших кальцийсодержащие ФСП. Эффект оказался более выраженным при длительной терапии (24 месяца) и в группах диализных пациентов (по сравнению с преддиализными). Cевеламер и лантан значимо снижают риски гиперкальциемии [34], но только в отношении севеламера существуют полученные в РКИ данные в пользу замедления кальцификации сосудов (в трех из пяти ключевых исследований) [44]. В одном из «негативных» исследований с севеламером (BRiC) [37] различия в кальцификации могли быть не выявлены из-за высокой смертности в группе пациентов, получавших соли кальция. В другом (CARE-2 [38]) – прогрессирование кальцификации было одинаковым, но необычно быстрым по сравнению с результатами в других исследованиях с севеламером, что могло отражать более тяжелую сердечно-сосудистую патологию и выраженный ГПТ. Позитивные эффекты севеламера в отношении липидемии, а также провоспалительных (СРБ) и прокальцификационных (фетуин) биомаркеров, а также FGF-23 могут иметь самостоятельный эффект на твердые конечные точки. Кроме того, по сравнению с солями кальция севеламер и лантан предотвращают смещение костной морфологии в сторону адинамической болезни, характеризующейся наихудшим прогнозом [44].
Соли магния (или гидроксид) применялись в качестве ФСП с 1980-х гг., но не были широко приняты из-за переносимости и поскольку соли кальция считались более оптимальными.
В последние годы опубликовано несколько небольших коротких исследований, демонстрирующих, в частности, хороший эффект от комбинации магния карбоната и кальция ацетата, получившей регистрацию в европейских странах и несколько позже – в России. Остается открытым вопрос об оптимальной концентрации магния в диализирующих растворах при применении этой терапии, а также о безопасности с точки зрения рисков сосудистой кальцификации
с учетом значительного содержания кальция в предложенных комбинациях и рисков избыточного подавления функции паращитовидных желез с перспективой развития адинамической болезни кости [39].
Алюминий (в форме солей или гидроксида) длительно и эффективно использовался в качестве ФСП до выявления его токсичности в отношении костной, кроветворной и нервной систем. И хотя источником поступления алюминия несомненно была неочищенная вода для диализа, параллельно с вводом в качестве стандарта реверсивного осмоса для очистки воды в 1980-х было свернуто применение алюминийсодержащих ФСП. Не существует прямых свидетельств токсичности такой терапии. Более того, на фоне продолжающегося применения гидроксида алюминия (в Австралии – 15 %, в Германии, Италии, Испании – 12–14 %; данные DOPPS-III [40]) не опубликовано ни одной работы, связывающей применение гидроксида алюминия в качестве ФСП с проявлением его токсичности [41]. Одно из немногих исследований, проведенных во времена использования ультрачистого диализирующего раствора, продемонстрировало отсутствие нарастания до опасных концентраций алюминия в крови ни у одного из 41 пациента при более эффективном по сравнению с другими ФСП снижением фосфатов при использовании гидроксида алюминия в средней дозе 900 мг/сут (14 % от пациентов под наблюдением на протяжении в среднем 17 месяцев со средней суммарной дозой гидроксида алюминия 463 г) [42]. При этом включение в систему очистки воды второго реверсивного осмоса снизило среднюю за ряд лет концентрацию алюминия в крови в среднем с 30 до 10 мкг/мл.
Известно, что более высокие уровни фосфатов (даже в пределах нормального диапазона) связаны с большей частотой сердечно-сосудистых событий и летальностью среди пациентов с ранними стадиями ХБП и даже с начальным снижением функции почек, снижая, кроме того, ренопротективный эффект иАПФ [43]. Более того, гиперфосфатемия долго не проявляется, компенсируясь ростом уровней паратгормона и все еще недостаточно раскрытого в механизмах своих эффектов фосфатурического гормона FGF-23 [7, 44]. Ясно, впрочем, что первично компенсаторный характер его повышения быстро сменяется негативными влияниями на костное ремоделирование, сердечно-сосудистую кальцификацию и в целом – на выживаемость пациентов.
В пилотном рандомизированном исследовании среди пациентов с СКФ 20-45 мл/мин оценивали эффективность севеламера, лантана карбоната и кальция ацетата, которые оказались одинаково, но умеренно эффективными в сравнении с плацебо [45], снижая уровни фосфатов с 1,35 до 1,26 ммоль/л (на 8 %), при этом мочевая экскреция фосфатов снижалась на 22 %. Применение ФСП препятствовало росту ПТГ (на 21 % в группе плацебо); при этом уровень FGF-23 снижался на терапии севеламером, не изменялся на фоне лантана карбоната и рос при использовании кальция ацетата. На этом фоне неожиданной находкой явилось прогрессирование сосудистой кальцификации, наиболее существенной при приеме ацетата кальция, но заметной и при терапии севеламером и лантаном. В целом, объединение в одной группе трех существенно разнящихся по дополнительным эффектам ФСП усложняет интерпретацию результатов исследования, и у преддиализных пациентов требуются дополнительные РКИ для подтверждения целесообразности и тактики использования ФСП [46]. Не исключено, впрочем, что эффект этот не случаен, и назначение любых ФСП увеличивает биодоступность пищевого кальция, приводя к его позитивному балансу и эктопической кальцификации [47].
Новый ФСП на основе железа, обозначаемый в исследованиях как PA-21, проходит завершающие фазы клинических испытаний, где продемонстрировал сопоставимую эффективность с классическими бескальциевыми ФСП, а в эксперименте – и способность предотвращать сосудистую кальцификацию [48].
В качестве ФСП могут использоваться никотиновая кислота и ее метаболиты. В недавнем обзоре собраны свидетельства их эффективности для пациентов как на гемо-, так и на перитонеальном диализе [49]; подчеркивается, однако, потребность в полномасштабных клинических исследованиях, чтобы определить адекватную дозу и подтвердить долговременную эффективность и безопасность.
Также важным условием коррекции гиперфосфатемии является коррекция гиперпаратиреоза, поскольку противодействовать фармакологическими/диализными технологиями массивному выходу фосфатов из кости, подвергающейся активной резорбции, потенциально опасно клинически и совершенно нерационально экономически.
В состав комплексной терапии МКН-ХБП входит широкий спектр препаратов, направленных как на коррекцию гиперфосфатемии, так и гиперпаратиреоза. Однако можно считать неоправданным недостаточное использование бескальциевых ФСП, убедительно показавших свою роль в замедлении сердечно-сосудистой кальцификации и снижении риска смерти по сравнению с препаратами кальция (по крайней мере среди диализных пациентов). Стоит также признать, что реализации полных возможностей существующих препаратов препятствуют побочные эффекты и недостаточная приверженность лечению [8,50–52].