Введение
Одной из актуальных проблем нефрологии является улучшение качества жизни и общей выживаемости больных хронической болезнью почек (ХБП), распространенность которой в мире неуклонно возрастает [1–4].
Несмотря на то что внедрение методов заместительной почечной терапии способствовало увеличению продолжительности жизни больных ХБП, появился ряд новых проблем, в т.ч. связанных с частотой нарушений нутритивного статуса (синоним белково-энергетической недостаточности – БЭН), особенно у больных на регулярном гемодиализе (ГД). Нарушения нутритивного статуса имеют важное прогностическое значение, поскольку оказывают значительное влияние на выживаемость и уровень реабилитации этих групп больных [3, 5–7]. Отмечено, что смертность больных в течение первого года диализной терапии составила 15 % среди больных с нормальным индексом массы тела – интегральным показателем оценки нутритивного статуса, и 39 % среди больных, у которых индекс массы тела менее 19 кг/м2 [2, 4, 8].
В настоящее время неинвазивными методами оценки степени нарушений нутритивного статуса, в т.ч. и у больных с наличием отеков, являются антропометрия и биоэлектрический импедансный анализ [2, 6]. Однако отсутствуют работы, в которых бы с помощью антропометрии и биоэлектрического импедансного анализа проводилась сравнительная оценка состояния нутритивного статуса у больных ХБП на додиализных стадиях ХБП и во время лечения регулярным ГД, а также изучение факторов риска развития нутритивных нарушений у этих больных.
В небольших по численности исследованиях показано, что ограничение суточной квоты белка в еде до 0,6 г/кг/сут предупреждает накопление токсических продуктов, уменьшает или отдаляет появление уремической диспепсии [9–15]. Вместе с тем результаты нескольких многоцентровых исследований, включивших множество пациентов, в т.ч. широко известного исследования MDRD (Modification of Diet in Renal Disease), не дают столь однозначного вывода [16–18]. Различие результатов объясняют сложностями в организации МБД (0,6 г/кг/сут), особенно массовой, и одновременно в обеспечении достаточной калорийности пищи (не менее 35 ккал/кг/сут) [19]. Насколько МБД может вызывать или усугублять нарушения питания, свойственные больным ХБП, остается предметом продолжающейся дискуссии в литературе. По мнению большинства авторов, состояние нутритивного статуса – один из главных факторов, определяющих выживаемость и степень реабилитации больных ХБП, находящихся на заместительной почечной терапии, а также эффективность диализного лечения [2, 3, 5].
Целью нашего исследования являлось определение диагностических возможностей традиционной антропометрии и биоэлектрического импедансного анализа для ранней диагностики нарушений нутритивного статуса у больных ХБП на додиализных стадиях и регулярном ГД, а также выявление наиболее значимых факторов их развития.
Материал и методы
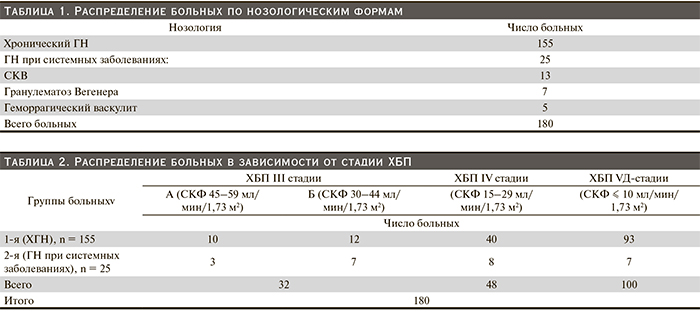
В исследование включены только 180 больных ГН, среди них 155 – хроническим ГН и 25 – ГН при системных заболеваниях: 13 системной красной волчанкой (СКВ) и 12 разными формами системного васкулита (табл. 1).
Среди 180 больных, включенных в исследование, у 80 диагностирована ХБП III–IV стадий (ХПН начальной и умеренной степени) и у 100 больных – ХБП VД стадии (ХПН тяжелая – диализная – стадия).
В зависимости от этиологии и стадии ХБП все больные, вошедшие в исследование, были рандомизированы в 2 группы (табл. 2).
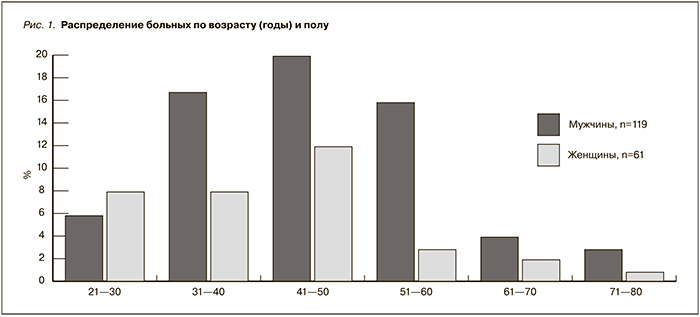
Первую группу составили 155 больных хроническим ГН, среди них 22 с ХБП III стадии (СКФ – 30–59 мл/мин/ 1,73 м2), 40 – с ХБП IV стадии (СКФ – 15–29 мл/мин/ 1,73 м2) и 93 VД стадии (СКФ ≤ 10 мл/мин/ 1,73 м2). В группу 2 включены 25 больных системными заболеваниями: 10 больных III стадией ХБП, 8 – IV стадией ХБП и 7 – VД-стадией. Для более точной оценки роли степени почечной недостаточности в развитии нутритивных нарушений больные III стадии обеих групп были разделены на 2 подгруппы: в подгруппу IIIА включили больных с СКФ 45–59 мл/мин/1,73 м2, а в IIIБ – больных с СКФ 30–44 мл/мин/1,73 м2 (табл. 2).
Возраст больных колебался от 21 до 80 (46,7 ± 10,8) лет, женщин было 61, мужчин – 119 (рис. 1). Продолжительность ХБП от начала нарушения функции почек составила 3,5–7,1 (5,2 ± 1,3) года
Диагноз ГН устанавливали по клинической картине, у 2/3 больных диагноз подтвержден морфологически при прижизненной биопсии почки.
У всех больных, вошедших в 1-ю группу, ГН был вне обострения. У 120 больных снижение СКФ и повышение уровня креатинина сочеталось с уменьшением размеров почек разной степени (сморщивание).

Системные заболевания диагностировали по критериям, принятым для каждой нозологической формы.
У больных этой группы наблюдалось рецидивирующее течение нефрита, у части больных (10 – СКВ, 2 – микроскопическим полиартериитом, 2 – гранулематозом Вегенера) в анамнезе были обострения, клинически протекающие по типу быстропрогрессирующего нефрита, для купирования которых проводилось лечение кортикостероидами, в т.ч. в больших дозах (пульс-терапия). Критерием включения больных системными заболеваниями в исследование было отсутствие в период проведения исследования признаков активности заболевания (гипокомплементемия, высокий титр антител к двуспиральной ДНК, антицитоплазматических антител – p-ANCA и c-ANCA).
Стадии ХБП определены по критериям NKF K/DOQI (2002), при этом СКФ рассчитана по формуле CKD EPI.
Помимо общеклинического обследования больных, принятого в нефрологическом отделении, для решения поставленных задач проведены специальные исследования (табл. 3).
Для определения степени нарушения нутритивного статуса у больных ХБП мы использовали 2 метода (табл. 3):
- Антропометрический метод оценки – антропометрические измерения
- Инструментальный метод оценки – определение состава тела пациента с помощью биоэлектрического импедансного анализа (монитор БИА, Компания Танита, США).
Полученные антропометрические измерения и результаты БИА дополнялись субъективной общей оценкой (расспрос, знакомство с анамнезом – выявление характерных жалоб, этиологических факторов) и лабораторными исследованиями (концентрация альбумина в плазме, абсолютное число лимфоцитов в периферической крови, уровень трансферрина в крови).
При оценке качества жизни использован опросник SF-36 (Medical Outcomes Study Survey Short Form – 36) в собственной модификации, касающийся разных аспектов состояния физического и психического здоровья пациентов.
При расчете выживаемости за конечную точку принято начало заместительной терапии.
У всех 100 больных с ХБП VД-стадии (рСКФ ≤ 10 мл/мин/1,73 м2) использован стандартный интермиттирующий low-flux-ГД или интермиттирующую гемодиафильтрацию (ГДФ) в режиме реального времени (on-line).
Статистическую обработку материала проводили по программе SPSS 12.0. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии различий и влияний) приняли равным 0,05. Для анализа качественных переменных использовали критерий χ2 Пирсона или критерий Фишера для таблиц 2 х 2. Для определения силы связи использовали двусторонний ранговый корреляционный анализ Спирмена или двусторонний корреляционный анализ Пирсона. Для выявления факторов, связанных с развитием нарушений нутритивного статуса, применяли множественный пошаговый логистический регрессионный анализ. Для определения относительного ожидаемого риска сердечно-сосудистых осложнений рассчитывали отношение шансов (OШ). Вычисления произведены с помощью программы Calculator for confidence intervals of odds ratio (David Hutchon). OШ = 1 рассматривали как отсутствие причинно-следственной связи (ассоциации), OШ > 1 – как положительную связь (повышенный риск развития осложнения), OШ < 1 – как отрицательную ассоциацию изучаемого параметра с развитием осложнений (заболевания). Кроме того, рассчитывалась величина доверительного интервала (ДИ) – интервала значений, в пределах которого с вероятностью 95 % находится ожидаемое значение изучаемого параметра, в данном случае – значение ОШ.
Результаты и обсуждение
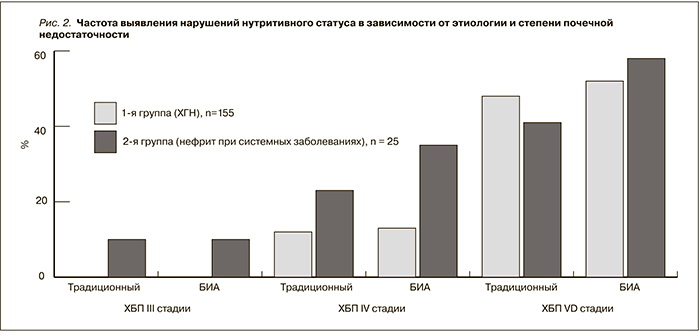
Среди всех 180 больных с III–VD стадиями ХБП БЭН выявлены у 33,9 % по данным традиционного метода и у 34,4 % с помощью монитора БИА. При этом частота нарушений нутритивного статуса зависела от степени почечной недостаточности: среди больных ХБП с уровнем СКФ 59–30 мл/мин/1,73 м2 нарушения нутритивного статуса были выявлены как по данным традиционного метода, так и с помощью БИА только у 3,1 %, в то время как среди больных ХБП с уровнем СКФ 29–15 мл/мин/1,73 м2 они диагностированы уже соответственно у 14,5 и 18,7 % больных и соответственно у 51 и у 54 % диализных больных (рис. 2).
У больных 2-й группы ХБП в рамках системных заболеваний с высокой протеинурией (> 1,5 г/сут) лечением кортикостероидами в анамнезе (> 6 месяцев до включения в исследование) нутритивные нарушения отмечались уже при умеренном снижении СКФ (44–30 мл/мин/1,73 м2). В 1-й группе они выявлены только среди больных IV стадией ХБП по данным как антропометрии, так и БИА.

Результаты скрининга позволили выявить разное количество больных с нарушениями нутритивного статуса в зависимости от используемого метода исследования: традиционного – у 59 больных (у 9 % на додиализных стадиях и у 51 % на диализе) и биоимпедансном анализе (БИА) – у 64 больных (соответственно у 10 и 64 %). При выяснении причины расхождения результатов выяснилось, что у 5 больных (все женщины), у которых при использовании традиционного метода не было выявлено нарушения нутритивного статуса, отмечены умеренные отеки туловища и конечностей, которые повлекли завышение результата антропометрических измерений и окончательное увеличение подсчета количества баллов.
Таким образом, метод БИА позволяет получать более точные результаты определения тощей и жировой массы пациентов с наличием отеков, чем традиционный метод, включивший антропометрические параметры диагностики.
Среди наблюдаемых нами больных 1-й и 2-й групп (n = 39), получавших МБД в сочетании с эссенциальными аминокислотами и их кетоаналогами (ЭАК и КА) не менее чем 12 месяцев до начала исследования, ни у одного из них не регистрировались нарушения нутритивного статуса (метод БИА). При этом среди больных (n = 10), получавших МБД, но без добавления ЭАК и КА нарушения нутритивного статуса выявлены в 1,25 % случаев, а среди больных (n = 31), не ограничивавших белок в рационе, – более чем в 11 % случаев (p < 0,05) (табл. 4).
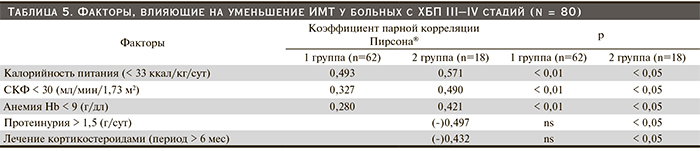
С помощью коэффициентов парной корреляции Пирсона (табл. 5) установлено влияние на уменьшение ИМТ как интегрального показателя нарушения нутритивного статуса, низкой калорийности питания (< 33 ккал/сут) [связь прямая, сильная] (рис. 3), тяжести почечной недостаточности [СКФ < 30 мл/мин/1,73 м2] (связь прямая, сильная), выраженности анемии (Hb < 9 г/дл) [связь прямая, сильная] у больных 2-й группы также высокой протеинурии (> 1,5 г/сут) [связь обратная, сильная] (рис. 4) и продолжительности кортикостероидной терапии (> 6 месяцев) [связь обратная, сильная]. Сочетание двух и более из этих факторов статистически значимо увеличивало риск развития нарушений нутритивного статуса.
Влияние низкой калорийности питания на уменьшение массы тела (на 3–5% в месяц) представлено на рис. 4. У наблюдаемых больных ХБП на додиализном этапе сохраняющаяся протеинурия (> 1,5 г/сут) увеличивала риск уменьшения массы тела (рис. 5).

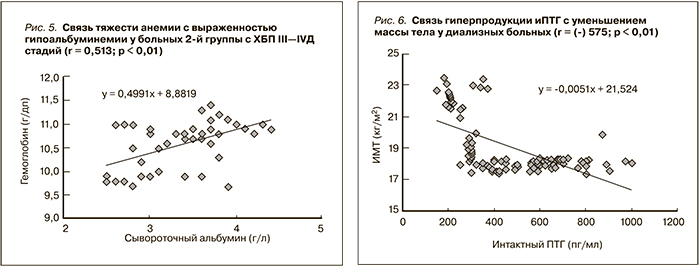
Выявлено соответствие нарушения нутритивного статуса тяжести анемии (корреляционная связь прямая, сильная) (рис. 6).
Среди больных ХБП III–IV стадий обеих групп нарушения нутритивного статуса (табл. 6) выявлены достоверно чаще среди пациентов пожилого возраста (> 65 лет) с депрессивным настроением и непереносимостью бессолевой, пресной пищи. У этих больных часто возникали бактериальные, вирусные инфекции, усугублявшие почечную недостаточность и нутритивные нарушения.
При множественном логистическом регрессионном моделировании значимо и независимо с развитием нарушений нутритивного статуса было связано только наличие низкой калорийности пищевого рациона (< 33 ккал/кг/сут) (Exp (B) = 6,2 (95 % ДИ – 2,25–16,8, р < 0,001) и СКФ < 30 (мл/мин/1,73 м2) (Exp (B) =1,07 (95 % ДИ – 1,0–1,13, р = 0,049) у больных 2-й группы также высокой протеинурии (> 1,5 г/сут) (Exp (B) = 2,05 (95 % ДИ – 1,2–2,5; р = 0,033) и лечения кортикостероидами (период > 6 месяцев) (Exp (B) = 2,01 (95 % ДИ – 1,0–2,13, р = 0,035) при коррекции модели по полу и возрасту.
Среди наблюдаемых нами больных 1-й и 2-й групп (n = 39), получавших МБД в сочетании с ЭАК и КА на преддиалином этапе не менее 12 месяцев до начала диализного лечения, в течение первого года лечения регулярным ГД достоверно реже отмечались нарушения нутритивного статуса (метод БИА), чем среди больных (n = 61), которым ЭАК и КА в додиализный период не назначались (табл. 7).
Среди больных на программном ГД обеих групп нарушения нутритивного статуса (использовался БИА + лабораторные методы) выявляли также достоверно чаще у больныхкурсив синдромом неадекватного диализа (Kt/V < 1,0; URR < 65 %), хронического воспаления (инфицированный сосудистый доступ, оппортунистические инфекции, вирусоносительство, гиперпродукция С-реактивного белка), а также при длительном использовании стандартного диализирующего раствора, содержащего уксусную кислоту (табл. 7) и развитии вторичного гиперпаратиреоза (рис. 8).

У 12 наблюдаемых нами больных диализ с использованием концентрата, содержащего уксусную кислоту, вызывал нестабильность гемодинамических показателей (интрадиализную гипотензию), тошноту, головную боль, анорексию. Замена у всех 12 больных традиционного концентрата для ГД на концентрат, в котором вместо уксусной кислоты используется соляная кислота, позволило для всех этих больных исключить интрадиализную гипотензию и улучшить переносимость процедур ГД, нормализовать аппетит.
По данным, приводимым в литературе [KDIGO, 2013], и результатам нашего исследования, повышение уровня иПТГ в крови усиливает катаболизм (быстрое падение массы тела на фоне прогрессирования метаболического ацидоза и гиперурикемии), усугубление почечной недостаточности. Нарастание концентрации иПТГ с дефицитом кальцитриола и снижением продукции клеточных рецепторов витамина D (VDR) при ХБП индуцирует формирование гломерулосклероза и тубулоинтерстициального фиброза.
Установлена обратная корреляционная связь (r = (-)619; p < 0,01) между ИМТ (кг/м2) и иПТГ (пг/мл) (рис. 7).
Нарушения нутритивного статуса выявляли также достоверно чаще у пациентов получавших лечение интермиттирующий low-flux-ГД (χ2 = 5,945, р = 0,01) по сравнению с пациентами, лечение которых проводилось интермиттирующей гемодиафильтрацией (ГДФ) (табл. 9).

С помощью ГДФ за счет высокой скорости кровотока (300–400 мл/мин) и интенсивной ультрафильтрации с гемодилюцией и автоматическим волюметрическим контролем удавалось достигать облегченного выведения избытка жидкости во время процедуры, улучшения нутритивного статуса (нормализации мышечной массы и увеличения уровня альбумина).
У больных на программном ГД с помощью регрессионной модели Сох установлено неблагоприятное влияние гипоальбуминемии на риск летальности от любой причины (сердечно-сосудистые осложнения – ССО, инфекции и. др.), госпитализаций по поводу ССО, необходимости коррекции диализного режима (для каждой конечной точки отдельно) (рис. 8, 9).
По сравнению с пациентами без гипоальбуминемии среди пациентов с наиболее тяжелой гипоальбуминемией (< 30 г/л) установлен более высокий риск летальности (ОШ – 1,3; 95 % ДИ – 0,9–1,9), частоты госпитализаций по поводу ССО (ОШ – 2,18; 95 % ДИ – 1,76–2,70) и необходимости коррекции режима диализной терапии (ОШ – 5,46; 95 % ДИ – 3,38–8,82), причем ОШ отражало изменяющиеся во времени показатели альбумина и Kt/V. Ассоциация гипоальбуминемии с изученными конечными точками становилась более тесной с утяжелением гипоальбуминемии. На основании этих результатов можно сделать вывод о том, что уровень снижения альбумина является предиктором неблагоприятного прогноза и связанных с ХБП осложнений.
Оценку качества жизни в группах больных с выявленными нарушениями нутритивного статуса проводили с помощью модифицированной нами формы SF 36. Результаты опроса больных представлены в табл. 10.
По нашим данным, распространенность депрессии и тревожности, существенно влияющих на физическую активность и социальные связи, среди больных на додиализных стадиях ХБП составляет 20%, а среди диализных больных увеличивается до 50 % (p < 0,01). При этом некоторые составляющие качества жизни, такие как общее самочувствие, утомляемость, склонность к депрессии и тревожность, усугублялись с увеличением диализного стажа.
В первой части проведенного нами исследования мы оценили возможности определения состава тела с использованием традиционного метода (включающего субъективную оценку состояния пациента, антропометрические и клинические параметры) по сравнению с методом БИА для ранней диагностики БЭН у больных ХБП на додиализных стадиях и у диализных больных.
Среди 180 больных нарушения нутритивного статуса выявлены у 3,1 % больных начальной стадией почечной недостаточности (ХБП IIIБ-стадии) без различий в частоте нарушений при сравнительной оценке традиционным методом антропометрии и биоэлектрическом импедансном анализе. Частота случаев нарушений нутритивного статуса увеличивалась прямо пропорционально нарастанию почечной недостаточности и зависела от метода диагностики (традиционная антропометрия или биоэлектрический импедансный анализ), составив у больных ХБП IV стадии соответственно 14,5 и 18,7 % и у диализных больных – 51 и 54 %.

По нашим данным, более точную информацию о соотношении тощей и жировой массы пациента дает биоэлектрический импедансный анализ по сравнению с традиционным методом определения нутритивного статуса, особенно у пациентов с наличием отеков. Метод удобен для скриниг-оценки нутритивного статуса как в популяции больных на додиализном этапе лечения ХБП, так и у диализных больных. Если антропометрические измерения занимали в среднем 40 ± 10,4 минуты, то измерение с помощью БИА – 2,5 ± 0,5.
Диагностика нутритивного статуса с помощью БИА у больных ХБП должна также включать расспрос о жалобах пациента, знакомство с анамнезом (выявление характерных жалоб, этиологических факторов), определение показателей синтеза висцеральных белков (содержание в плазме крови альбумина, трансферрина и количества лимфоцитов в периферической крови).
Во второй части исследования мы оценили влияние общих для ХБП факторов риска (малобелковая диета, высокая протеинурия, продолжительность кортикостероидной терапии, депрессия) и связанные с уремией (вторичный гиперпаратиреоз, анемия, лечение программным гемодиализом) на возникновение или прогрессирование нутритивных нарушений. Установлено повышение роли факторов уремии в нарастании их частоты и тяжести при прогрессировании ХБП к VД-стадии.
Проведенное исследование показало, что более частую БЭН у диализных больных по сравнению с додиализным периодом вызывают большая выраженность депрессии, анорексии, дополнительное усиление катаболизма на регулярном ГД, а также влияние неэффективного режима диализа (синдром недодиализа). Использование МБД с добавлением ЭАК и КА позволяет проводить рациональное сбалансированное питание больных на додиализном этапе ХБП, предупреждающее развитие нарушений нутритивного статуса. У больных ХБП III–VД-стадий гипоальбуминемия тесно связана с увеличением сопутствующих заболеваний (инфекции), госпитализаций и риска летальности. С помощью коэффициентов парной корреляции Пирсона выявлена обратная корреляция между уровнем в сыворотке крови острофазового С-реактивного белка и альбумина.
Синдром хронического воспаления (англ. Systemic Inflamation Response Syndrome – SIRS), диагностированный у 18,8 % больных БЭН, был обусловлен влиянием инфицированного диализного сосудистого доступа и оппортунистическими инфекциями (пневмония, мочевая инфекция и др.). Важную роль в индукции хронического воспаления и развитии нарушений нутритивного статуса играли также сопутствующие сердечно-сосудистые заболевания (ИБС, КМП), гиперволемическая гипергидратация, синдром непереносимости ацетата, тяжелая анемия.
Результаты нашего исследования позволяют расширить представления об эпидемиологии нутритивных нарушений у больных ХБП III–VД-стадий, выявить конкретные факторы, способствующие развитию и прогрессированию ХБП и БЭН в данной популяции. Среди больных ХБП в рамках системных заболеваний нутритивные нарушения отмечались уже при умеренном снижении СКФ (44–30 мл/мин/1,73 м2), в то время как среди больных хроническим ГН они выявлялись при более выраженном падении СКФ (< 29 мл/мин/1,75 м2). У всех больных ХБП в период включения в исследование отсутствовали признаки активности заболевания. Однако у подавляющего числа больных системными заболеваниями (СКВ, системные васкулиты), несмотря на развитие ХБП, сохранялась высокая протеинурия (> 1,5 г/сут) и у всех из них в анамнезе были обострения заболевания, во время которых пациенты длительно (> 6 месяцев) получали кортикостероиды, в т.ч. в сверхвысоких дозах. У больных ХБП в рамках системных заболеваний выявлена связь между быстрым снижением массы тела и высокой протеинурией (связь обратная, сильная) и продолжительностью лечения кортикостероидами (связь прямая, сильная). Однако, по-видимому, роль протеинурии в развитии нарушений нутритивного статуса не ограничивалась только потерей белка с мочой. Получены данные о том, что протеинурия, превышающая 1 г/л, индуцируя продукцию канальцевым эпителием провоспалительных цтокинов (ФНО-α, ИЛ-8) и факторов роста (трансформирующий фактор роста-β), хемокинов (моноцитарный хемоаттрактантный протеин-1, RANTES) и свободные радикалы кислорода, приводит к апоптозу канальцевого эпителия с ускоренным формированием тубулоинтерстициального фиброза и прогрессированием почечной недостаточности с высоким риском развития или усугубления нарушений нутритивного статуса [2, 3]. Однако оценка роли протеинурии как ведущего фактора прогрессирования ХБП (протеинурическое ремоделирование тубулоинтерстиция) не входило в задачи нашего исследования.
Результаты нашего исследования и анализ данных литературы позволили нам определить принципы ранней диагностики нарушений БЭН у наблюдаемых больных ХБП III–VД стадий (рис. 10).
Скринингу нарушений нутритивного статуса уже на IIIБ-стадии подлежат все пациенты с ХБП, получающие малобелковую диету (0,6 г белка/кг/сут) при недостаточной энергетической ценности пищи, высокой протеинурии (> 1,5 г/сут), продолжительном (> 6 месяцев) лечении кортикостероидами.
Скрининг белково-энергетической недостаточности следует проводить на додиализном этапе всем лицам с ХБП с жалобами, позволяющими заподозрить наличие нарушений нутритивного статуса:
- прогрессирующей потерей массы тела;
- депрессией;
- усугублением артериальной гипертензии, не объяснимым другими причинами;
- развитием тяжелой анемии не соответствующей степени почечной недостаточности (уменьшение эритропоэза может быть обусловлено снижением синтеза белка).
Комплексная оценка нутритивного статуса больных ХБП может проводиться с использованием БИА. При этом следует анализировать ИМТ, динамику «сухого веса», объема безжировой и мышечной массы тела, желудочно-кишечные симптомы, диализное время, лабораторные данные (альбумин и трансферин крови), частоту госпитализаций и риск летальности на ГД.



