Введение
Распространенность хронической сердечной недостаточности (ХСН) продолжает неуклонно возрастать [1]. Общепризнанно, что прогноз больных ХСН особенно ухудшается при развитии
почечной дисфункции [2, 3]. Вовлечение почек можно рассматривать как важнейшую детерминанту прогрессирования ХСН, и, таким образом, оправданны представления о значении сохранения почечной функции как важной составляющей вторичной профилактики ХСН [1]. Сегодня хорошо известно, что многие факторы, ассоциирующиеся с развитием хронической болезни почек (ХБП), одновременно являются и сердечно-сосудистыми факторами риска (ФР) [4, 5]. Многие сердечно-сосудистые факторы риска (анемия, хроническое воспаление, оксидативный стресс, гиперурикемия и др.) особенно сильно связаны именно с прогрессирующей почечной дисфункцией [5]. В связи с этим актуальной проблемой является первичная профилактика ХБП у лиц, страдающих сердечно-сосудистыми заболеваниями [6]. В литературе представлены пока единичные и неоднозначные сведения о распространенности ФР ХБП у больных с ХСН [5–7], оценка которой явилась целью нашего исследования.
Материал и методы
Обследованы 167 пациентов, страдающих ХСН, из них 21 мужчина и 146 женщин (средний возраст составил 60,9 ± 11,4 года). Распределение больных по этиологии ХСН: ишемическая болезнь сердца (ИБС) + артериальная гипертензия (АГ) – 113 (67,7 %) больных, ИБС – 12 (7,2 %), АГ – 35 (20,9 %), ревматические пороки сердца вне активности ревматической лихорадки – 6 (3,6 %), идиопатическая дилатационная кардиомиопатия – 1 (0,6 %) больной. Пациенты с заболеваниями почек и/или
эндокринной системы в исследование не включались. Все обследуемые были разделены на группы в зависимости от ФК ХСН соответственно классификации NYHA. Первую группу (44 человека) составили больные с I ФК ХСН (средний возраст – 52,5 ± 12,3 года), 62 больных имели II ФК ХСН (2-я группа,
средний возраст – 59,5 ± 9,9 года), 61 больной – III–IV ФК ХСН (3-я группа, средний возраст – 66,1 ± 10,4 года). Группу контроля составили 20 практически здоровых лиц (средний возраст – 60,1 ± 1,3 года). Все исследования проведены с информированного письменного согласия больных.
Комплексное обследование включило сбор анамнеза, биохимические, общеклинические методы. Учитывали возраст, пол больных, наличие сопутствующих заболеваний. Производили расчет индекса массы тела (ИМТ). В зависимости от значения ИМТ определяли питательный статус: нормальный ИМТ –
20,0–24,9 кг/м², избыточная масса тела (предожирение) – 25,0–29,9 кг/м², ожирение – 30,0 кг/м² и выше, пониженное питание – ниже 19,9 кг/м² [8]. Определяли суммарный уровень холестерина, холестерина липопротеидов высокой плотности (ЛПВП) и триглицеридов (ТГ) с последующим расчетом
содержания холестерина во фракции липопротеидов низкой плотности (ЛПНП). Исследовали концентрацию мочевой кислоты (МК) и креатинина в сыворотке крови. Пациентам проводилось измерение артериального давления (АД) с подсчетом среднего гемодинамического АД. Определяли число сердечных сокращений (ЧСС) в покое. Скорость клубочковой фильтрации (СКФ) определяли по формуле Кокрофта–Голта [5].
Таблица 1. Факторы риска дисфункции почек у больных с ХСН.
Статистическая обработка полученных данных проведена с использованием компьютерной программы “Statistica for Windows 6.0”. Достоверными считали различия при p < 0,05. Данные представлены в виде M ± m, где M – среднее значение величины, m – ее стандартная ошибка.
Результаты и обсуждение
У обследованных пациентов установлено усугубление ФК ХСН с увеличением возраста (табл. 1), при этом различие с показателем группы контроля оказалось достоверным в группе больных ХСН III–IV ФК (p < 0,01). Как видно из табл. 2, число пациентов старше 60 лет также увеличивалось по мере нарастания ФК ХСН. Были выявлены достоверные различия между показателями больных I ФК с больными II, III–IV ФК (p < 0,05 и p < 0,01 соответственно). Средняя СКФ у больных с ХСН в возрасте до 60 лет составила 79,5 ± 25,4 мл/мин, у больных старше 60 лет – 61,1 ± 22,6 мл/мин (p < 0,01). Средний
возраст больных с СКФ менее 60 мл/мин составил 66,1 ± 8,1, с СКФ более 60 мл/мин – 58,7 ± 10,1 года (p < 0,01). Обнаружена прямая корреляция между возрастом и ФК ХСН (r = 0,43; p < 0,001) по группе ХСН в целом, возрастом и креатининемией (r = 0,17; p < 0,05) и обратная корреляция между возрастом и СКФ (r = -0,46; p < 0,001).
Из всех больных с ХСН 72,6 ± 5,7 % имели ИМТ ≥ 25,0 кг/м² (повышенный ИМТ), из них лица с ожирением составили 75,6 ± 6,4 %; 3,2 ± 2,2 % больных имели сниженный ИМТ. Достоверных различий между группами с различными ФК по числу пациентов с повышенным ИМТ выявлено не было, выявлена только тенденция к достоверности между показателями групп II и III–IV ФК по числу больных с ожирением (p = 0,06; табл. 2). Из обследованных с III–IV ФК 11,7 ± 7,8 % больных имели сниженный ИМТ, при I, II ФК такие пациенты отсутствовали; более того, при ХСН I, II ФК выявлено достоверное повышение ИМТ по сравнению с группой контроля (p < 0,01 и p < 0,001 соответственно; табл. 1). Обращает на себя внимание тот факт, что средняя СКФ у больных с повышенной массой тела составляла 75,4 ± 30,3 мл/мин, с нормальной – 57,5 ± 18,9 и 37,6 ± 4,1 мл/мин у больных с пониженным
питанием. Различия по СКФ между группами больных с повышенной и нормальной массой тела, повышенной массой тела и пониженным питанием достоверны. СКФ менее 60 мл/мин обнаружена у 29,3 ± 7,1 % больных с повышенной массой тела, у 55,6 ± 12,8 % с нормальной массой тела и у 75 ± 30,6 % больных с пониженным питанием. Различие достоверно между группами больных с повышенной массой тела и пониженным питанием (p < 0,05), тенденция к достоверности выявлена между группами больных с повышенной и нормальной массой тела (p = 0,057). Среднее значение ИМТ у пациентов с СКФ более 90 мл/мин составляет 33,4 ± 7,6 кг/м², с СКФ от 60–89 мл/мин – 32,9 ± 5,1 кг/м² и 27,3 ± 4,8 кг/м² при СКФ менее 60 мл/мин. Различия достоверны между СКФ более 90 мл/мин, 60–89 мл/мин и с СКФ менее 60 мл/мин (p < 0,01). Имеется прямая корреляционная зависимость между ИМТ и СКФ
(r = 0,5; p < 0,001).
Уровень общего холестерина (ХС) в крови оказался повышенным у 61,3 ± 6,2 % больных ХСН по группе в целом, средняя гиперхолестеринемия (ГХС) составила 5,7 ± 1,7 ммоль/л. Наибольшее число больных с ГХС наблюдается при II ФК, по мере усугубления тяжести ФК число больных с ГХС достоверно снижается (p < 0,05; табл. 2). Достоверное повышение уровня ЛПНП отмечено начиная с ХСН I ФК, снижение уровня ЛПВП – у больных II, III–IV ФК. Гипертриглицеридемия определяется у больных II ФК (p < 0,05; табл. 1). Средняя СКФ у больных с ГХС составила 68,8 ± 19,9 мл/мин и 64,1 ± 20,8 мл/мин – у больных с нормальным уровнем ХС в крови (p > 0,05). Вместе с тем из числа лиц с ГХС СКФ менее 60 мл/
мин выявлена в 48,2 ± 9,6 % случаев, против 38,1 ± 10,6 % среди лиц с нормальным уровнем ХС в крови (p > 0,05). Определяется слабая положительная корреляция между ЛПНП и уровнем сывороточного креатинина (r = 0,60; p = 0,037).
Таблица 2. Распространенность факторов риска ХБП среди больных с ХСН.
Уровень МК в крови был повышен у 17 ± 5,5 % обследованных больных ХСН в целом, при этом у всех больных отсутствовал подагрический анамнез. Достоверных различий по числу больных с гиперурикемией между ФК выявлено не было (p > 0,05). Уровень МК в крови у пациентов с II ФК достоверно превышал таковой в контрольной группе (p < 0,05; табл. 1). Концентрация МК в крови коррелировала с общим ХС, ТГ и ИМТ (r = 0,33, p = 0,041; r = 0,60, p = 0,002; r = 0,56, p = 0,003 соответственно). Средняя СКФ у больных с гиперурикемией составляла 73,8 ± 26,8 мл/мин, 65,4 ± 20,7 мл/мин – у больных с нормальным уровнем МК в крови (p > 0,05). У 20 ± 7,9% больных с гиперурикемией СКФ составляла менее 60 мл/мин, у больных с нормальным уровнем МК – 40,9 ± 10,5 % (p > 0,05).
Распространенность АГ среди больных с ХСН составила 74,1 ± 5,9 %. Уменьшение числа больных с АГ происходит при III–IV ФК (различие достоверно между II и III–IV ФК, p < 0,05; табл. 2). Выявлены достоверные различия между показателями больных I, II ФК и III–IV ФК по среднему систолическому давлению (САД), а также среднему диастолическому артериальному давлению (ДАД); p < 0,05. Достоверные различия определяются между показателями в контрольной группе и у больных с I, II ФК по САД (p < 0,01 и p < 0,001 соответственно) и ДАД (p < 0,01; табл. 1). Среднее гемодинамическое АД у больных ХСН I ФК составило 122,0 ± 21,2 мм рт. ст., у больных ХСН II ФК – 121,7 ± 21,8 мм рт. ст., 106,0 ± 18,6 мм рт. ст. у больных III–IV ФК и 98,3 ± 6,8 мм рт. ст. у лиц контрольной группы. Выявлены достоверные различия между показателями в контрольной группе и у больных ХСН I, II ФК (p < 0,01). Средняя СКФ у больных АГ составляла 69,5 ± 18,5 мл/мин (число пациентов со СКФ менее 60 мл/
мин – 33 ± 12,2 %), тогда как у больных с нормальным АД – 48,2±14,6 мл/мин (число пациентов с СКФ менее 60 мл/мин – 75 ± 21,7 %). Различие между группами достоверно (p < 0,05). Обнаружена положительная корреляция между ДАД и СКФ (r = 0,5; p = 0,03), а также между значениями среднего гемодинамического АД и уровнем сывороточного креатинина (r = 0,82; p = 0,046).
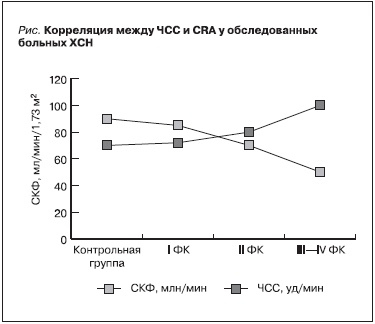
По мере увеличения ФК ХСН происходит нарастание ЧСС покоя, выявлены достоверные различия между показателями группы контроля и больных ХСН III–IV ФК (p < 0,001; табл. 3), а также между I, II ФК и III–IV ФК ХСН (p < 0,01 и p < 0,05 соответственно). Обнаружена обратная корреляционная зависимость между ЧСС и СКФ (r = -0,58; p < 0,01; см. рисунок), а также тенденция к достоверности между ЧСС и уровнем креатинина (r = 0,3; p = 0,09).
Общепризнанно, что одним из ведущих ФР ХБП является пожилой возраст, что связано как с возрастными инволютивными изменениями почечной ткани, способствующими постепенному снижению ее функции, так и с тем, что у лиц старше 60 лет чаще наблюдают поздние стадии различных
хронических нефропатий [9]. У больных ХСН с увеличением возраста пациентов происходит нарастание ФК. У пациентов старше 60 лет наблюдаются достоверно более низкие значения СКФ, а также более высокие уровни креатинина сыворотки.
В последние годы установлено, что ожирение является независимым ФР, предсказывающим развитие терминальной почечной недостаточности в общей популяции [6, 9–11]. При ожирении развивается специфическая нефропатия – особая форма фокально-сегментарного гломерулосклероза [6], в
патогенезе которой решающее значение имеют медиаторы, продуцируемые адипоцитами, например лептин, α-фактор некроза опухоли [9]. При нарастании ФК ХСН уменьшается число пациентов с нормальным ИМТ: 42,9 ± 18,7 %; 23,7 ± 6,9 %; 17,7 ± 9,3 % (I, II, III–IV ФК соответственно). Так, с I
ФК по II ФК увеличивается число пациентов с избыточной массой тела и ожирением, далее при усугублении ФК ХСН (III–IV ФК) уменьшается число пациентов с ожирением, появляются пациенты со сниженным ИМТ. Полученные данные свидетельствуют о неблагоприятном влиянии на функцию почек не только повышенного, но и сниженного ИМТ у пациентов с ХСН.
Таблица 3. Частота сердечных сокращений у обследованных больных ХСН.
Дислипопротеидемия также связана с большей частотой выявления ХБП в общей популяции населения [6]. Первоочередной мишенью избытка атерогенных фракций ХС являются эндотелий почечных клубочков, а также мезангиоциты и эпителиоциты проксимальных канальцев. Дислипидемия способствует атеросклеротическому поражению почечных сосудов и непосредственно почечной ткани с формированием т. н. липопротеидовой гломерулопатии [9]. С I по II ФК происходит увеличение как числа больных с ГХС, так и средних значений ГХС. У больных с III–IV ФК отмечается уменьшение числа больных с ГХС и средних значений ОХС, что можно объяснить снижением синтеза ХС в печени [8]. Таким образом, дислипопротеидемия наблюдается у больных ХСН начиная с I ФК. В последней группе установлено увеличение уровня ЛПНП и общего ХС. По мере прогрессирования ФК ХСН (III–IV ФК) происходит снижение общего ХС в крови до нормохолестеринемии, но снижается уровень ЛПВП и
продолжает нарастать уровень ЛПНП. У больных с ГХС чаще выявлялась СКФ менее 60 мл/мин. Кроме того, повышение уровня ЛПНП сопровождалось повышением уровня сывороточного креатинина.
Роль АГ как одного из важнейших ФР развития и прогрессирования ХБП общеизвестна [5]. Формирование патологии почек при АГ подразумевает нарастающий глобальный нефросклероз с вовлечением как структур клубочка, так и тубулоинтерстиция, дополняемый дезадаптивной перестройкой внутрипочечного сосудистого русла [9]. У больных ХСН III–IV ФК происходит снижение средних значений САД и ДАД, а также показателей среднего гемодинамического АД. Согласно нашим данным, по мере снижения СКФ происходит уменьшение числа пациентов с АГ, высокое среднее АД сочетается с более высоким уровнем сывороточного креатинина, а низкое ДАД коррелирует со снижением СКФ.
Гиперурикемия рассматривается как один из наиболее распространенных в популяции факторов риска ХБП [9]. Основная мишень для повреждающего действия мочевой кислоты и ее солей – структура почечного тубулоинтерстиция. В индукции процессов воспаления и фиброза тубулоинтерстиция при уратном дисметаболизме существенное значение имеют депрессия локально-почечных механизмов фибринолиза, увеличение экспрессии ренина юкстагломерулярными клетками под действием мочевой кислоты, сопровождающееся активацией ренин-ангиотензин-альдостероновой системы [7]. Исследования МК в крови показали ее максимальное повышение у пациентов с ХСН II ФК, а по мере усугубления тяжести ФК уровень МК в крови снижался. У больных ХСН при наличии гиперурикемии отмечаются более высокие уровни СКФ, хотя достоверных различий выявлено не было. Обнаружена прямая связь между уровнем МК и нарушениями липидного обмена, ожирением.
Повышенная ЧСС как показатель симпатической гиперактивности рассматривается в качестве предиктора сердечно-сосудистой и общей смертности, а также и ФР прогрессирования ХБП [12–15]. В исследовании установлена обратная достоверная корреляция между ЧСС и СКФ, ЧСС покоя нарастает с усугублением тяжести ФК ХСН.
Таким образом, у больных ХСН почечная дисфункция “тесно” сопровождается группой известных ФР ХБП: ГХС, повышением уровня ЛПНП, снижением ЛПВП и ожирением. Однако по мере усугубления ФК ХСН и рельефности почечных нарушений достоверно нарастает число больных с низким ИМТ. Почечная дисфункция при ХСН коррелирует с возрастом, показателями ЧСС и АД. У больных ХСН выявлена прямая корреляция между уровнем МК и дислипидемией, ожирением.



