Кардиоренальные синдромы (КРС) - это патологические взаимообусловленные состояния с вовлечением сердца и почек, развивающиеся вследствие острой или хронической дисфункции одного из органов с последующей острой или хронической дисфункцией другого. КРС включают острые и хронические расстройства, при которых первично пораженным органом может быть как сердце, так и почка [1].
Даже незначительное нарушение функции почек (как острое, так и длительно существующее) ассоциируется с увеличением общей и сердечно-сосудистой смертности. Установлено, что у больных острой декомпенсацией хронической сердечной недостаточности (ОДХСН) развитие острого почечного повреждения (ОПП) ассоциируется с более продолжительной госпитализацией и большей частотой повторных госпитализаций по поводу ХСН, прогрессированием хронической болезни почек (ХБП) до 4-5-й стадий, повышением риска сердечно-сосудистой и общей смертности [2]. Смертность пациентов с ОДХСН обратно пропорциональна скорости клубочковой фильтрации (СКФ). Более тяжелое ОПП отмечается у пациентов с острой сердечной недостаточностью (ОСН) со сниженной фракцией выброса (ФВ) по сравнению с пациентами с ОСН, но сохранной ФВ. При этом исходная СКФ является более сильным, чем ФВ, предиктором [2]. Риск негативных исходов увеличивается независимо от транзиторности или устойчивости ОПП [3]. Даже незначительное нарастание уровня креатинина - на 0,3 мг/дл (26,5 мкмоль/л) - ассоциируется с повышением смертности [4].
ПАТОГЕНЕЗ КАРДИОРЕНАЛЬНОГО СИНДРОМА 1-ГО ТИПА (КРС1)
КРС1, или острый КРС, характеризуется быстрым внезапным ухудшением сердечной деятельности, приводящим к ОПП (рис. 1).
Рисунок 1.Кардиоренальный синдром 1-го типа.
Механизмы развития ОПП при остром ухудшении сердечной деятельности многообразны и сложны. Внезапное снижение функции почек, вероятно, не только является маркером тяжести заболевания, но и ухудшает течение сердечно-сосудистых заболеваний, приводя к повышению частоты сердечно-сосудистых осложнений, возможно вследствие активации воспалительных путей. Низкий сердечный выброс и/или значимое повышение венозного давления, обусловливая застой в почках, также может быть причиной развития ОПП. Не исключается роль феномена нарушения действия диуретиков и постдиуретической задержки натрия. Ухудшение функции почек может быть обусловлено и назначением высоких доз диуретиков. Также не исключается влияние спектра лекарственных препаратов, в первую очередь нестероидных противовоспалительных средств, антибиотиков, ингибиторов ангиотензин превращающего фермента и т. д. [5].
Распространенность КРС1при ОДХСН составляет 24-45 %. КРС1 обычно развивается в начальные сроки госпитализации: в 50 % случаев - в первые 4 дня [6], в 70-90 % - в первую неделю [6, 7]. Такие пациенты в анамнезе часто имеют хронические нарушения функции почек, предрасполагающие к развитию ОПП [8, 9]. Предикторы развития КРС1 при ОДХСН: артериальная гипертония (АГ), сахарный диабет (СД), атеросклероз, пожилой возраст, анамнез ХСН, ХБП в анамнезе [10].
Стратификация пациентов по риску развития ОПП (рис. 2). Важно как можно раньше идентифицировать популяцию пациентов с высоким риском ухудшения функции почек. На основании изучения факторов риска для 1004 пациентов, госпитализированных с первичным диагнозом “сердечная недостаточность”, Forman и соавт. были выделены следующие предикторы ухудшения функции почек: анамнез ХСН, СД, уровень САД > 160 мм рт. ст. при поступлении, уровень креатинина ≥132 мкмоль/л [11]. Определены дополнительные факторы риска: отек легких или влажные незвучные хрипы при поступлении; тахикардия; женский пол; фибрилляция предсердий; заболевания периферических артерий [6, 7]. Оценка риска ухудшения функции почек при госпитализации пациентов с ОДХСН с использованием шкалы Forman позволит своевременно идентифицировать пациентов с высоким риском ОПП и своевременно применить профилактические и терапевтические стратегии [5].
Рисунок 2.Стратификация пациентов по риску развития ОПП: ХСН - хроническая сердечная недостаточность; САД - систолическое артериальное давление; ОР - относительный риск.
ДИАГНОСТИКА КРС1
Ранняя диагностика КРС1 затруднена в связи с “запаздыванием” клинических проявлений (повышение уровня креатинина сыворотки и симптомы наблюдаются уже на фоне развившегося ОПП), что, с одной стороны, препятствует своевременному лечению и ухудшает прогноз, с другой - способствует активному изучению, поиску и внедрению в широкую клиническую практику лабораторных и инструментальных методов для более раннего выявления ОПП.
Концептуальная модель ОПП демонстрирует стадийность и прогрессирование от факторов риска через структурное и функциональное повреждение к почечной недостаточности (рис. 3) [5]. Цель создания концептуальной модели - определение профилактических и терапевтических стратегий на каждой из стадий с учетом имеющихся диагностических критериев. Двунаправленные стрелки демонстрируют возможность обратного развития состояния при своевременном вмешательстве на данной стадии.
Рисунок 3. Концептуальная модель ООП. N - норма. СКФ - скорость клубочковой фильтрации. ПН - почечная недостаточность. NGAL - ассоциированный с нейтрофильной желатиназой липокалин. IL-18 - интерлейкин-18. L-FABP - белок, связывающийся с жирными кислотами печени. KIM-1 - молекула почечного повреждения.
Биомаркеры. В настоящее время широко обсуждается область применения биомаркеров в медицине, в частности при КРС1. При остром КРС возможно использование биомаркеров для диагностики как первичного (ОСН и ОДХСН), так и вторичного (ОПП) события. Признанными маркерами ОСН и ОДХСН, а также независимыми предикторами сердечно-сосудистых осложнений и смертности от любой причины как в общей популяции, так и среди пациентов с почечной недостаточностью являются натрийуретические пептиды (мозгового натрийуретического пептида (BNP) и NT-концевого фрагмента предшественника BNP (NT-proBNP)). К наиболее значимым маркерам ОПП относят ассоциированный с нейтрофильной желатиназой липокалин (NGAL), интерлейкин-18 (IL-18), молекула- почечного повреждения (KIM-1) и цистатин С. При этом наибольшей диагностической точностью в отношении ранней диагностики ОПП обладают определение уровня цистатина С в сыворотке крови, NGAL и IL-18 в моче. Для дифференциальной диагностики уже развившегося ОПП и определения риска смерти после ОПП целесообразно определение уровня IL-18 и KIM-1 в моче [5].
Инструментальные методы. Перегрузка объемом рассматривается в настоящее время в качестве главного предиктора заболеваемости, смертности и повторных госпитализаций по поводу ХСН [14]. Актуален поиск неинвазивных визуализирующих методов подтверждения перегрузки объемом [12]. Биоимпедансный векторный анализ (БИВА) является быстрым, точным, неинвазивным методом оценки статуса гидратации у пациентов с сердечной недостаточностью, который коррелирует с функциональным классом ХСН и обладает высокой диагностической точностью в отношении дифференциальной диагностики одышки, обусловленной ХСН (рис. 4) [13].
Рисунок 4. Оценка статуса гидратации с использованием БИВА.
Развитие ОДХСН требует назначения высоких доз петлевых диуретиков, при этом выраженность системного застоя снижается ценой гипоперфузии почек и развитием ОПП [14]. Таким образом, при ОДХСН необходимо тщательное мониторирование статуса гидратации пациентов для определения стратегии диуретической терапии с целью снижения частоты развития КРС1, а следовательно, смертности и повторных госпитализаций по поводу ХСН в данной популяции пациентов.
Наиболее перспективным представляется совместное использование биомаркеров (в особенности натрийуретических пептидов и NGAL) и инструментальных методов (БИВА), что позволит более точно оценить степень гидратации и своевременно прекратить воздействие повреждающего фактора (неадекватная диуретическая терапия/ультрафильтрация).
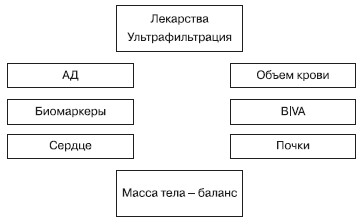
Потенциальное значение совместного применения биомаркеров и БИВА в ведении пациентов с ОДХСН послужило основанием для формирования стратегии 5В управления водным балансом, включающей контроль артериального давления (Blood pressure), объема крови (Blood volume), оценку уровня биомаркеров (Biomarkers), проведение БИВА (BIVA), контроль массы тела (Body weight-Balance) (рис. 5) [15].
Рисунок 5.Управление водным балансом: стратегия “5В”.
Приводится клиническое наблюдение развития острого КРС у больного ОДХСН.
Клинический случай. Пациент Н. 66 лет, бухгалтер, курильщик (индекс пачка-лет = 30, индекс курящего человека = 360) с длительным анамнезом АГ, перенесенным инфарктом миокарда (2010), СД 2 типа; госпитализирован экстренно с клиническими проявлениями ОДХСН на фоне бронхо-легочной инфекции (рис. 6).
Рисунок 6.Схема истории болезни.
При поступлении предъявил жалобы на повышение температуры тела до 38 0С, кашель с отделением мокроты серо-желтого цвета, одышку в покое, отеки нижних конечностей, слабость.
В анамнезе: с 1980 г. систоло-диастолическая АГ (максимальные цифры - 200/100, обычно - 150/90 мм рт. ст.). В январе 2010 г. - дебют ИБС с инфаркта миокарда без предшествующей стенокардии. С марта 2010 г. - клиника ХСН (одышка при незначительной физической нагрузке, отеки нижних конечностей, выраженная слабость, утомляемость). В 2000 г. диагностирован СД 2 типа (диету соблюдает, уровень гликемии контролирует регулярно, эпизоды гипогликемии отрицает). По данным предоставленной медицинской документации, у пациента ХБП 3-й стадии (СКФ - 45-50 мл/мин/1,73 м2 на протяжении не менее 3 предшествовавших госпитализации месяцев). С марта 2010 г. регулярная медикаментозная терапия: эналаприл 10 мг/сут, бисопролол 7,5 мг/сут, фуросемид 40 мг/сут, аспирин 100 мг/сут, спиронолактон 25 мг/сут, гликлазид 60 мг/сут.
Настоящее ухудшение с 25.09.2011, когда после переохлаждения отметил повышение температуры тела до субфебрильных цифр и кашель с отделением мокроты серо-желтого цвета. На фоне вышеуказанных жалоб - нарастание слабости, появление одышки в покое. 29.09.2011 - лихорадка до фебрильных цифр. Госпитализирован экстренно.
При физическом исследовании: абдоминальное ожирение (окружность талии - 123 см), выраженные проявления синдрома недостаточности кровообращения по обоим кругам (кожные покровы влажные, холодные, акроцианоз, ортопноэ, ЧДД 24/мин, набухшие шейные вены, влажные незвучные мелкопузырчатые хрипы в нижних отделах легких, ослабление дыхания в нижних отделах с обеих сторон, III тон, гепатомегалия (15/3 х 12/2 х 10 см по Курлову), отеки стоп, голеней, передней брюшной стенки); ЧСС 70/мин, АД 110/74 мм рт. ст., SaO2 96%.
Выявлен лабораторный воспалительный синдром (лейкоциты 12,3 х 109/л, СОЭ 44 мм/ч, СРБ 7,8 мг/дл), нарушение азотвыде- лительной функции почек (креатинин 141 мкмоль/л, мочевина 9,6 ммоль/л, СКФ 44 мл/мин/1,73 м2, повышение уровня BNP (784,5 пг/мл); протеинурия (0,5 г/л). Выявлены рентгенологические признаки застоя по малому кругу кровообращения и инфильтративные изменения легочной ткани, ЭКГ-признаки гипертрофии левого желудочка (индекс Соколова-Лайона 38 мм, Корнельский вольтажный индекс 36 мм), эхо-признаки эксцентрической гипертрофии левого желудочка с диастолической дисфункцией I типа и нарушения локальной сократимости (акинез верхушки, базально-боковых, среднебоковых, верхнебоковых сегментов левого желудочка), снижение фракции выброса до 32%.
По данным БИВА, у пациента определена тяжелая степень гипергидратации: смещение точки импеданса Z за 95-й центиль, низкие значения активного сопротивления R (356,7 Ом) и реактивного сопротивления Xc (28,1 Ом).
С учетом наличия рентгенологически подтвержденной инфильтрации в нижних отделах легких с двух сторон и трех клинических признаков (кашель с мокротой; фебрильная лихорадка; лейкоцитоз > 10 x 109/л) диагноз пневмонии определенный. Сумма баллов по шкале PORT - 80, что соответствует III классу риска, пневмония среднетяжелого течения.
Терапия в стационаре: эналаприл 10 мг/сут, бисопролол 5 мг/сут, верошпирон 25 мг/сут, фуросемид 100 мг/сут внутривенно струйно, нитроглицерин через шприцевой дозатор со скоростью 1,0 мл/ч под контролем АД; антитромботическая терапия (аспирин 100 мг/сут, гепарин 15000 МЕ/сут подкожно), сахароснижающая терапия (гликлазид 60 мг/сут), антибактериальная терапия (цефтриаксон 2,0 г внутривенно струйно).
Состояние контролировали на основании динамики массы тела, клинических параметров (количество хрипов, диурез, выраженность одышки по шкале Borg), лабораторных показателей, параметров БИВА.
На фоне проведенной терапии наблюдались некоторая положительная динамика отечного синдрома (уменьшение веса от 97,4 до 96,0 кг, отеков), что подтверждалось данными БИВА (смещение точки импеданса Z между 95-м и 75-м центилем, нарастание активного сопротивления R (от 356,7 до 376,2 Ом) и реактивного сопротивления Xc (от 28,1 до 29,5 Ом); уменьшение кашля и количества мокроты, нормализация температуры тела. На 3-й день пребывания в стационаре ухудшение самочувствия: нарастание слабости, снижение АД до 100/64 мм рт. ст., усиление перегрузки объемом по данным БИВА (смещение точки импеданса Z за 95-й центиль, снижение активного R [от 376,2 до 355,3 Ом] и реактивного Xc [от 29,5 до 28,4 Ом] сопротивлений, сопровождавшееся отрицательным диурезом и отсутствием динамики веса. Пациент не соблюдал рекомендаций врача по ограничению употребления соли. Выявлено нарастание уровня креатинина сыворотки в 1,7 раза и снижение СКФ на 45 % от исходного в течение 48 часов, что соответствует критериям ОПП, I стадии RIFLE и AKIN [16, 17]. С учетом этих изменений и тенденции к гипотонии отменены пероральные препараты, увеличена доза фуросемида до 200 мг/сут с переходом на инфузионное введение, начата инотропная поддержка допамином в почечной дозе 2 мкг/ кг/мин; пероральные сахароснижающие препараты заменены введением короткодействующего инсулина.
На фоне изменений терапии наблюдалась отчетливая положительная динамика: отечного синдрома (снижение веса от 97 до 96 кг, уменьшение отеков и количества влажных незвучных хрипов в легких, положительный диурез), подтвержденная данными БИВА (смещение импеданса Z в эллипс, ограничивающий 95-й центиль, нарастание активного R [от 355,3 до 384,2 Ом] и реактивного Xc [от 28,4 до 30,7 Ом] сопротивлений), в связи с чем уменьшена доза фуросемида (рис. 7).
Рисунок 7.Динамика состояния пациента. Коррекция терапии.
На 10-й день достигнуты полный регресс отечного синдрома, снижение уровня креатинина практически до исходного (от 235 до 158 мкмоль/л) и нарастание СКФ (от 24 до 38 мл/мин/1,73 м2). По данным БИВА, достигнута эуволемия: точка импеданса Z на границе эллипса, ограничивающего 50-й центиль.
Причиной декомпенсации ХСН у данного пациента послужила бронхо-легочная инфекция, что, согласно литературным данным, наблюдается среди 15 % пациентов с ОДХСН. По шкале Forman пациент имел высокий риск (4 балла) ухудшения функции почек: анамнез ХСН - 1 балл, анамнез СД - 1 балл, уровень креатинина при поступлении 141 мкмоль/л - 2 балла. Развитие КРС1 было обусловлено сохраняющейся перегрузкой объемом, несмотря на адекватную терапию, вероятно вследствие несоблюдения пациентом рекомендаций по ограничению употребления соли. Также нельзя исключить и ятрогенное воздействие: пациенту с анамнезом ХБП 3-й стадии и высоким риском ухудшения функции почек по шкале следовало снизить дозу антибактериального препарата [5].
Ведение пациентов с ОДХСН. Согласно рекомендациям, лечение пациентов с ОДХСН предполагает стартовую терапию петлевыми диуретиками, предпочтительно - внутривенное введение (уровень доказательности В) [18]. До исследования DOSE (Diuretic Optimization Strategies Evaluation) открытым с позиций доказательной кардиологии оставался вопрос о предпочтительном режиме диуретической терапии при ОДХСН. В исследовании DOSE не выявлено различий в регрессе симптомов сердечной недостаточности или изменении функции почек в течение 72 часов в зависимости от режима дозирования петлевого диуретика (болюс против инфузии) или интенсивности (низкая против высокой дозы). Несмотря на преходящие изменения почечной функции, стратегия высоких доз не ассоциировалась с увеличением риска осложнений за 60 дней. Стратегия высоких доз (в 2,5 раза превышающая пероральную дозу) ассоциировалась с лучшими результатами в отношении регресса симптомов, снижения веса и чистого объема жидкости, доли пациентов без клиники застойной сердечной недостаточности и снижения уровня NT-proBNP [19]. Полученные данные могут изменить реальную практику. Поскольку режим высоких доз (петлевых диуретиков) приводит к более быстрому регрессу одышки и не ассоциируется с ухудшением функции почек, он предпочтительнее режима низких доз. Назначение болюса может быть более удобным по сравнению с длительной инфузией при сопоставимой эффективности [20].
Эффективной альтернативой диуретической терапии при ОДХСН с гиперволемией может быть ультрафильтрация (UNLOAD - Ultrafiltration Versus Intravenous Diuretics for Patients Hospitalized for Acute Decompensated Heart Failure). Через 90 дней в группе ультрафильтрации по сравнению с группой внутривенного назначения диуретиков частота повторных госпитализаций по поводу сердечной недостаточности была значимо ниже (16 из 89 [18 %] против 28 из 87 [32 %]; p = 0,037). Не выявлено различий в уровне креатинина сыворотки между группами [21].
В отсутствие гипотонии целесообразно сочетание петлевых диуретиков с внутривенной инфузией нитратов (уровень доказательности В). При уровне САД < 90 мм рт. ст. показано назначение инотропных препаратов (уровень доказательности С). Предварительные результаты исследования DAD-HF (Dopamine in Acute Decompensated Heart Failure) свидетельствуют об эффективности комбинации низких доз фуросемида и допамина для пациентов с ОДХСН по сравнению с фуросемидом в высокой дозе. Данная комбинация ассоциируется с лучшим профилем почечной функции и гомеостазом калия: ухудшение функции почек значимо чаще регистрировалось в группе высоких доз фуросемида (n = 9; 30%) по сравнению с группой низких доз фуросемида и допамина (n = 2; 6,7%; уровень р = 0,042); динамика уровня калия за 24 часа в группе фуросемида в высокой дозе составила от 4,3 ± 0,5 до 3.9 ± 0,4 мэкв/л (р = 0,003) и от 4,4 ± 0,5 до 4,2 ± 0,5 мэкв/л (р = 0,07) - в группе фуросемида и допамина в низких дозах.
Длительность госпитализации, смертность и частота повторных госпитализаций за 60 дней были сопоставимыми в обеих группах [22].
Всем пациентам с ОДХСН необходимы ежедневный контроль веса, потребляемой и выделяемой жидкости (уровень доказательности С); низкосолевая диета (натрий 2 г/сут) (уровень доказательности С); контроль функции почек, электролитов, мочевой кислоты и уровня АД (уровень доказательности С). Ограничение жидкости ( < 2 л/сут) необходимо только для пациентов с умеренной гипонатриемией ( < 130 мЭкв/л); строгое ограничение жидкости исключительно при тяжелой гипонатриемии ( < 125 мЭкв/л) (уровень доказательности С) [18].
Трудность ведения пациентов и неудачи исследований новых классов лекарственных препаратов для лечения ОДХСН во многом предопределяет тот факт, что не определены четкие терапевтические стратегии и в действующих рекомендациях по лечению ОСН существует только одна позиция с уровнем доказательности А (неинвазивное положительное давление в конце выхода у пациентов с тяжелой одышкой и отеком легких) [18]. В большинстве исследований помимо эффективности в отношении симптомов и критериев ОДХСН оценивается и безопасность в отношении функции почек. Неудачи исследований во многом могут быть объяснены неоднородностью популяции пациентов с ОДХСН и субъективностью оцениваемой динамики состояния.
Селективные антагонисты рецепторов вазопрессина (V2). В исследование EVEREST (Efficacy of Vasopressin Antagonism in hEart failuRE: Outcome Study With Tolvaptan) включены 4133 пациента с ОДХСН, средний возраст - 66 ± 12 лет, ФВ - 28 ± 8 %; почечная недостаточность выявлена у 27%. В дополнение к стандартной терапии пациенты получали селективный антагонист рецепторов вазопрессина V2 толваптан или плацебо в течение не менее 60 дней. Средняя продолжительность наблюдения составила 9.9 месяца. Пероральный прием толваптана 30 мг/сут пациентами с ОДХСН способствовал уменьшению перегрузки объемом и ассоциировался с ранним и устойчивым снижением массы тела; уменьшением одышки в первый и седьмой день; отсутствием влияния на оценку общего состояния пациентом по визуальноаналоговой шкале в седьмой день и при выписке; нормализацией концентрации натрия; отсутствием ухудшения функции почек. Однако не выявлено влияния длительного лечения на общую и сердечно-сосудистую смертность или госпитализации по поводу ОДХСН. Селективный антагонист рецепторов вазопрессина V2 толваптан имеет приемлемый профиль безопасности, но необходимы дальнейшие исследования для определения целевой популяции пациентов и терапевтических стратегий для выявления клинических преимуществ терапии антагонистами рецепторов вазопрессина [23].
Антагонисты рецепторов аденозина - новый класс лекарственных препаратов, активирует аденозиновые рецепторы, улучшает почечный кровоток, стимулирует диурез и экскрецию натрия. В исследование PROTECT (Placebo-Controlled Randomized Study of the Selective A1 Adenosine Receptor Antagonist Rolofylline for Patients Hospitalized with Acute Decompensated Heart Failure and Volume Overload to Assess Treatment Effect on Congestion and Renal Function) включены 2033 пациента с ОДХСН и нарушением функции почек. Рандомизация осуществлялась 2 : 1 в две группы: антагонист рецепторов аденозина ролофиллин 30 мг или плацебо в течение 3 дней. В качестве первичной конечной точки оценивали эффективность терапии, неэффективность терапии, отсутствие динамики в отношении выживаемости, сердечной недостаточности и почечной функции. Вторичная конечная точка: персистирующая почечная недостаточность, повторная госпитализация по поводу сердечной недостаточности или почечных причин за 60 дней, смерть. Частота персистирующего ухудшения функции почек составила 15 % в группе ролофил- лина по сравнению с 13,7 % в группе плацебо (относительный риск - 0,92, 95 % доверительный интервал - 0,85-1,46, р = 0,44). Ролофиллин не имел преимуществ по влиянию на первичную комбинированную конечную точку и не обладал ренопротективным эффектом [24].
Натрийуретические пептиды. В исследование ASCEND-HF (A Study Testing the Effectiveness of Nesiritide in Patients With Acute Decompensated Heart Failure) включен 7141 пациент, госпитализированный с ОДХСН. Рандомизация осуществлялась в две группы лечения: натрийуретический пептид несеретид против плацебо в течение 24-168 часов в дополнение к стандартной терапии. Первичная конечная точка представлена динамикой уровня одышки по шкале Likert через 6 и 24 часа, комбинированная конечная точка - повторными госпитализациями по поводу сердечной недостаточности и смертью от любой причины в течение 30 дней. Назначение несеретида не было ассоциировано со снижением или увеличением частоты смерти или повторных госпитализаций (9,4 % в группе несеретида по сравнению с 10,1% в группе плацебо [р = 0,31]) и имело незначимое влияние на одышку. Терапия несеретидом не ассоциировалась с ухудшением функции почек (определяемое как снижение СКФ > 25%): 31,4 и 29,5 % в группах несеритида и плацебо; р = 0,11, но обусловливала более высокую частоту гипотонии. Несеретид не может быть рекомендован для рутинного использования пациентами с ОДХСН [25].
Алгоритм ведения пациентов с ОДХСН предполагает исходную оценку факторов риска ухудшения функции почек и своевременное выявление подгруппы пациентов с высоким рисом развития КРС1. Поскольку сложно прервать уже развивающийся КРС и не во всех случаях он полностью обратим, необходимо использовать биомаркеры для его ранней диагностики, а также определить профилактическую стратегию и тактику органопротекции на основании патофизиологических механизмов с использованием биомаркеров и БИВА. Основная профилактическая стратегия включает первичную профилактику развития сердечной недостаточности, подразумевающую модификацию факторов риска, контроль уровня артериального давления, блокаду ренин-ангиотензин-альдостерновой и симпатической нервной систем.



