Введение
Первичный полисимптомный энурез (ППЭ) является распространенным заболеванием среди детей и подростков (2,3–30%) [1–3]. Нижней границей возраста для постановки диагноза служат 5 лет [4]. Однако к 7-летнему возрасту начинают беспокоиться по поводу ночного недержания мочи у их ребенка лишь 15% родителей [5]. Это связано с отсутствием данных о качестве жизни пациентов с энурезом, влиянии заболевания на развитие и формирование личности ребенка. Выявлено большое количество этиопатогенетических факторов [6–8], но не определены наиболее значимые из них, которые формируют течение и тяжесть заболевания. Разнообразие причин и механизмов развития энуреза привело к появлению огромного количества средств и методов лечения. Каждое из предложенных медикаментозных средств действует однонаправленно, что, возможно, снижает эффективность лечения и формирует резистентные формы энуреза. Это диктует необходимость разработки комбинированной программы лечения для детей с первичным полисимптомным энурезом.
Цель – сравнить эффективность медикаментозных программ лечения первичного полисимптомного энуреза у детей.

Материал и методы
Данное исследование проведено на кафедре госпитальной педиатрии ГБОУ ВПО «НижГМА» МЗ РФ, расположенной на базе ГБУЗ НО «ДГКБ № 1» Приокского района Нижнего Новгорода (главный врач Н.В. Кисель).
За 2011–2014 гг. были обследованы 107 детей с жалобами на ночное недержание мочи. Выборка формировалась по активной обращаемости пациентов.
Критерии включения: дети от 5 до 12 лет, имеющие первичный характер энуреза с частотой не менее 3 раз в месяц и длительностью не менее 3 последовательных месяцев.
Критерии исключения: наличие пороков развития органов мочевой системы, требующих хирургической коррекции; острое течение инфекции мочевой системы; хроническая болезнь почек; хроническая соматическая патология в стадии обострения; эндокринные заболевания; органическая патология центральной и периферической нервной системы; психические заболевания.

Обследование включило изучение жалоб и анамнеза заболевания, оценку соматического и неврологического статусов, анализ водного режим ребенка в течение трех дней по частоте и соотношению объема выпитой и выделенной за сутки жидкости и кратности мочеиспускания, исследование общего анализа крови и мочи, ультразвуковое исследование почек и мочевого пузыря с определением остаточной мочи, урофлоуметрию. По показаниям проведены проба мочи по Зимницкому, посев мочи и чувствительность к антибиотикам, ретроградная цистометрия, экскреторная урография и цистография, ЭЭГ. Изучение качества жизни осуществлено при помощи опросника Pediatric Quality of Life Inventory – PedsQLTM4.0.
Показатели качества жизни пациентов с ППЭ по данным анкетирования детей и их родителей были сопоставлены с имеющимися в литературе данными о качестве жизни детей с I группой здоровья соответствующего пола и возраста: в возрасте от 5 до 7 лет – 37 детей, от 8 до 12 – 34 ребенка [10].
 Возрастной состав обследованной группы детей представлен согласно возрастной периодизации Н.П. Гундобина (табл. 1).
Возрастной состав обследованной группы детей представлен согласно возрастной периодизации Н.П. Гундобина (табл. 1).
С учетом использования различных медикаментозных программ лечения пациенты были поделены на три группы.
В основную группу, получавшую комбинированную терапию (гопантеновая кислота, десмопрессин), вошли 40 (47%) человек, а в группы сравнения 26 (30,6%) человек, получавших один из ноотропных препаратов (группа сравнения № 1) и 19 (22,4%), получавших в лечении десмопрессин (группа сравнения № 2) (табл. 2).
Всем пациентам была назначена уротерапия, включившая мотивационную терапию, режимные мероприятия, контроль потребляемой жидкости в течение дня. Пациентам основной группы кроме выше представленных мероприятий была добавлена тренировка мочевого пузыря.
Комбинированная терапия начиналась с уротерапии и приема гопантеновой кислоты в дозе 25 мг/кг/сут в два приема. Через месяц от начала терапии пациентам добавлялось назначение десмопрессина 200 мкг/сут в 1 прием (на ночь) на 3 месяца с постепенной отменой препаратов. Первым отменялась гопантеновая кислота, а затем десмопрессин. Отмена гопантеновой кислоты проходила следующим образом: через два месяца от начала приема в течение двух недель препарат принимался один раз в день в объеме ½ суточной дозы, затем препарат отменялся полностью. Постепенная отмена десмопрессина производилась через три месяца от начала терапии при сохранении суточной дозы и увеличении перерывов между приемами препаратов в режимах через день и два раза в неделю.
В группах сравнения пациенты получали монотерапию.
В первой из них использовались такие ноотропные средства, как пирацетам, аминофенилмасляная кислота, глицин в возрастных дозировках два раза в день в течение двух месяцев с быстрой отменой препарата. Во второй группе сравнения пациенты получали десмопрессин 200 мкг/сут на ночь. Курс лечения составил 3 месяца, отмена препарата происходила сразу.
Оценка эффективности терапии осуществлена по частоте снижения количества «мокрых» ночей в неделю после проведенного курса терапии. Полный ответ определен как снижение числа «мокрых» ночей не менее, чем на 90%, а частичный ответ – как снижение числа «мокрых» ночей по меньшей мере на 50% (ICСS, 2014).
Дети, получавшие разные виды терапии, не различались по полу, возрасту, тяжести энуреза и количеству этиопатогенетических факторов.
Статистическая обработка полученных данных выполнена с применением прикладного пакета программ Microsoft Excel 2007, статистических программ «Statistics 6.0», MedCalc 12.6.1.0. Для анализа качественных показателей применялся критерий хи-квадрат (χ2). При сравнении трех независимых групп по количественному признаку использован метод Краскела–Уоллиса. Для сопоставления двух групп по количественным данным применялся U-критерий Манна–Уитни. Проведено вычисление медианы, интерквартильного интервала, результаты представлены в виде медианы (Ме) и квартилей (Р25; Р75), где Р25 и Р75 – нижний и верхний квартили. Для выявления факторов, связанных с развитием неблагоприятных событий (установления вероятности наступления события [исхода] в зависимости от значений независимых переменных) указывались следующие показатели: отношение шансов (ОШ), относительный риск (ОР) и его (95%) доверительный интервал (ДИ) (95% CI), р – значение. Установленный уровень статистической значимости р≤0,05.
Результаты исследования
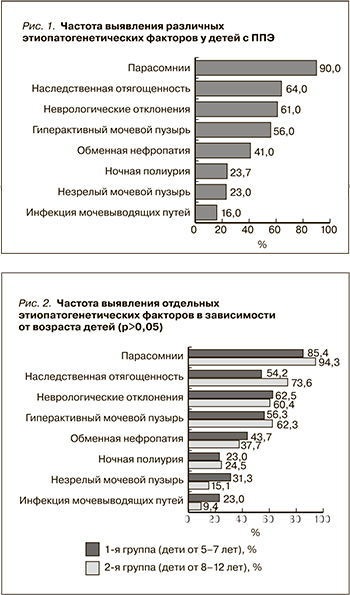
В ходе исследования проводилась оценка вклада известных в литературе этиопатогенетических факторов в формирование ППЭ. Установлена частота встречаемости отдельных этиопатогенетических факторов и проведен их анализ в возрастном аспекте (рис. 1, 2).
В подавляющем большинстве (в 90,1% [91 из 101] случаев) у пациентов зарегистрировано явление парасомнии. Парасомнии с одинаково большой частотой регистрировались во все возрастные периоды заболевания, начиная с его дебюта.
Анализ генеалогического анамнеза показал значительную отягощенность по энурезу – у 64,4% (65 из 101) детей. Отягощенность по энурезу чаще выявлялась преимущественно у старшей возрастной группы, однако различия в частоте не были статистически значимыми.
У 61,4% (62 из 101) пациентов выявлены неврологические нарушения, которые проявлялись в виде синдрома дефицита внимания и гиперактивности у 56,5% (35 из 62), навязчивых состояний и страхов у 28% (18 из 62), церебрастенического синдрома у 41,5% (26 из 62) пациентов. Неврологическая симптоматика также выявлена на всех возрастных этапах с одинаковой частотой.
Из обследованных 56,4% (57 из 101) детей имели симптомокомплекс гиперактивного мочевого пузыря (ГАМП). Частота выявления синдрома ГАМП с возрастом увеличивается, что соответствует данным литературы [9].
Обменная нефропатия была выявлена у 40,6% детей (41 из 101). При исследовании суточного биохимического анализа мочи в основном определялась уратурия (57,8%) и оксалатурия (78,9%).
У 23,7% (24 из 101) пациентов зарегистрирована ночная полиурия. Обменная нефропатия, ночная полиурия были выявлены во всех возрастных группах с одинаково небольшой частотой.
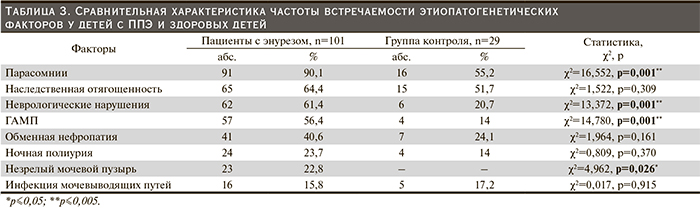
При анализе дневника мочеиспусканий у 22,8% пациентов (23 из 101) выявлено отставание в функциональном развитии мочевого пузыря. С возрастом имеется тенденция к уменьшению частоты регистрации незрелого мочевого пузыря и инфекции мочевыводящих путей.
Инфекцию мочевыводящих путей в анамнезе имели 15,8% пациентов (16 из 101) (хронический цистит, хронический пиелонефрит). На момент включения в исследование все дети имели клинико-лабораторную ремиссию. Родители детей отмечали, что учащение «мокрых» ночей происходило с обострением ИМП.
Следует отметить, что достоверно чаще у 85% (86 детей из 101) (χ2=31,137; р=0,001) пациентов было выявлено сочетание более двух этиопатогенетических факторов.
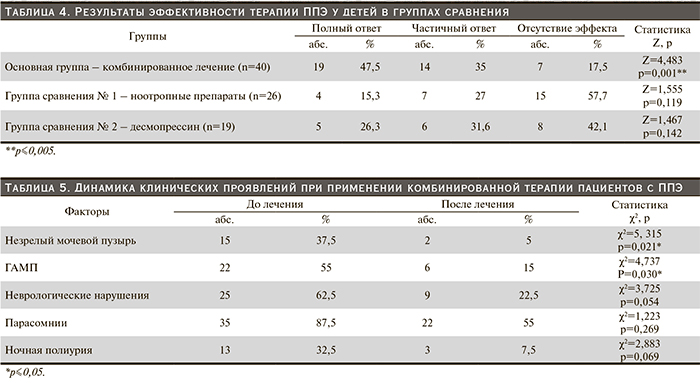
Нами был оценен вклад указанных этиопатогенетических факторов в развитие энуреза у детей. С этой целью проведено сравнение частоты встречаемости данных факторов у пациентов с энурезом, включенных в исследование, и здоровых детей соответствующего возраста и пола (табл. 3).
Незрелый мочевой пузырь (χ2=4,962, р=0,026; 95% ДИ – 1,10; 171,65) был выявлен только у пациентов с ППЭ, следовательно, он является наиболее важным этиопатогенетическим фактором в развитии болезни. Достоверно чаще у пациентов основной группы регистрировались неврологические нарушения (χ2=13,372; р=0,001; 95% ДИ – 2,11; 18,48), проявления ГАМП (χ2=14,780; р=0,001; 95% ДИ – 2,43; 29,78) и парасомнии (χ2=16,552; р=0,001; 95% ДИ – 2,51; 22,23).
При анализе результатов лечения установлено, что эффект от применения комбинированной терапии достигает 82,5% (Z=4,483; р=0,001) (табл. 4).
При сравнении эффективности терапии в основной группе и группах сравнения выявлено, что эффективность комбинированной терапии ППЭ достоверно выше (Н=8,575; р=0,014) по сравнению с монотерапией.
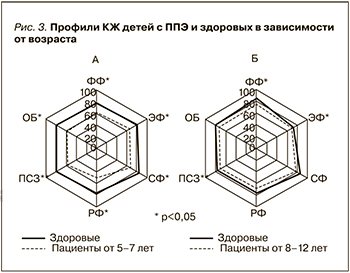 При применении комбинированной терапии кроме эффективности были отмечены следующие положительные реакции: у 86,7% (13 из 15) пациентов сформировался зрелый мочевой пузырь в процессе терапии, отсутствие ночной полиурии у 77% (10 из 13), купирование синдрома императивного мочеиспускания у 72,7% (16 из 22), улучшение неврологических изменений у 64% (16 из 25), нормализация глубины сна произошла у 42,8% (15 из 35) детей (табл. 5).
При применении комбинированной терапии кроме эффективности были отмечены следующие положительные реакции: у 86,7% (13 из 15) пациентов сформировался зрелый мочевой пузырь в процессе терапии, отсутствие ночной полиурии у 77% (10 из 13), купирование синдрома императивного мочеиспускания у 72,7% (16 из 22), улучшение неврологических изменений у 64% (16 из 25), нормализация глубины сна произошла у 42,8% (15 из 35) детей (табл. 5).
При оценке эффективности терапии в катамнезе через 3 месяца удалось установить, что у пациентов основной группы в 94% наблюдается сохранение эффекта от проведенной комбинированной терапии.
При оценке показателей качества жизни (КЖ) установлено, что все аспекты достоверно снижены у детей с ППЭ в возрасте от 5 до 7 лет по сравнению со здоровыми детьми (рис. 3а).
В возрасте от 8 до 12 лет у детей с ППЭ также все показатели КЖ снижены, но статистически значимы физическое функционирование (Z=4,987; р=0,001), эмоциональное функционирование (Z=4,877; р=0,001), психосоциальное здоровье (Z=2,684; р=0,001) (рис. 3б).
При анализе различий в ответах детей и родителей установлено, что родители детей в возрасте от 5 до 7 лет лучше оценивают параметры КЖ по всем аспектам, но достоверно значимым определено физическое функционирование (Z=2,629; р=0,007). При анализе различий в ответах детей и родителей в возрасте от 8 до 12 лет родители, напротив, оценивают КЖ по всем параметрам ниже, чем дети. Выявлены значимые различия по эмоциональному функционированию (Z=2,101; р=0,038), функционированию в школе (Z=4,387; р=0,002), психосоциальному здоровью (Z=4,889; р=0,001) и общему баллу (Z=2,118; р=0,054).
Обсуждение результатов исследования
Таким образом, этиопатогенетические факторы ППЭ сочетаются в различных комбинациях независимо от возраста и пола и действуют в период манифестации заболевания, формируя его течение и тяжесть. Достоверно значимыми факторами в развитии ППЭ у детей являются незрелый мочевой пузырь, гиперактивный мочевой пузырь, неврологические нарушения, парасомнии.
С учетом установленного вклада отдельных этиопатогенетических факторов в развитие заболевания нами предложена комбинированная программа лечения детей. Так, включение гопантеновой кислоты в терапию нивелирует проявления гиперактивного мочевого пузыря, способствует коррекции выявленных неврологических нарушений и зрелости нервной системы. Десмопрессин купирует проявления ночной полиурии, уменьшает глубину сна. Сочетание гопантеновой кислоты и десмопрессина на фоне уротерапии позволяет воздействовать на наиболее статистически значимые этиопатогенетические механизмы ППЭ. Использование комбинированной терапии с разным патогенетическим механизмом действия позволяет добиваться лучших результатов при ППЭ у детей. Предложенная нами комбинированная медикаментозная программа высокоэффективна (82,5%) и безопасна для детей дошкольного и школьного возраста.
В результате проведенного исследования можно сделать следующий вывод: качество жизни безусловно страдает у пациентов с первичным полисимптомным энурезом, по мнению как самих детей, так и их родителей, по сравнению со здоровыми детьми. При сравнительном анализе здоровых детей и детей, страдающих первичным полисимптомным энурезом в возрасте от 5 до 7 лет, удалось выявить, что все аспекты КЖ достоверно снижены у больных детей. КЖ детей от 8 до 12 лет с первичным полисимптомным энурезом имеет более низкие показатели по всем аспектам. Достоверно значимы такие параметры, как физическое функционирование, эмоциональное функционирование, психосоциальное здоровье. Родители детей в возрасте от 5 до 7 лет несколько выше оценивают КЖ детей, чем сами дети. При анализе различий в ответах детей и родителей в возрасте от 8 до 12 лет удалось установить, что родители оценивают КЖ по всем параметрам ниже, чем дети. Поэтому необходимо как можно раньше начинать лечение детей, страдающих первичным полисимптомным энурезом. При составлении программ реабилитации необходимо учитывать все выявленные особенности характеристик качества жизни ребенка.
Выводы
- В формировании первичного полисимптомного энуреза достоверно чаще (85%) принимают участие более двух этиопатогенетических факторов в различных сочетаниях; к лидирующим факторам относятся парасомнии, незрелый мочевой пузырь, гиперактивный мочевой пузырь, неврологические нарушения, связанные с задержкой созревания ЦНС и дизрегуляцией. Сочетанное воздействие этиопатогенетических факторов регистрируется с дебюта заболевания, при этом не выявлено достоверной возрастной зависимости влияния факторов на формирование энуреза.
- Комбинированная терапия, включающая уротерапию и медикаментозное лечение в виде сочетанного использования гопантеновой кислоты и десмопрессина, высокоэффективна и безопасна для детей дошкольного и школьного возраста по сравнению с монотерапией. Сочетание медикаментозных методов лечения с разным патогенетическим механизмом действия позволяет повышать эффективность терапии до 82,5% при первичном полисимптомном энурезе.
- Качество жизни достоверно страдает у пациентов с первичным полисимптомным энурезом, по мнению как самих детей, так и их родителей, по сравнению со здоровыми детьми и не зависит от длительности заболевания. Под влиянием оказываются такие характеристики качества жизни, как физическое, эмоциональное, социальное, ролевое функционирование и психосоциальное здоровье, что свидетельствует о необходимости раннего лечения детей, страдающих первичным полисимптомным энурезом.



