Лечение хронического гломерулонефрита (ХГН) является одной из актуальных проблем в нефрологии, что определяется распространенностью данной патологии (диагностируется у трети всех пациентов с заболеваниями почек), тяжестью течения и недостаточной эффективностью стандартных схем терапии определенных форм ХГН с неизбежным прогрессированием в хроническую почечную недостаточность (ХПН).
В механизмах прогрессирования ХГН особое значение придают моноцитарному хемотаксическому протеину-1 (MCP-1), что показано на воспалительных [1] и невоспалительных [2, 3] моделях почечного повреждения у животных. В клинических исследованиях, в т.ч. отечественных, продемонстрирована связь уровня МСР-1 в моче с клиническими и гистологическими признаками активности нефрита, а также с распространенностью тубулоинтерстициального фиброза (ТИФ) [4, 5].
Данный хемокин секретируют мезангиальные, эндотелиальные клетки почки, подоциты, а также клетки тубулярного эпителия, в т.ч. в ответ на воздействие компонентов протеинурии (ПУ) [6, 7]. МСР-1 является основным хемоаттрактантом для мононуклеарных клеток и играет ключевую роль в формировании воспалительного инфильтрата в ткани почки [1, 8].
Введение нейтрализующих антител к МСР-1 мышам с экспериментальным нефритом приводило к уменьшению ПУ, инфильтрации клубочков макрофагами и препятствовало развитию гломеруло- и тубулоинтерстициального фиброза [9, 10]. У пациентов с нефритом отмечен антипротеинурический и ренопротективный эффекты ингибиторов МСР-1 за счет нивелирования неблагоприятных эффектов этого цитокина на подоциты [11, 12].
В ФГБУ РКНПК МЗ РФ разработан препарат, представляющий собой пептид Х молекулы МСР-1 (65–76 МСР-1). Противовоспалительное действие препарата обусловлено связыванием с гликозаминогликанами на поверхности клеток, вытеснением эндогенного МСР-1 и, возможно, других хемокинов. В моделях локального воспаления у различных животных (линейных мышей и крыс, а также у обезьян) препарат при внутримышечном и внутривенном введении ингибировал миграцию моноцитов и гранулоцитов в участки воспаления.
Доклиническое изучение фармакологического и токсикологического действий препарата показало его безопасность в рекомендованных дозах [13]. В исследованиях на здоровых добровольцах и на 52 больных ишемической болезнью сердца введение препарата не сопровождалось клинически значимыми побочными эффектами и отклонениями лабораторных показателей [14]. Принимая во внимание важную роль МСР-1 в патогенезе и прогрессировании почечного повреждения (как гломерулярного, так и тубулоинтерстициального), представляется актуальным исследование действия ингибиторов МСР-1 на больных с протеинурическими формами ХГН.
Исследование препарата при протеинурических формах хронического гломерулонефрита проводилось в соответствии с действующим законодательством (разрешение Министерства здравоохранения и социального развития РФ № 720 от 16.02.2012, разрешение Совета по этике при Министерстве здравоохранения и социального развития РФ № 34 от 08.02.2012, протокол межвузовского комитета по этике № 02-12 от 14.03.2012).
Цель исследования: оценить эффективность, безопасность и переносимость нового отечественного противовоспалительного препарата – ингибитора действия МСР-1 у больных протеинурическими формами хронического гломерулонефрита.
Материал и методы
 Обследованы 7 больных различными формами ХГН: 1 женщина и 6 мужчин в возрасте 31 [24; 57] года. Все больные были с активным течением (обострением) ХГН, которым возможно было отсрочить патогенетическое лечение кортикостероидами и цитостатиками минимум на 3 месяца без высокой вероятности ухудшения. Каждый пациент подписывал информированное согласие на участие в исследовании.
Обследованы 7 больных различными формами ХГН: 1 женщина и 6 мужчин в возрасте 31 [24; 57] года. Все больные были с активным течением (обострением) ХГН, которым возможно было отсрочить патогенетическое лечение кортикостероидами и цитостатиками минимум на 3 месяца без высокой вероятности ухудшения. Каждый пациент подписывал информированное согласие на участие в исследовании.
Морфологически диагноз был подтвержден в отношении 6 больных: у 2 выявлен мезангиопролиферативный ГН, у 1 – мезангиокапиллярный ГН, у 1 – мембранозная нефропатия, у 1 – минимальные изменения, у 1 – фокальный сегментарный гломерулосклероз.
Выраженность фиброза в интерстиции почки оценивали в баллах: 1 – единичные очаги фиброза интерстиция, 2 – наличие множественных очагов фиброза интерстиция, 3 – наличие диффузного фиброза интерстиция.
Трое пациентов страдали умеренным нефротическим синдромом (НС): ПУ составляла в среднем 2,5 [2,46; 5,28] г/сут, альбумин – 29 [27,6; 30] г/л, у двух пациентов НС сочетался с умеренной эритроцитурией до 20 в п/зр. Функция почек у этих больных была сохранна: креатинин – 0,68 [0,64; 0,72] мг/дл (расчетная скорость клубочковой фильтрации [СКФ] по CKD-EPI 100–140 мл/мин). У всех пациентов отмечена умеренная артериальная гипертензия (АД до 150/100 мм рт.ст.), поддающаяся коррекции антигипертензивными препаратами с достижением целевого уровня 130/80 мм рт.ст.
У 4 пациентов с выраженным мочевым синдромом уровень суточной ПУ в среднем составлял 2,03 [1,48; 3,92] г/сут, у 2 ПУ сочеталась с выраженной эритроцитурией (до 100 в п/зр.), у 2 – с умеренной эритроцитурией (до 20 в п/зр). У 3 паци-ентов имело место начальное снижение функции почек (креатинин в среднем 1,27 [1,17; 1,54] мг/дл, СКФ 62–74 мл/мин).
У 2 пациентов – умеренная артериальная гипертензия (АД до 160/100 мм рт.ст.).
Препарат вводили больным ХГН по следующей схеме: в первую неделю лечения – 6 инъекций по 2,5 мг с интервалами 6 часов между двумя первыми, 24 часа между последующими двумя, 48 часов между пятой и шестой инъекциями. Первые 2 инъекции выполнялись внутривенно, остальные 4 – внутримышечно (суммарная доза – 15 мг). Интервалы и кратность между введениями препарата в первую неделю лечения базировались на результатах применения препарата пациентами при стентировании коронарных сосудов для подавления острого воспаления.
Всем пациентам проведена нефропротективная и антигипертензивная терапия ингибиторами ангиотензин-превращающего фермента (ИАПФ) или блокаторами рецепторов ангиотензина (БРА), антагонистами кальциевых каналов, бета-блокаторами, альфа-адреноблокаторами, а также гиполипидемическая терапия (статины – симвастатин, аторвастатин).
Шести пациентам до и во время лечения препаратом базисная терапия иммуносупрессивными препаратами не была проведена. Одному пациенту продолжена поддерживающая терапия преднизолоном в дозе 10 мг/сут, что допускалось протоколом исследования. На фоне введения препарата дозы преднизолона и нефропротективных препаратов не менялись.
Шести пациентам через 4 недели курс лечения был повторен. Одному пациенту проведен однократный курс лечения препаратом в связи с нарастанием тяжести НС. На 21-е сутки этому пациенту была начата иммуносупрессивная терапия стероидами и циклофосфамидом (ЦФА).
У 3 из 7 пациентов после проведения 3 курсов сохранялась высокая активность нефрита, в связи с чем начата стандартная иммуносупрессивная терапия в соответствии с клинической и морфологической картиной ХГН: преднизолон (ПЗ) перорально до 1 мг/кг/сут, а также введение сверхвысоких доз ПЗ и цитостатиков в виде «пульс»-терапии внутривенно: ПЗ 1500–3000 мг, ЦФА от 500 до 1000 мг.
Исследование мочевой экскреции профиброгенных факторов (МСР-1, TФР-β) проведено методом ELISA (МСР-1 Bioscience, Austria, TGF-beta1 Invitrogen, USA), определение уровня провоспалительного интерлейкина ИЛ-8 в сыворотке крови – методом Immulite. В исследовании была оценена динамика этих показателей (1 раз в 7 дней) в течение первого курса лечения. При повторных курсах введения ингибитора действия МСР-1 эти показатели исследовались на большинстве пациентов однократно перед введением препарата.
Статистический анализ данных осуществлен при помощи стандартного пакета программ статистического анализа (Statistica, версия 6.0). Для описания распределений признаков вследствие малой выборки использованы медиана и интерквартильный размах: Me [25-й и 75-й процентили]. Для оценки достоверности различий показателей в динамике использован W-критерий Уилкоксона.
Результаты исследования
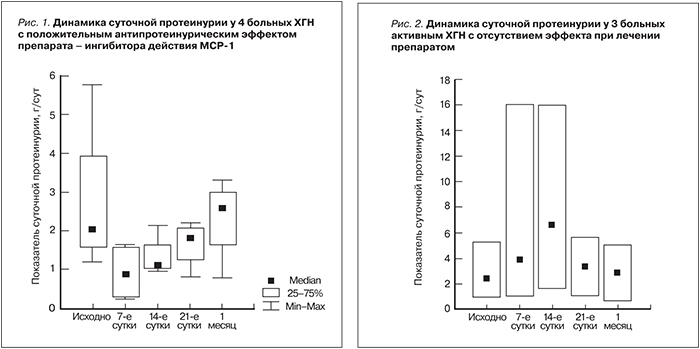
У 4 из 7 обследованных больных введение препарата сопровождалось снижением ПУ. Максимальное снижение ПУ у этих больных (с 2,03 [1,49, 3,91] до 0,71 [0,28; 1,28] г/сут) наблюдалось на 7-е сутки, что составило 65% от исходного уровня, антипротеинурический эффект сохранялся до 14 суток (ПУ до 1,1 [1,03; 1,38] г/сут). Однако с 21-х суток уровень ПУ вновь увеличился до 1,39 [0,93; 1,81] г/сут (рис. 1). Уменьшение ПУ на 7–14-е сутки в отсутствие приема дополнительных нефропротективных препаратов в эти сроки позволяет предполагать, что антипротеинурический эффект служит результатом действия препарата, однако он кратковременный и длится не более 2 недель.
У 3 из 7 больных после введения препарата на 14-е сутки, напротив, отмечено нарастание ПУ (рис. 2). У 2 из них в течение 21 суток после введения препарата показатель ПУ вернулся к исходному уровню. Одному пациенту в связи с дальнейшим нарастанием ПУ и выраженности НС на 21-е сутки начата стандартная иммуносупрессивная терапия ПЗ и ЦФА.
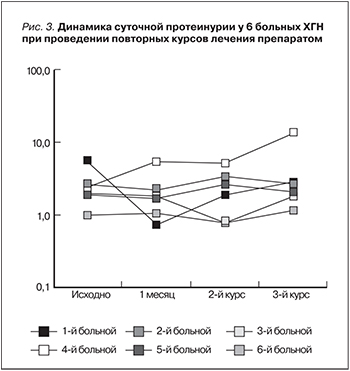
У 6 из 7 больных при повторных курсах (втором и третьем) введения препарата также было отмечено кратковременное снижение ПУ, однако стойкого эффекта даже при проведении повторных курсов добиться не удалось (рис. 3).
Учтя неоднозначный эффект препарата в отношении ПУ, мы попытались оценить влияние препарата на динамику молекулярных маркеров воспаления и фиброза. В зависимости от достигнутого эффекта мы выделили группу больных, у которых препарат снижал ПУ (положительный эффект), а также группу больных с нарастанием ПУ (отрицательный эффект).
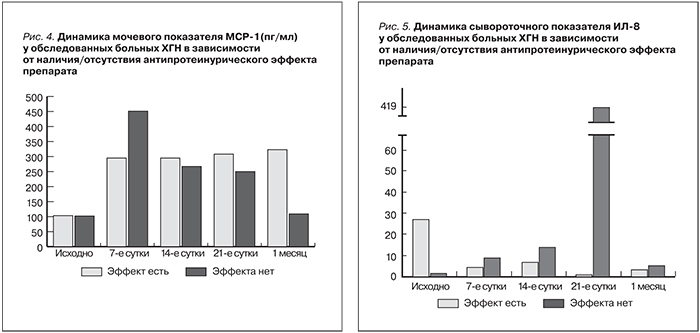
Исходный уровень МСР-1 в моче не различался у больных обеих групп. У всех обследованных больных с активным течением ХГН начиная с 1-х суток (через 24 часа) лечения препаратом и в течение 1-го месяца отмечено увеличение экскреции МСР-1 с мочой (рис. 4). У 2 пациентов с наиболее высокой активностью нефрита (нефротический синдром) и небольшой длительностью заболевания (до 6 месяцев) повышение МСР-1 на 7-е сутки лечения было максимальным в нашем наблюдении, что сопровождалось дальнейшим нарастанием ПУ и снижением белков сыворотки крови.
У пациентов, от которых был получен положительный антипротеинурический эффект, отмечено постепенное снижение уровня ИЛ-8 в сыворотке крови к 21-м суткам, этот эффект сохранялся и при повторных курсах лечения. Напротив, в другой группе больных с увеличением ПУ в ходе лечения наблюдалось нарастание уровня ИЛ-8 в сыворотке крови в те же сроки (рис. 5). Нарастание ПУ у 3 из 7 больных одновременно с повышением уровня МСР-1 в моче и ИЛ-8 в сыворотке крови, по-видимому, служит проявлением синдрома «рикошета» после прекращения блокирующего МСР-1 эффекта препарата.
Исходный уровень ТФР-β в моче больных, которым удалось добиться антипротеинурического действия, был в 1,5 раза выше, чем у пациентов с отрицательным результатом. Более высокие значения ТФР-β сохранялись у этих пациентов в течение всего месяца. В другой группе больных уровень ТФР-β снижался к 7-м суткам (рис. 6), в то время как ПУ и выраженность НС в эти сроки нарастала.
Учтя противоположный характер изменений молекулярных медиаторов воспаления и фиброза у обследованных больных ХГН при лечении препаратом, нами был рассчитан условный индекс «активности» нефрита, отражазивший соотношение про- и противовоспалительных цитокинов (МСР-1+ИЛ-8/ ТФР-β). Этот индекс исходно был ниже у больных с положительным антипротеинурическим эффектом и изменился незначительно за весь период наблюдения. У другой группы пациентов (с нарастанием ПУ) этот расчетный показатель был исходно выше и значительно увеличился к 7–14-м суткам наблюдения (рис. 7), что, с нашей точки зрения, можно расценивать как нарастание активности заболевания у этой категории больных за счет возникновения синдрома «рикошета».
У всех обследованных пациентов при введении препарата не было отмечено каких-либо изменений показателей клинического анализа крови, уровня трансаминаз, липидного обмена, электролитов, глюкозы сыворотки крови, показателей коагулограммы, уровня иммуноглобулинов и комплемента.
У пациентов с исходно нормальными показателями креатинина и СКФ эти параметры при лечении препаратом также не изменились. Однако у 3 больных, имевших исходно сниженную СКФ (1,27 [1,17; 1,54] мг/дл), на 14-е сутки лечения отмечено транзиторное повышение креатинина и снижение СКФ в среднем на 15% от исходного и совпало во времени с увеличением уровня МСР-1 в моче. В этом случае мы можем расценивать повышение креатинина как следствие повышения активности в рамках синдрома «рикошета» (возможно, с привлечением большего числа клеток в интерстиций ткани почки).
Двое пациентов отметили ощущение жара после внутривенного введения препарата и один пациент – локальную болезненность при внутримышечных инъекциях.
Дальнейшее исследование препарата было прекращено по следующим причинам: низкая эффективность препарата и отсутствие стойкого эффекта на терапию, а также нарастание тяжести нефротического синдрома, транзиторное ухудшение функции почек у пациентов с исходным ее снижением, наличие синдрома «цитокинового рикошета» на 14–21-й день обследования.

Обсуждение полученных результатов
В экспериментальных исследованиях острого воспаления на моделях лабораторных животных были продемонстрированы противовоспалительные эффекты пептидного препарата – ингибитора действия хемокина МСР-1, основанные на подавлении миграции в очаг воспаления гранулоцитов и моноцитов [13, 14].
Ранее в экспериментальных и некоторых клинических исследованиях были получены данные об антипротеинурическом эффекте ингибиторов МСР-1 с различным механизмом действия [9, 10].
В нашем пилотном исследовании впервые оценено действие препарата на больных с протеинурическими формами ХГН. Снижение ПУ наблюдалось у 4 из 7 пациентов. Быстрый и кратковременный антипротеинурический эффект, возможно, связан помимо подавления миграции клеток воспаления с непосредственным влиянием препарата на подоциты – ключевое звено развития ПУ при ХГН.
Влияние МСР-1 на подоциты было показано в исследовании E.Y. Lee и соавт. [15]. Добавление МСР-1 в культуру подоцитов привело к изменению миграционных свойств (подвижности) этих клеток путем реорганизации цитоскелета с перемещением актиновых филаментов к периферии. Показано, что такие изменения цитоскелета подоцита осуществляются при активации рецепторов CCR2, экспрессирующихся на поверхности эпителиальных клеток клубочков [12]. Антагонисты МСР-1 и CCR2 блокируют изменения цитоскелета подоцитов и повышение проницаемости подоцитарного монослоя для альбумина, что лежит в основе их антипротеинурического действия. Однако механизмы воздействия препарата на подоциты требуют отдельного изучения, т.к. пептид X (65-76 МСР-1) не взаимодействует с CCR2, а конкурирует с эндогенным МСР-1 за связывание с гликозаминогликанами на поверхности клеток [16].
В исследовании больных активным волчаночным нефритом A. Ble и соавт. применение ингибитора МСР-1 привело к стойкому антипротеинурическому эффекту у 6 из 11 больных в течение 6 месяцев наблюдения. Однако в этом исследовании стойкий эффект был обеспечен длительным приемом препарата в сочетании с кортикостероидной терапией [20].
Среди всех изученных в нашем исследовании показателей и молекулярных биомаркеров предикторное значение в отношении снижения ПУ имел высокий исходный уровень TGF-beta в моче. Активность нефрита у этих пациентов была исходно ниже, длительность заболевания – выше, и мы полагаем, что и более высокий уровень TGF-beta в моче, возможно, отражает процессы фиброгенеза в ткани почки. С другой стороны, снижение TGF-beta в динамике больных, у которых отмечено увеличение ПУ при введении препарата, может отражать преобладание процессов активного воспаления над механизмами противовоспалительной защиты.
У всех больных в нашем исследовании отмечено повышение МСР-1 в моче через 24 часа после введения препарата. С учетом быстрого разрушения пептида X в крови (через 24 часа) возможным объяснением такой динамики МСР-1 в моче служит его повышенная эндогенная секреция. После завершения введения препарата и его МСР-1 блокирующего эффекта начинается компенсаторный эндогенный синтез этого хемокина, способствующий развитию синдрома «рикошета». Так, наиболее значимое увеличение уровня МСР-1 в моче и «высокий индекс активности» были отмечены у пациентов с нарастанием ПУ и/или повышением уровня креатинина сыворотки крови на 7–14-е сутки лечения.
ЗАКЛЮЧЕНИЕ
- У 4 из 7 больных с активным течением ХГН на 7–14-е сутки лечения препаратом отмечено уменьшение ПУ. Антипротеинурический эффект был кратковременным: при динамическом наблюдении к концу месяца показатели ПУ возвращались к исходным значениям как в конце первого курса, так и при повторных введениях препарата.
- В группе больных, от которых был получен антипротеинурический эффект препарата, наблюдался исходно более высокий уровень ТФР-β в моче, а на 14–21-й день наблюдения он увеличивался наряду со снижением сывороточного показателя ИЛ-8.
- У 3 из 7 обследованных пациентов на 7–14-е сутки наблюдения, напротив, отмечено нарастание ПУ, ассоциированное с резким подъемом уровня МСР-1 в моче и ИЛ-8 в сыворотке крови и снижением мочевого показателя ТФР-β, что, возможно, является проявлением синдрома «рикошета» после прекращения введения препарата.
- Антипротеинурический эффект препарата был достигнут пациентами с исходно более низким индексом «активности» ХГН (МСР-1+ИЛ-8/ ТФР-β). В группе больных, которым препарат не оказывал положительного эффекта, увеличение индекса «активности» на 7–14-е сутки было ассоциировано с нарастанием протеинурии и свидетельствовало о риске обострения заболевания.
- Среди побочных эффектов при введении препарата у 3 больных отмечено транзиторное повышение показателя креатинина на 14-е сутки лечения, у 2 –ощущение жара после внутривенного введения препарата и у 1 – болезненность при внутримышечных инъекциях.
Для обеспечения стойкого эффекта препарата и уменьшения явлений «рикошета» у больных активным ХГН, по-видимому, необходимы разработка пролонгированных форм ингибиторов МСР-1 (для постоянного приема per os, депонированных инъекционных форм), а также оценка эффекта препарата (как нефропротективного/антипротеинурического) в комбинации со стандартной иммуносупрессивной терапией.



