Исследования последних лет существенно изменили понимание причин прогрессирования нефропатий и развития хронической почечной недостаточности (ХПН). Помимо основных факторов прогрессирования нефросклероза, таких как протеинурия и артериальная гипертензия (АГ), активно изучается значение полиморфизмов гена ангиотензинпревращающего фермента (АПФ), которые определяют активность АПФ и тем самым влияют на уровень синтеза ангиотензина II (Ang II), который является центральным звеном патогенеза склеротических изменений в почках [1].
Ген АПФ локализован на длинном плече 17-й хромосомы в локусе 17q23, содержит 26 экзонов, его размер составляет 45 т.п.о. (тысяч пар оснований). В гене АПФ выявлен инсерционно-делеционный полиморфизм, связанный с инсерцией (I) или делецией (D) повтора размером 287 п.н. (пар нуклеотидов) в интроне 16-го экзона АПФ [2]. Данный ген кодирует два изофермента. Соматический или мембраносвязанный изофермент АПФ экспрессируется во многих тканях, включая эндотелиальные клетки сосудов, мембраны кардиомиоцитов, почечные эндотелиальные клетки и др. [3]. АПФ играет важную роль в регуляции кровяного давления и электролитного баланса, также влияет на фибринолиз, активацию и агрегацию тромбоцитов путем гидролиза ангиотензина I в ангиотензин II, инактивирует брадикинин, является мощным вазопрессором и альдостеронстимулирующим пептидом [4]. Активность фермента в крови связана с наличием варианта D-делеции (отсутствия) Alu-последовательности внутри интрона гена АПФ. Носители I/I генотипа имеют самый низкий уровень активности фермента, в то время как у людей с D/D-генотипом он максимален. Генотип I/D характеризуется промежуточным уровнем активности фермента [5].
Значение полиморфизма АПФ изучалось при АГ и прогрессировании нефропатий, в частности при остром повреждении почек, гломерулонефрите, поликистозе почек, диабетической нефропатии и др. [6–9]. Данные о связи полиморфизма гена АПФ с прогрессированием нефропатии неоднозначны [10]. Современные исследования подтверждают увеличение риска артериальной гипертензии у носителей генотипа D/D [11, 12]. Снижение почечных функций демонстрировали больные фокально-сегментарным гломерулосклерозом (ФСГС), гомозиготные по D-аллелю в еврейской, арабской и турецкой популяциях [13, 14]. S. Rizvi и соавт. (2014) определили, что идентификация полиморфизма гена АПФ позволит обнаружить группу лиц с высоким риском развития диабетической нефропатии, что могло бы помочь в лечении, диагностике и раннем предупреждении заболевания [6].
 Л.С. Приходина (2013) отметила, что распределение аллелей и генотипов АПФ у детей с нефротическим синдромом не отличалось от группы контроля, что подтверждается отсутствием ассоциации с развитием заболевания, и установила низкую вероятность его прогрессирования при наличии I/D- и D/D-полиморфизмов гена АПФ [15].
Л.С. Приходина (2013) отметила, что распределение аллелей и генотипов АПФ у детей с нефротическим синдромом не отличалось от группы контроля, что подтверждается отсутствием ассоциации с развитием заболевания, и установила низкую вероятность его прогрессирования при наличии I/D- и D/D-полиморфизмов гена АПФ [15].
Е.С. Камышева (2005) показала, что у больных хроническим гломерулонефритом (ХГН) отсутствует ассоциация полиморфных маркеров I/D-гена АПФ с генетической предрасположенностью к возникновению ХГН, но выявила ассоциацию данных полиморфных маркеров с факторами неблагоприятного течения ХГН и быстрого прогрессирования вплоть до развития ХПН [16]. Ж.П. Шарнова (2006) показала, что частота генотипов достоверно не различалась между больными нефротическим синдромом и контролем [17]. Достоверной разницы в распределении генотипов АПФ среди больных фокально-сегментарным гломерулосклерозом (n=12), стероид-чувствительным нефротическим синдромом (n=32), нефротическим синдромом с артериальной гипертензией (n=22) отмечено не было. Однако преобладание D/D-генотипа АПФ было достоверно выше в группе больных ХПН, она отметила, что D/D-генотип может служить фактором риска прогрессирования НС до стадии ХПН.
K. Hohenfellner и соавт. (2001) определили полиморфизм АПФ у 59 детей с различными врожденными пороками развития почек и у 36 больных гломерулярной патологией. Прогрессирование болезни определяли по скорости снижения клубочковой фильтрации (СКФ) Статистической разницы полиморфизма генотипов между группами найдено не было. Среди детей с врожденными пороками развития почек с генотипом D/D через 2 года наблюдения почечная выживаемость составила 61%, что значительно ниже, чем у пациентов с I/D- или I/I-генотипами (89%, р<0,01). Авторы отметили, что генотип АПФ D/D является значимым фактором риска прогрессирования заболевания вплоть до развития ХПН у детей с врожденными пороками развития почек и не зависит от наличия АГ и протеинурии [18].
В ряде работ показано, что у носителей D/D-генотипа отмечались значительно более высокие цифры артериального давления [19]. В других исследованиях подобной связи с уровнем артериального давления не выявлено. Авторы отметили, что протеинурия у больных с D/D-генотипом АПФ гена является неблагоприятным фактором и связана с более быстрым темпом прогрессирования заболевания у этих больных [11].
Р.Р. Калиев и соавт. (2004) обнаружили, что у больных ХГН с D/D-генотипом была значительно более высокая активность АПФ [20]. E. Sekerli и соавт. (2009) отметили, что D/D-генотип не является зависимым фактором риска развития склероза у детей с инфекцией мочевыводящих путей (ИМВП) и пузырно-мочеточниковым рефлюксом (ПМР) [21].
У людей с генотипом D/D АПФ выявляется повышенная активность АПФ и ангиотензина II. Последний в свою очередь стимулирует выработку склерозирующего цитокина – трансформирующего фактора роста (TGF-β1) [22–24]. Следовательно, имеющиеся данные литературы противоречивы в отношении роли D/D-генотипа АПФ в отношении развития той или иной патологии органов мочевой системы, но большинство исследований показало значение полиморфизма гена АПФ D/D в качества фактора риска прогрессирования нефропатий, влияние на тяжесть АГ и ухудшение у лиц с этим генотипом почечной выживаемости [25].
Рефлюкс-нефропатия (РН) относится к прогрессирующим нефропатиям, которые нередко приводят к развитию ХПН.
В Российском регистре по ХПН примерно 6% составляют дети с ПМР, осложненным РН [26]. По данным North American Pediatric Renal Transplant Cooperative Study (2010), в структуре причин хронической болезни почек (ХБП) до 57,6%, а по данным European Renal Association-European Dialysis Transplant Association (2012), до 22% занимают тубулоинтерстициальные болезни почек, ассоциированные с врожденными или наследственными уропатиями, рефлюкс-нефропатией [27, 28].
В связи с этим изучение роли полиморфизма генов АПФ в прогрессировании РН и развитии АГ важно для разработки методов вторичной профилактики и обоснования раннего начала терапии ингибиторами АПФ.
Целью настоящего исследования было изучение связи полиморфизмов гена ангиотензинпревращающего фермента у детей с формированием и прогрессированием рефлюкс-нефропатии, а также с мочевыми уровнями ангиотензина II и трансформирующего фактора роста β1 для обоснования ранней терапии ингибиторами ангиотензинпревращающего фермента.
Материал и методы
В нефрологическом и урологическом отделениях Центра матери и ребенка (Кишинев, Молдова) обследованы 94 ребенка с ПМР в возрасте от года до 14 лет (средний возраст – 5,69±0,44 года), из них 65 девочек (69,1%, χ²=6,72, p<0,05). Программа исследования пациентов с ПМР включала ультразвуковое исследование органов мочевой системы с допплерографией, статическую нефросцинтиграфию, клинические анализы крови и мочи, определение уровня мочевины и креатинина в крови, разовое измерение артериального давления. Скорость клубочковой фильтрации определялась по формуле Шварца, концентрационная функция почек – по пробе Зимницкого.
Степень ПМР оценивалась по результатам микционной цистографии согласно принятой в 1985 г. Международной классификации ПМР [29].

Для выявления рефлюкс-нефропатии и определения ее степени всем детям с ПМР была проведена статическая сцинтиграфия с ДМСА (димеркаптосукциновая кислота) в отделении ядерной медицины Республиканской клинической больницы (Кишинев, Молдова). Исследование проводилось не ранее чем через 3 месяца после последнего эпизода инфекции мочевой системы. Степень рефлюкс-нефропатии определена согласно классификации A. Piepsz и соавт. (2001) [26]: 1-я ст. – 1–2 рубца, 2-я ст. – 2–3 рубца с сохранной почечной паренхимой, 3-я ст. – очагово-диффузное распространение склеротических очагов с сохраненным почечным контуром, 4-я ст. – «маленькая», или атрофированная, почка [30].
В утренней моче определяли уровни AngII и TGF-β1 на биохимическом анализаторе «Униплан» (США) методом иммуноферментного анализа ELISA с использованием наборов фирмы «Human TGF-beta-1 Quantikine ELISA Kit» и «Human Angiotensin II Quantikine ELISA Kit» (Великобритания) в биохимической лаборатории Государственного Медицинского университета им. Н. Тестимицану (Кишинев, Молдова). Уровень AngII и TGF-β1 в моче пересчитывали на содержание креатинина в данной порции мочи (нг/ммоль креатинина). Все дети с ПМР на момент исследования мочевых уровней AngII и TGF-β1 находились в клинико-лабораторной ремиссии инфекции мочевой системы (пиелонефрита).
Всем детям проведено молекулярно-генетическое исследование полиморфизма гена АПФ (I/D) в лаборатории молекулярной генетики человека Центра репродуктивного здоровья и медицинской генетики, Кишинев, Республика Молдова
В качестве популяционного контроля для сравнения распределения генотипов и аллелей гена АПФ использовали выборку из 100 здоровых детей (82 д/18 м), представителей коренной этногруппы, средний возраст – 11,3±5,4 года.
Все участники исследования или их ближайшие родственники подписывали информационное согласие, подтверждающее добровольное участие в исследовании.
Молекулярно-генетические методы
Геномную ДНК экстрагировали из лимфоцитов периферической крови с помощью набора Qiagen Genta Puregene Kit. Полимеразная цепная реакция (ПЦР) проводилась в автоматическом термоциклере Eppendorf MastercyclerPro (Германия) с использовнием специальной программы: денатурация (94°С, 7 минут) и 35 циклов в режиме: 94°С – 40 секунд; 58°С – 45 секунд; 72°С – 1 минута [5].
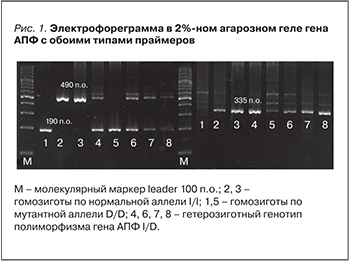
Для выявления присутствия аллеля I и D гена АПФ использовались праймеры (ACE I) по методике L. Tiret и соавт. [31]. Носители генотипа I/I идентифицировались по наличию полосы 490 п.о. (пар оснований). Гомозиготные носители по мутантной аллели генотипа D/D идентифицировались по наличию полосы 190 п.о. (рис. 1).
Кроме того, по методике S. Namazi и соавт. [32] для подтверждения наличия у пациентов с ПМР генотипа АПФ D/D проводился повторный анализ ПЦР с использованием праймеров (ACE D).
 Статистический анализ
Статистический анализ
Статистическая обработка результатов проведена по общепринятой методике вариационной статистики. Для проверки соответствия эмпирического распределения частот генотипов и аллелей в выборке больных и здоровых детей использовали критерий χ2 Пирсона [33].
Статистическая обработка полученных клинических результатов проводилась c использованием программы Statistica for Windows 6.0. с определением χ² и корреляционного анализа. Достоверными считались различия показателей при p<0,05.
Результаты и обсуждение
В исследование были включены 94 ребенка с различной степенью ПМР в возрасте от года до 14 лет (средний возраст – 5,66±0,38 года), из них 65 (69,1%) девочек (χ²=6,72, p<0,05).
У детей с ПМР преобладал генотип I/D (51 ребенок, 54,3%), реже выявлялся генотип D/D (28 детей, 29,8%) и наиболее редко – генотип I/I (15 детей, 15,9%). Среди детей с генотипом I/D и I/I большинство составили девочки (84,3 и 66,7% соответственно), а у мальчиков чаще выявлялся генотип D/D (57,1 против 42,9% соответственно p>0,05). Наиболее низкий средний возраст определен у детей с генотипом I/I (табл. 1).
Контрольную группу составили 100 здоровых детей (средний возраст – 11,3±5,4 года) без патологии ОМС в анамнезе. В контрольной группе также преобладали девочки (82%) (табл. 1).
При сравнительном анализе частот аллелей и генотипов полиморфизма гена АПФ в основной и контрольной группах не выявлено достоверных различий (табл. 2). Так, в группе контроля частота генотипа D/D составила 0,27, а среди пациентов с пузырно-мочеточниковым рефлюксом – 0,298% (χ2=0,90; DF=2; p=0,64).
ПМР I степени определен у 25 (26,6%) детей, ПМР II степени – у 22 (23,4%), ПМР III степени – у 18 (19,1%) и ПМР IV–V степеней – у 29 (30,9%) пациентов.
Выявлено, что у пациентов как с I, так и со II степенью ПМР частота генотипа АПФ I/I была выше по сравнению с IV–V степенями ПМР и, наоборот, при IV–V степенях ПМР чаще, чем при I степени ПМР, определялся генотип D/D (рис. 2).Суммарный анализ сравнения генотипов АПФ при легких (I–II) и тяжелых (III, IV и V) степенях ПМР показал, что у детей с тяжелыми степенями ПМР генотип D/D выявлялся чаще по сравнению с пациентами с низкими степенями ПМР (34 против 26%, χ²=5,51, p>0,05). Напротив, генотип I/I чаще выявлялся у пациентов с низкими, чем с тяжелыми, степенями ПМР (19 против 13%, χ²=2,12, p>0,05).
В группе детей с двусторонней локализацией ПМР генотип D/D выявлялся чаще, чем при одностороннем ПМР (37,5 против 24,1%, χ²=5,51, p>0,05).
Следовательно, для детей с генотипом D/D более характерны высокие степени ПМР и его двусторонняя локализация по сравнению с группой детей с генотипом I/I (рис. 2, 3).
По данным статической нефросцинтиграфии с ДМСА, РН выявлена у 82 (87,2%) детей с различной степенью ПМР.
В группе детей с ПМР без РН (12 детей, 12,8%, средний возраст – 2,71±0,63 года, 5 м/7 д) частота генотипа I/I составила 0,58, I/D – 0,42, а D/D не выявлена. В группе детей с РН I–II степеней (51 пациент, 54,3%, средний возраст – 5,52±0,49 года, 11 м/40 д) частота генотипа I/I составила 0,16% случаев, I/D – 0,61, и D/D – 0,23. В группе детей с РН III–IV степеней (31 пациент, 32,9%, средний возраст – 7,02±0,7 года, 13 м/18 д) генотип I/I не встречен, частота генотипов I/D и D/D составила 0,45 и 0,55 соответственно (табл. 3).
Таким образом, чем выше степень повреждения почечной паренхимы, тем чаще определялся генотип D/D и аллель D (20,8; 54 и 77,4% соответственно).
У всех детей с ПМР была определена гломерулярная функция почек, рассчитанная по формуле Шварца. Среднее значение СКФ у больных с ПМР в целом по группе составила 94,1±1,97 мл/мин/1,73 м², в т.ч. у больных с генотипом I/I гена АПФ уровень СКФ был 97,37±5,38 мл/мин/1,73 м², у больных с генотипом I/D – 96,1±2,64 мл/мин/1,73 м² (t=0,2, р=0,83) и у больных с генотипом D/D – 88,72±3,4 мл/мин/1,73 м² соответственно (t=1,69, р=0,094). Все пациенты были распределены на 2 группы: 28 пациентов – дети со сниженным уровнем СКФ (дети с ХБП II ст., менее 90 мл/мин/1,73 м²) и 66 пациентов – дети с нормальным уровнем СКФ (ХБП I ст.).
Установлено, что снижение СКФ имело место у половины детей с полиморфизмом АПФ D/D и редко у детей с полиморфизмом АПФ I/I (табл. 4).
У 62 пациентов (средний возраст – 5,66±0,38 года, 39 д/23 м) с ПМР была оценена тубулярная функция почек по пробе Зимницкого. В зависимости от состояния концентрационной функции почек пациенты были распределены на 2 группы: 22 (35%) ребенка с ПМР, у которых была выявлена гипостенурия, и 40 детей с нормостенурией.
Установлено, что снижение тубулярных функций почек имело место у 2/3 детей с полиморфизмом АПФ D/D, у трети – с полиморфизмом АПФ I/D и не определялось у детей с полиморфизмом АПФ I/I (табл. 5).
Мочевой уровень профиброгенных цитокинов, таких как AngII и TGF-β1, определен у 71 пациента (средний возраст – 5,26±0,64 года, 52 д/19 м) с ПМР. Известно, что данные цитокины участвуют в патогенезе развития тубулоинтерстициального фиброза, и доказано, что их мочевой уровень коррелирует со степенью нефросклероза. В работе Н.М. Зайковой и соавт. (2014) доказана прямая связь тяжести РН у детей с ПМР с мочевым уровнем AngII и TGF-β1 [34]. В работе И.В. Зорина (2014) отмечена высокая корреляционная связь между степенью тубулоинтерстициального повреждения, провоспалительными цитокинами и TGF-β1 в моче [35].

У детей с полиморфизмом гена АПФ D/D мочевой уровень AngII (108,27±15,11 нг/ммоль Cr) был значительно выше, чем у пациентов с генотипом I/D и особенно I/I (рис. 4). В группе детей с полиморфизмом гена АПФ D/D уровень AngII в моче был в 1,5 раза выше, чем у детей с генотипом I/D (p<0,05), и в 2,7 раза выше, чем у пациентов с генотипом I/I (p<0,01).
Мочевой уровень TGF-β1 (278,01±37,56 нг/ммоль Cr) был достоверно выше, чем у пациентов с генотипом I/I, достоверной разницы мочевого уровня TGF-β1 в группе детей с генотипом D/D и I/D не выявлено (рис. 4). Мочевой уровень TGF-β1 в группе детей с генотипом D/D в моче был в 1,31 раза выше, чем у детей с генотипом I/D (p>0,05), и в 2,2 раза выше, чем у пациентов с генотипом I/I (p<0,001).
Обсуждение
Ведущая роль в патогенезе прогрессирования заболеваний почек и развития нефросклероза принадлежит дисфункции РААС, что объясняет интерес к изучению генетических программ функционирования этой системы [36].
Частота генотипов гена АПФ (I/D) у больных ПМР достоверно не отличалась от группы контроля, что подтверждает отсутствие ассоциации с развитием заболевания. Проведенные сопоставления степени ПМР, тяжести РН, функционального состояния почек (фильтрационной и концентрационной), уровня профиброгенных цитокинов с генотипом АПФ убедительно показали, что для детей с генотипом D/D характерны более высокая степень ПМР, более тяжелая РН, чаще выявляется гипостенурия, снижение клубочковой фильтрации и достоверно выше мочевой уровень AngII и TGF-β1. В отличие от этого для пациентов с генотипом I/I более характерны низкие степени ПМР, легкие степени РН, редко наблюдается гипостенурия, снижение клубочковой фильтрации и в несколько раз ниже мочевой уровень AngII и TGF-β1.
Полученные результаты подтвердили предрасполагающую роль генотипа D/D гена АПФ к прогрессированию тубулоинтерстициальных изменений у больных ПМР, что соответствует результатам ранее проведенных исследований [37]. Y. Ohtomo и соавт. (2001), I. Haszon и соавт. (2002) определили тесную корреляционную связь между «маленькими» почками, рефлюксирующими мочеточниками и D/D-генотипом у детей с первичным ПМР и несомненную роль аллеля D в прогрессировании РН [38, 39]. В то же время R. Pardo и соавт. (2003), J. Dudley и соавт. (2202) не выявили связи между генотипом D/D и РН [40, 41].
В отличие от полученных нами данных E. Sekerli и соавт. (2009) показали слабую корреляционную связь между полиморфизмом генов АПФ и склерозированием почечной ткани у 186 детей с ПМР и ИМП, из которых 90 были с рефлюкс-нефропатией и 96 детей с ПМР без РН. Достоверной разницы между группами исследования и контрольной группой генотипа D/D авторами найдено не было. Авторы этого исследования свидетельствуют о том, что генотип D/D не является зависимым фактором риска развития почечного рубцевания у детей с ПМР и ИМП [42].
M. Kowalewska-Pietrzak и соавт. (2003) при исследовании 63 детей с ПМР IV степени и рецидивирующей ИМП, среди которых 21 (30%) пациент имел различную степень РН, так же как и в нашем исследовании, не нашли статистически значимых различий в распределении генотипа I/D гена AПФ между группами детей с ПМР и ИМП и здоровыми детьми. Авторы отметили, что полиморфизм гена АПФ не связан с ПМР. Однако в отличие от полученных нами данных авторами не обнаружено статистически значимой разницы наличия аллеля I/D в группе детей с РН и без РН. Тем не менее M. Kowalewska-Pietrzak и соавт. была определена высокая частота встречаемости D/D-аллеля (в 64% случаев) у детей с поражением почечной паренхимы, что может обосновать гипотезу, что этот генетический фактор играет важную роль в формировании почечного рубцевания [43].
А.В. Баранова и соавт. (2012) при обследовании 60 детей раннего и дошкольного возраста с тубулоинтерстициальными поражениями почек выявили ассоциацию развития данных заболеваний у детей c генотипом D/D. Установлено, что данный генотип является предрасполагающим фактором трансформации оксалурии в дисметаболическую нефропатию и тубулоинтерстициальный нефрит [37].
Выводы
- Не выявлено различий распределения генотипов АПФ между группой пациентов с ПМР и группой контроля. Однако у детей с тяжелыми степенями ПМР (IV–V) преобладал генотип D/D.
- D/D-генотип гена АПФ является независимым фактором риска развития и прогрессирования нефросклероза у детей с ПМР, о чем свидетельствует ассоциация данного генотипа с более высокой степенью ПМР, более тяжелой РН, более частым нарушением концентрационной и фильтрационной функциями почек и более значительным повышением мочевых уровней профиброгенных цитокинов (AngII и TGF-β1).
- Генотип I/I гена АПФ чаще определялся у больных с низкими степенями ПМР, не осложненными РН, с нормальной СКФ и нормостенурией.



