Введение
Патогенез артериальной гипертензии является многофакторным, однако к одной из ведущих его составляющих относится неспособность почками поддерживать гомеостаз натрия в организме [1, 2]. Общепризнанно, что одной из основных функций ренин-ангиотензин-альдостероновой системы (РААС) является регуляция водно-солевого гомеостаза: при этом в норме независимо от количества потребляемого с пищей натрия суммарный объем жидкости в организме человека и уровень АД существенно не меняются. Это достигается за счет того, что при избыточном потреблении натрия тенденция к росту АД сопровождается усилением почечного кровотока с последующим снижением секреции ренина, уменьшением активности РААС, нарастанием натрийуреза и диуреза. Установлено также влияние ангиотензина II (АT-II) на центральную нервную систему: известно, что при увеличении его концентрации в крови стимулируется ряд нейроэндокринных поведенческих реакций, например «солевой аппетит», а также синтез вазопрессина и окситоцина [3, 4]. При изучении влияния АT-II на клетки петли Генле было показано, что АT-II стимулирует 10-pS Cl-каналы в базолатеральной мембране петли Генле, что в свою очередь приводит к нарастанию АT-II-зависимой соль-чувствительности с усилением реабсорбции натрия в нефроне [5].
 Цель настоящего исследования – определение активности РААС, изменений центральной гемодинамики и выраженности задержки жидкости у пациентов, находящихся на высоко- и низкосолевой диете, а также сопоставление активности РААС у соль-чувствительных и соль-резистентных пациентов.
Цель настоящего исследования – определение активности РААС, изменений центральной гемодинамики и выраженности задержки жидкости у пациентов, находящихся на высоко- и низкосолевой диете, а также сопоставление активности РААС у соль-чувствительных и соль-резистентных пациентов.
Материал и методы
Исследование было проведено на базе ГБУЗ «Городская клиническая больница № 4» Департамента здравоохранения города Москвы в соответствии с правилами ICH GCP и было одобрено Этическим комитетом больницы.
В исследование были включены 103 пациента, из них 56 оказались соль-чувствительными, 47 – соль-резистентными.
Критерии включения в исследование: возраст > 18 лет; артериальная гипертензия (АГ) 1–2-й стадий; наличие признаков хронической сердечной недостаточности (ХСН); стабильная терапия в течение последних 3 месяцев; употребление поваренной соли > 6 г/сут; наличие подписанного информированного согласия пациента на участие в исследовании.
Критериями исключения считали тяжелые коморбидные состояния в стадии декомпенсации, скорость клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м2, рассчитанную по формуле Кокрофта–Голта; тяжелую или неконтролируемую артериальную гипертензию в период скрининга (систоличе ское АД > 180 мм рт. ст. и/или диастолическое АД > 110 мм рт. ст.); нефротический синдром; беременность или период лактации.
Все диагностические процедуры проводились в ходе теста M.H. Weinberger (1996) [6]: пациенты находились 5 дней на низкосолевой диете (до 100 ммоль/д), 5 дней – на высокосолевой диете (более 249 ммоль/д), при приросте среднего АД на 10 % констатировали соль-чувствительность. Прием соли контролировался по разработанным пищевым дневникам и по величине натрийуреза. Контроль соблюдения пациентами диеты проводился на основании анализа соответствующих показателей в утренней порции мочи, взятой после завершения периода высоко- и низкосолевой диеты. Концентрация АT-II определялась в плазме крови дважды: первый раз – по окончании 5 дней низкосолевой диеты, второй – по окончании высокосолевой диеты. Плазменную концентрацию АT-II определяли методом иммуноферментного анализа.

Показатели центральной гемодинамики определялись с помощью апланационной тонометрии на визите 2 и 3 с помощью артериографа TensioClinic. Измеряемыми параметрами были систолическое и диастолическое артериальное давление (АД) (Sys, Dia), среднее АД (MAP), пульсовое давление (РР), частота сердечных сокращений (НR), центральное АД (SХPao), индекс аугментации (AIx Хrachial), скорость пульсовой волны в аорте (PWV ао), длительность периода изгнания левого желудочка (ED). Нормативы пульсовой волны и индекса аугментации (ИА) приведены в табл.1. Измерение указанных показателей было полностью автоматизировано и компьютеризировано.
Определение объема жидкости в организме человека проводили на визитах 2 и 3 методом биоимпедансометрии с программным обеспечением ABC – 01 «Медасс».
Для определения уровня потребления пациентами соли на визитах в утренней порции мочи определялся уровень натрия и креатинина. Далее производили расчет суточного потребления натрия по формуле, предложенной T. Tanaka et al. (2002) [7]: XNa = SUNa/SUCr ×PRCr, где SUNa – натрий в утренней порции мочи, SUCr – креатинин в утренней порции мочи, PRCr – прогнозируемый креатинин.
PRCr – вычислялась по формуле: PRCr (мг/день) = -2,04 × возраст + 14,89 × вес (кг) + 1,14 × рост (см) − 2244,45.
Количество соли рассчитывалось по уравнению: 2300 мг натрия (Na) = 100 ммоль натрия (Na) = 5,8 г соли (NaCl).
Структура исследования представлена на рис. 1. Исследование включило несколько визитов.
Визит 1 (D0): скрининг пациентов, подписание информированного согласия, оценка соответствия пациентов критериям включения и исключения, назначение низкосолевой диеты.
Визит 2 (D5): забор крови для определения плазменной концентрации АT- II; определение экскреции натрия с мочой и расчет суточного натрийуреза; определение параметров центральной гемодинамики с расчетом среднего АД; проведение биоимпедансометрии для определения уровня жидкости; повторная оценка соответствия пациентов критериям включения/ исключения; назначение высокосолевой диеты.
Визит 3 (D10): забор крови для определение плазменной концентрации АT-II; определение экскреции натрия с мочой и расчет суточного натрийуреза; определение параметров центральной гемодинамики с расчетом среднего АД; проведение биоимпедансометрии для определения уровня жидкости; повторная оценка соответствия пациентов критериям включения/ исключения; определение соль-чувствительности.
Для статистической обработки полученных данных использовали программное обеспечение Statistica 6.1. При изложении результатов пользовались методами непараметрической и параметрической статистики. Количественные показатели представлены в форме среднее значение (M) ± стандартное отклонение (S) или медиана, 25-й и 75-й процентили. Для сравнения групп применялся критерий Вилкоксона. Статистически значимыми признавали значения р < 0,05.
Результаты и обсуждение
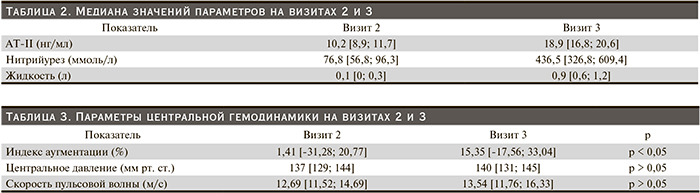
В табл.2 представлены результаты определения плазменного уровня АT-II, натрийуреза и общей жидкости на визите 2 и 3 (все данные представлены в виде медианы 25-го и 75-го перцентилей). Как видно из табл. 2, активность РААС, натрийурез и выраженность задержки жидкости различаются после периода соблюдения низкосолевой диеты и диеты с повышенным содержанием соли. В конце периода соблюдения низкосолевой диеты задержка жидкости фактически отсутствовала, а активность РААС была низкой. После периода соблюдения высокосолевой диеты наблюдается противоположный характер изменений: активность РААС была максимальной и медиана задержки жидкости составляла около 1 литра.
В табл. 3 представлены показатели центральной гемодинамики, оцененные на визите 2 и 3: как видно, после недели высокосолевой диеты значения всех параметров находятся за пределами нормального диапазона. Сопоставление значений параметров центральной гемодинамики с периодом соблюдения низкосолевой диеты выявило статистически достоверное различие в величине индекса аугментации.
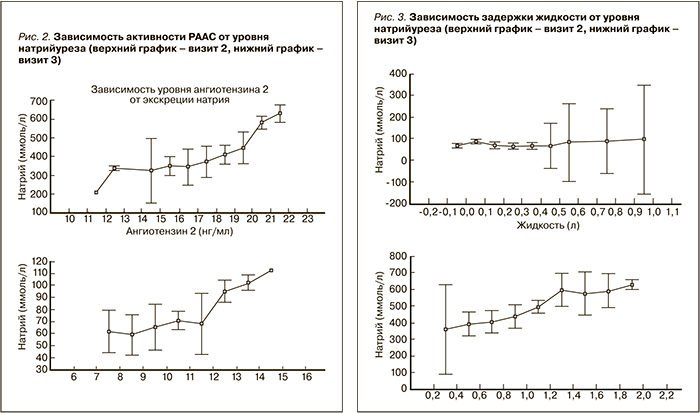
На рис. 2 представлена взаимосвязь активности РААС и натрийуреза, оцененная на визите 2 и 3. Как видно, активность РААС возрастает пропорционально увеличению натрийуреза, причем данная зависимость сохраняется также и в период соблюдения низкосолевой диеты.
На рис. 3 представлена зависимость выраженности задержки жидкости от экскреции натрия. На визите 2 (верхний график) задержка жидкости минимальна или отсутствует и довольно выражены колебания средних значений при увеличении уровня жидкости. Напротив, на визите 3 (нижний график) прослеживается четкая зависимость задержки жидкости от величины натрийуреза.
Рис. 4 демонстрирует связь параметров центральной гемодинамики с натрийурезом. По мере увеличения натрийуреза было отмечено достоверное нарастание индекса аугментации.
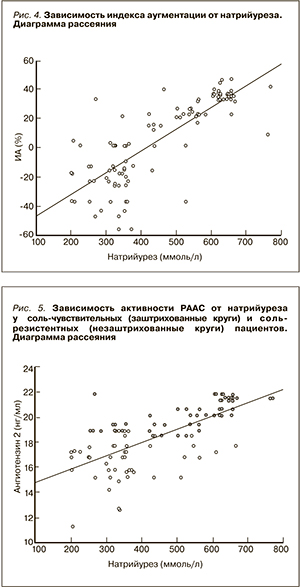
По результатам пробы M.H. Weinberger (1996) [6] все пациенты были разделены на соль-чувствительных и соль-резистентных. Сопоставление указанных групп больных показало (рис. 5), что активность РААС существенно выше среди соль-чувствительных, у которых также оказались существенно большими величины экскреции натрия с мочой.
 Общепризнанно, что активация РААС является одним из основных механизмов развития и прогрессирования артериальной гипертензии. Результаты ряда экспериментальных исследований продемонстрировали, что при увеличении образования АT-II нарастает инфильтрация Т-лимфоцитами тубулоинтерстициальной ткани (ТИТ) почки с одновременным увеличением продукции провоспалительных цитокинов. Данный патогенетический каскад свойствен в первую очередь соль-чувствительной артериальной гипертензии [8, 9]. Связь между соль-чувствительной артериальной гипертензией и поражением ТИТ четко установлена, например, при индуцированном лекарствами тубулоинтерстициальном нефрите, а также при поражении почечного тубулоинтерстиция у больных ВИЧ-инфекцией [10]. В эксперименте развитие соль-чувствительной артериальной гипертензии удавалось вызывать путем индукции воспаления в ТИТ почки; удавалось также и провоцировать поражение почечного тубулоинтерстиция с помощью избытка поваренной соли [11]. Связь между артериальной гипертензией и поражением почечной ТИТ опосредуется нарушениями почечной реабсорбции натрия [12].
Общепризнанно, что активация РААС является одним из основных механизмов развития и прогрессирования артериальной гипертензии. Результаты ряда экспериментальных исследований продемонстрировали, что при увеличении образования АT-II нарастает инфильтрация Т-лимфоцитами тубулоинтерстициальной ткани (ТИТ) почки с одновременным увеличением продукции провоспалительных цитокинов. Данный патогенетический каскад свойствен в первую очередь соль-чувствительной артериальной гипертензии [8, 9]. Связь между соль-чувствительной артериальной гипертензией и поражением ТИТ четко установлена, например, при индуцированном лекарствами тубулоинтерстициальном нефрите, а также при поражении почечного тубулоинтерстиция у больных ВИЧ-инфекцией [10]. В эксперименте развитие соль-чувствительной артериальной гипертензии удавалось вызывать путем индукции воспаления в ТИТ почки; удавалось также и провоцировать поражение почечного тубулоинтерстиция с помощью избытка поваренной соли [11]. Связь между артериальной гипертензией и поражением почечной ТИТ опосредуется нарушениями почечной реабсорбции натрия [12].
Основным компонентом РААС, действующим в почечных канальцах, является АT-II: в частности, в раде исследований было показано, что концентрация АT-II в почечной ткани выше, чем его концентрация в плазме крови [13]. Кроме того, установлено, что повышение концентрации АT-II в ткани почки обусловливает расстройства местной гемодинамики, функций нефронов, в дальнейшем – приводит к структурным изменениям почечной ткани [14, 15]. АT-II является одним из наиболее мощных антинатрийуретических факторов. Под действием АT-II реабсорбция натрия возрастает как вследствие изменений перитубулярного кровотока, так и за счет его прямого действия на эпителиальные транспортные клетки и усиления образования альдостерона [15].
Результаты проведенного нами исследования свидетельствуют о том, что плазменная концентрация АT-II, отражающая активность РААС, возрастает по мере увеличения натрийуреза; активность ее оказалась наибольшей именно среди соль-чувствительных пациентов. В зависимости от количества поваренной соли, потребляемого с пищей, менялась величина индекса аугментации, она также нарастала по мере увеличения концентрации АТ-II. Данную взаимосвязь можно объяснить тем, что АТ-II способствует увеличению выработки коллагена с одновременным угнетением синтеза эластина, что сопровождается нарастанием жесткости сосудистой стенки [16]. Зависимость между жесткостью сосудистой стенки и соль-чувствительностью продемонстрирована также и в других исследованиях [17]. В определенной степени она может быть объяснена также и тем, что избыток натрия угнетает продукцию оксида азота и таким образом обусловливает расстройство процесса эндотелий-зависимой вазодилатации [18]. Так, активность РААС взаимосвязана с потреблением натрия с пищей, задержкой жидкости и нарастанием индекса аугментации, что следует учитывать при выборе схемы терапии.



