Введение
Хроническая болезнь почек (ХБП) – общемировая проблема, связанная со значительной смертностью и заболеваемостью [1, 2]. Распространенность ХБП в общей популяции достигает 10% и более, что связано как с ростом сахарного диабета (СД) 2 типа и артериальной гипертензии (АГ) в развитых странах, так и другой почечной патологии в развивающихся странах [3, 4]. За два последних десятилетия смертность от ХБП повысилась на 82,3% и является третьей среди 25 основных причин смерти по темпам роста после СПИДа и СД [2]. Отмечается неуклонный рост популяции пациентов с терминальной почечной недостаточностью (ТПН), получающих заместительную почечную терапию (ЗПТ) [5].
 Аллотрансплантация почки (АТП) – оптимальный метод заместительной почечной терапии (ЗПТ), т.к. увеличивает продолжительность жизни больных в большей степени, чем перитонеальный и гемодиализ (ГД), обеспечивает более высокое качество жизни и оптимальный уровень медико-социальной реабилитации [6–10]. АТП является, кроме того, наиболее предпочтительным методом ЗПТ с экономической точки зрения [11, 12]. В настоящее время в мире ежегодно выполняют около 70 тыс. трансплантаций почки, при этом 5-летняя выживаемость больных и ренальных аллотрансплантатов (РАТ) достигает 80% и более [13, 14]. В то же время успехи клинической нефротрансплантологии относятся преимущественно к первым годам после операции, тогда как потери ренальных аллотрансплантатов (РАТ) в отдаленном периоде остаются значительными. По данным международных регистров доля таких потерь к 5 годам после АТП составляет 25–30%, а к 10–15 годам она возрастает почти до 50% [13–15]. Исследуются многие группы факторов, являющихся предиктором отдаленных результатов трансплантации почки: иммунологическая совместимость, тип донора и биологическое состояние донорского органа, возраст донора и реципиента, длительность периода консервации, коморбидная патология реципиента, инфекционные осложнения и др. [8, 9, 16, 17].
Аллотрансплантация почки (АТП) – оптимальный метод заместительной почечной терапии (ЗПТ), т.к. увеличивает продолжительность жизни больных в большей степени, чем перитонеальный и гемодиализ (ГД), обеспечивает более высокое качество жизни и оптимальный уровень медико-социальной реабилитации [6–10]. АТП является, кроме того, наиболее предпочтительным методом ЗПТ с экономической точки зрения [11, 12]. В настоящее время в мире ежегодно выполняют около 70 тыс. трансплантаций почки, при этом 5-летняя выживаемость больных и ренальных аллотрансплантатов (РАТ) достигает 80% и более [13, 14]. В то же время успехи клинической нефротрансплантологии относятся преимущественно к первым годам после операции, тогда как потери ренальных аллотрансплантатов (РАТ) в отдаленном периоде остаются значительными. По данным международных регистров доля таких потерь к 5 годам после АТП составляет 25–30%, а к 10–15 годам она возрастает почти до 50% [13–15]. Исследуются многие группы факторов, являющихся предиктором отдаленных результатов трансплантации почки: иммунологическая совместимость, тип донора и биологическое состояние донорского органа, возраст донора и реципиента, длительность периода консервации, коморбидная патология реципиента, инфекционные осложнения и др. [8, 9, 16, 17].
Целью настоящего исследования явилось изучение ряда посттрансплантационных предикторов исходов АТП.
Материал и методы
В исследование включены 350 пациентов, перенесших трансплантацию почки по поводу ТПН. Максимальный срок наблюдения после АТП достиг 352 месяца (29,3 года); средний срок наблюдения – 79,1±3,4, медиана – 68, стандартное отклонение (СО) – 6,9 месяца. Наблюдались 229 (65,4%) мужчин, женщин – 121 (34,6%). Возраст пациентов составил в среднем 37,1±0,6 года (12–61 лет, СО – 10,4, медиана – 38 лет).
Структура нозологических форм, приведших к ТПН, была следующей. Хронический гломерулонефрит диагностирован у 199 (50,9%) больных, врожденные заболевания почек и мочевыводящих путей – у 23 (5,9%), хронические тубулоинтерстициальные заболевания – у 17 (4,3%) больных. Диабетическая нефропатия (ДН) выявлена у 11 (2,8%) больных. Другие заболевания почек констатированы у 10 (2,6%) пациентов. Диагноз основного заболевания не был уточнен у 90 (23%) больных.
Средняя продолжительность диализа до АТП составила 26,6±1,3 месяца, СО – 21,3; максимум – 162 месяца (13,5 лет). Пять (1,43%) пациентов перенесли упреждающую трансплантацию почки. Трансплантаций с использованием трупного донора было выполнено 342 (97,7%), от живых родственных доноров – 8 (2,29%). Первичных АТП было 338 (96,6%), повторных – 12 (3,7%).

Использовано три протокола иммуносупрессивной терапии (ИМСТ): 1 – циклоспорин+преднизолон+азатиоприн (96 пациентов – 27,5%); 2 – циклоспорин+преднизолон+микофенолат (228 пациентов – 65,1%); 3 – такролимус+преднизолон+микофенолат (26 пациентов – 7,4%). В качестве индукционной ИМСТ в отношении 174 (44,5%) пациентов применялись блокаторы рецепторов интерлейкина-2 (БРИ): базиликсимаб – «Новартис Фарма», Швейцария, и даклизумаб – «Ф. Хоффманн-Ля Рош. Лтд.», Швейцария. Уровень циклоспорина-А (ЦсА) в крови измерен методом радиоиммунного анализа и флюоресцентного поляризационного иммуноанализа (Abbott TDX). Для определения концентрации такролимуса (Так) и ЦсА в крови использована также иммунохимическая методика (иммунохимический анализатор Архитект i2000 sr). Исследовалась концентрация ЦсА до утреннего приема препарата (С0-уровень) либо через 2 часа после утреннего приема (С2-уровень).
В ряде случаев изучен профиль фармококинетики препарата в период абсорбции (С0–С4-уровни) [18–22]. Концентрацию Так измеряли по С0-уровню препарата в крови [22, 23].
 Часть (208 человек – 59,4%) пациентов получала противовирусную терапию препаратами ганцикловир («Ф. Хоффманн-Ля Рош. Лтд.», Швейцария) и валганцикловир («Ф. Хоффманн-Ля Рош. Лтд., Швейцария) либо в качестве профилактики цитомегаловирусной инфекции (ЦМВ) – профилактическая противовирусная терапия (ППВТ), либо в качестве лечения манифестных форм ЦМВ-инфекции.
Часть (208 человек – 59,4%) пациентов получала противовирусную терапию препаратами ганцикловир («Ф. Хоффманн-Ля Рош. Лтд.», Швейцария) и валганцикловир («Ф. Хоффманн-Ля Рош. Лтд., Швейцария) либо в качестве профилактики цитомегаловирусной инфекции (ЦМВ) – профилактическая противовирусная терапия (ППВТ), либо в качестве лечения манифестных форм ЦМВ-инфекции.
Дисфункцию трансплантата констатировали по повышению значения креатинина сыворотки крови (Кр). При внезапном повышении Кр и отсутствии подозрений на какие-либо иные причины дисфункции установлен диагноз – острое отторжение (криз отторжения трансплантата – КОТ) и проведена «пульс-терапия» метилпреднизолоном (внутривенное введение препарата 3 дня подряд по 500–1000 мг). В отсутствие нормализации Кр после проведения «пульс-терапии» части пациентов проведено лечение поликлональными антилимфоцитарными препаратами (иммуноглобулин антитимоцитарный кроличий – «Джензайм Поликлоналс С.А.С.», Франция, и иммуноглобулин антитимоцитарный лошадиный – «Фармация и Апджон Компани», США).
Под отсроченной функцией трансплантата (ОФТ) понимали необходимость проведения ГД после АТП. Под хронической дисфункцией трансплантата (ХДТ) подразумевали нефропатию трансплантата, проявившуюся повышением Кр свыше 0,135 ммол/л в течение более 3 месяцев. Морфологическое состояние трансплантатов оценено согласно международной BANF-классификации [24].
Были изучены следующие неблагоприятные исходы АТП: 1 – смерть пациента, 2 – утрата РАТ (в т.ч. по причине смерти пациента с функционирующим трансплантатом) и 3 – развитие ХДТ. При анализе исхода ХДТ из расчетов не исключались пациенты, умершие с имевшейся дисфункцией трансплантата. Статус пациента обозначен либо цифрой «0» – жив, либо цифрой «1» – умер. Статус РАТ обозначен цифрой «0», если трансплантат функционировал, и цифрой «1», если не функционировал.
На момент проведения исследования живых пациентов с функционирующим трансплантатом было 114 (32,6%) человек; живых пациентов, утративших функцию трансплантата и вернувшихся на ГД, было 68 (19,4%); пациентов, имевших на момент исследования дисфункцию РАТ (а именно ХДТ), был 81 (23,1%) человек; умерших пациентов – 87 (24,9%).
Изучено влияние следующих посттрансплантационных факторов на исходы АТП: срок нормализации Кр, необходимость проведения диализа после АТП, КОТ, ИМСТ, данные лабораторных показателей в динамике (Кр, протеинурия, уровень АД, концентрация ингибиторов кальцинейрина в крови, содержание в крови гемоглобина, холестерина, альбумина и АЛТ), лабораторные маркеры вирусных инфекций (цитомегаловирус [ЦМВ] и вирус простого герпеса [ВПГ] 1-го и 2-го типов [25]), а также комплаентность пациентов, курение и трудовая реабилитация после АТП.
В качестве лабораторной диагностики ЦМВ либо ВПГ-инфекции использовался как метод полимеразной цепной реакции (ПЦР), так и серологический метод (иммуноферментный анализ с определением иммуноглобулинов класса G и M). Значения ПЦР (как для ЦМВ, так и для ВПГ) подразделяли следующим образом: 0 – отрицательное, 1 – <10² ген.коп/л (генетический копий на литр), 2 – ≥10²–≤104, 3 – ≥104.
АГ констатировали в соответствии с рекомендациями ВОЗ [26, 27] и подразделяли по степени контроля АД на 4 группы: 1-я группа – АГ отсутствует (АД≤120/80 мм рт.ст. без антигипертензивных препаратов, 2-я группа – АГ контролируется на цифрах АД≤140/90, 3-я группа – АГ контролируется на цифрах ≤160/100, 4-я группа – на фоне антигипертензивной терапии уровень АД>160/100.
Под комплаентностью («приверженность лечению») пациентов подразумевали осознанное стремление к сотрудничеству с врачом, выполнение медицинских рекомендаций. Для определения комплаентности пациента пользовались следующими критериями: отсутствие пропусков пациентом без уважительной причины плановых визитов к лечащему врачу-нефрологу; консультирование с лечащим врачом очно или по телефону при возникновении непредвиденной ситуации, связанной со здоровьем; знание пациентом названия принимаемых им препаратов (иммуносупрессанты, гипотензивные и др.), их назначения, режима приема и доз.

Для статистического анализа использовали пакет прикладных программ SPSS, версия 16 (SPSS Inc, США) [28]. К основным методам статистики относятся описательные статистики, методы сравнения средних величин, методы корреляционного анализа (Kendall), таблицы сопряженности, выживаемость (таблицы жизни, анализ по Kaplan–Meier), регрессионный анализ: логистический регресс (ЛР) и Кокс-регресс (КР). Статистически значимыми являлись значения р<0,05. Величина доверительного интервала (ДИ)=95%. Для оценки качества моделей ЛР использовался тест Hosmer–Lemeshow, моделей КР – Omnibus-тест.
Результаты исследования
А. Данные однофакторного анализа
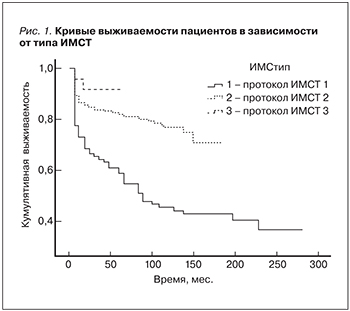
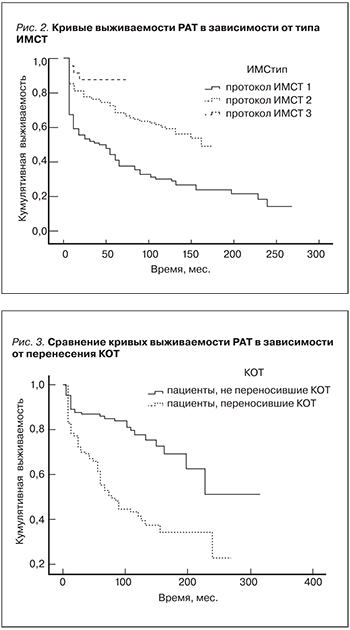
1. Иммуносупрессивная терапия. Протокол иммуносупрессивной терапии. Выживаемость больных была достоверно ниже при использовании протокола 1 (ЦсА+преднизолон+азатиоприн), чем при использовании протокола 2 (ЦсА+преднизолон+микофенолат), либо протокола 3 (Так+преднизолон+микофенолат) (р<0,001, Wilcoxon). Достоверного различия в выживаемости пациентов при применении протоколов 2 и 3 обнаружено не было (р=0,156, Wilcoxon). Показатели выживаемости и КВ пациентов в зависимости от исходного протокола ИМСТ представлены в табл. 1, 2 и на рис. 1, 2. Выживаемость РАТ при использовании протокола 1 была достоверно ниже, чем при использовании протокола 2, либо протокола 3 (р<0,001, Wilcoxon); рис. 2. Сравнение выживаемости РАТ при применении протокола 2 и 3 показало достоверно большую выживаемость РАТ при использовании протокола 3 (р=0,037, Wilcoxon). Развитие ХДТ коррелировало с использованием протокола ИМСТ-1 (к=-0,141, р=0,017; Kendall).
Индукция блокаторами рецепторов интерлейкина-2. Пациенты были разделены на 2 группы: группа 0 – не получившие индукции БРИ и группа 1 – получившие индукцию БРИ. Выживаемость пациентов и РАТ при применения БРИ были статистически значимо выше (р<0,001, Wilcoxon). Достоверной связи между использованием БРИ и развитием ХДТ обнаружено не было (к=-0,067, р=0,269; Kendall).
Мониторирование концентрации циклоспорина А. Выживаемость пациентов и РАТ при систематическом мониторировании концентрации ЦсА была значимо выше (р<0,001 для пациентов и РАТ; Wilcoxon). Имеется достоверная связь систематического определения концентрации ЦсА и развития ХДТ (к=-0,171, р=0,014; Kendall): отсутствие регулярного мониторирования концентрации ЦсА повышает риск ХДТ.
2. Функция и патология трансплантированной почки. Срок нормализации креатинина сыворотки и отсроченная функция трансплантата. У большей части пациентов Кр нормализовался в течение месяца после АТП – 201 (57,4%) пациент. У 28 (8%), пациентов Кр не нормализовался у 22 (6,3%) Кр нормализовался более, чем за месяц (у 19 – в течение 100 дней, у 3 – после 100 дней). Пациенты были разделены на 4 группы: 0 – Кр не нормализовался, 1 – Кр нормализовался менее чем за 10 дней, 2 – Кр нормализовался за 11–30 дней, 3 – Кр нормализовался более чем за 30 дней. Выживаемость больных и РАТ группы 3 была статистически значимо ниже, чем у пациентов 0-й, 1-й, и 2-й групп (р<0,001, Wilcoxon). Женщины имели нормальный уровень Кр после АТП достоверно раньше, чем мужчины (p=0,038; Mann–Whytney). Выживаемость пациентов, не нуждавшихся в проведении ГД после АТП, достоверно не отличалась от таковой пациентов с ОФТ (р=0,070; Wilcoxon). Выживаемость РАТ была достоверно выше в отсутствие ОФТ (р=0,012; Wilcoxon).
Уровень креатинина сыворотки. Выявлены статистически значимые связи (р<0,05; Kendall) статуса пациента и Кр в сроке 1, 108, 120, 132 месяца после трансплантации: чем больше уровень, тем больше риск для жизни пациента. Выявлены также значимые связи (р<0,05; Kendall) статуса РАТ и уровня Кр в сроке 1, 36, 48, 60, 72, 84, 96, 108, 120, 132, 156 месяцев после АТП: чем больше уровень, тем больше риск потери РАТ.
Протеинурия. Обнаружены достоверные связи (р<0,05; Kendall) статуса пациента и протеинурии в сроки 12, 24, 36, 48, 60, 72, 108 месяцев после АТП: чем больше уровень протеинурии, тем больше риск потери пациентов. Показано также наличие достоверных связей (р<0,05; Kendall) статуса трансплантата и протеинурии в сроки 6, 12, 24, 36, 48, 60, 72, 108 месяцев после АТП: чем больше значение протеинурии, тем больше риск потери РАТ. Выявлены достоверные связи протеинурии и ХДТ (р<0,05; Kendall) во все сроки после АТП.
Кризы отторжения трансплантата. В исследуемой когорте пациентов КОТ были диагностированы у 135 350 (38,6%) пациентов из 350. У 14 (10,4%) пациентов наблюдались повторные кризы. При помощи биопсии было подтверждено 42 КОТ (31,1%). Корреляционный анализ не выявил связей между фактом перенесения КОТ (к=0,088, р=0,136; Kendall), числом КОТ (к=0,086, р=0,142; Kendall) и жизнью пациентов. В то же время обнаружены значимые связи между фактом перенесения КОТ (к=0,316, р<0,001; Kendall), числом КОТ (к=0,313, р<0,001; Kendall) и статусом трансплантата. Выживаемость пациентов и трансплантатов была статистически значимо выше в отсутствие КОТ (р=0,034 – для пациентов, р<0,001 – для трансплантатов; Wilcoxon); рис. 3. Имеется достоверная связь факта перенесения КОТ (к=0,453, р<0,001; Kendall), числа КОТ (к=0,426, р<0,001; Kendall) и развития ХДТ.
3. Артериальная гипертензия. Корреляционный анализ показал статистически значимые связи статуса пациента и РАТ и уровня АД практически во все временные точки после АТП (р<005; Kendall): чем выше цифры АД, тем больше риск потери пациентов и трансплантатов. При сравнении выживаемости пациентов и РАТ в зависимости от уровня АД в срок 36 месяцев после АТП показано статистически достоверное различие в выживаемости пациентов и РАТ: наименьшие показатели выживаемости продемонстрировали пациенты с уровнем АД на фоне гипотензивной терапии >160/100 мм рт.ст. (р=0,024 для пациентов и р=0,05 для РАТ; Wilcoxon); табл. 3, 4. Практически во все сроки наблюдения после АТП выявлена значимая связь уровня АД и развития ХДТ (р<0,05; Kendall): чем выше уровень АД, тем выше риск развития ХДТ.
4. Уровень альбумина сыворотки крови. Установлено наличие достоверных связей (р<005; Kendall) статуса пациента и уровня альбумина в сроки 1, 3, 6, 9, 12, 24, 36, 48, 60, 72, 84, 96, 108, 144 месяца после АТП: чем меньше значение, тем больше риск смерти после АТП. Достоверные связи были обнаружены также между уровнем альбумина и статусом РАТ в сроки 1, 3, 6, 9, 12, 24, 36, 48, 60, 84, 108 месяцев после АТП: чем больше уровень альбумина, тем лучше прогноз для РАТ (р<005; Kendall). Обнаружены значимые связи уровня альбумина и развития ХДТ в сроки 3, 9, 54, 66, 90, 108 месяцев (р<005; Kendall) после АТП: чем ниже уровень, тем выше риск развития ХДТ.
5. Уровень АЛТ. Показано наличие статистически значимых связей статуса пациента и уровня АЛТ в сроки 1, 6, 12, 24, 36, 42, 48, 60 месяцев после АТП (р<005; Kendall): чем выше активность АЛТ, тем выше риск для жизни пациента. Обнаружены статистически достоверные связи статуса трансплантата и значения АЛТ в сроки 1, 6, 12, 24, 36, 48, 60 и 156 месяцев после АТП (р<005; Kendall): чем выше значения АЛТ, тем выше риск потери РАТ. Достоверной связи уровня АЛТ и развития ХДТ в разные сроки после АТП обнаружено не было (р<005; Kendall).

6. Уровень холестерина. Выявлена статистически достоверная связь статуса пациента и уровня холестерина в срок 36 месяцев после АТП (к=0,178, р=0,03; Kendall): чем выше уровень, тем больше риск смерти пациента. Обнаружены статистически достоверные связи статуса РАТ и уровня холестерина в сроки 12, 24, 36, 42 месяца после АТП (р<005; Kendall). Имеется связь ХДТ и уровня холестерина в сроке 114 месяцев (к=0,608, р=0,013; Kendall): чем выше уровень, тем выше риск развития ХДТ.
7. Анемия. Выявлены значимые связи статуса пациента и РАТ с уровнем гемоглобина в срок 1 месяц после операции (р<0,05; Kendall): чем ниже уровень гемоглобина, тем больше риск смерти пациента и потери РАТ. Обнаружены значимые связи уровня гемоглобина в сроки 60, 66, 72, 84, 102, 108 месяцев после АТП и ХДТ (р<005; Kendall): чем ниже уровень, тем больше риск развития ХДТ. Пациенты, которым понадобились гемотрансфузии после АТП, имели статистически значимо меньшие показатели выживаемости пациентов и РАТ (р<0,001 – для пациентов и РАТ; Wilcoxon). Развитие ХДТ коррелировало с фактом гемотрансфузий после АТП (к=0,252; р<0,005, Kendall) и их числом (к=0,269, р<0,002, Kendall).
8. Инфекции после АТП – влияние на исходы. Инфекции оказались основной причиной смерти пациентов после АТП в наблюдаемой когорте (28,7%) реципиентов. Выявлена связь статуса пациента (к=0,687, р<0,001, Kendall) и трансплантата (к=0,491, р<0,001, Kendall) и факта перенесения какой-либо инфекции после АТП.
Фатальные инфекции. Всего фатальных инфекций (ФИ) наблюдалось 29 случаев.
Структура их была следующей:
- пневмонии – 15 (51,72%) случаев;
- сепсис – 9 (31,03%) случаев;
- туберкулез – 4 (13,79%) случая;
- абсцесс легких – 1 (3,45%) случай.
Были выявлены статистически значимые связи (р<005; Kendall) между ФИ и следующими факторами: Кр через 9 месяцев после АТП (чем выше уровень, тем выше риск ФИ); систематическое мониторирование концентрации ЦсА (отсутствие систематического мониторирования увеличивает риск ФИ); концентрация ЦсА (С2-уровень) в сроки 1 и 3 месяца после АТП (чем выше концентрация ЦсА [С2-уровень], тем выше риск ФИ); начальная доза ЦсА (чем выше, тем выше риск ФИ); уровень протеинурии через 30 месяцев после АТП (чем выше уровень, тем выше риск ФИ); появление IgM-антител к ЦМВ в срок 42 месяца после АТП (связано с повышенным риском развития ФИ); появление IgG-антител к ЦМВ в срок 1 месяц после АТП (связано с повышенным риском развития ФИ); ВПГ-виремия в сроки 3 и 6 месяцев после АТП (повышает риск ФИ); наличие IgG-антител к ВПГ в срок 6 месяцев после АТП (увеличивает риск ФИ); появление IgМ-антител к ВПГ в сроке 42 месяца после АТП (повышает риск развития ФИ); профилактическая противовирусная терапия (снижает риск ФИ); срок диагностирования ХДТ (чем раньше развивается ХДТ, тем больше риск развития ФИ).

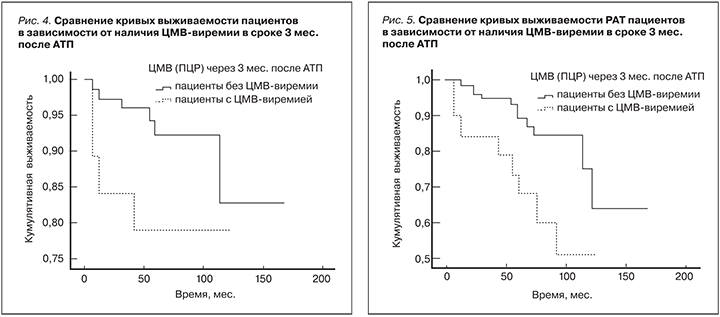
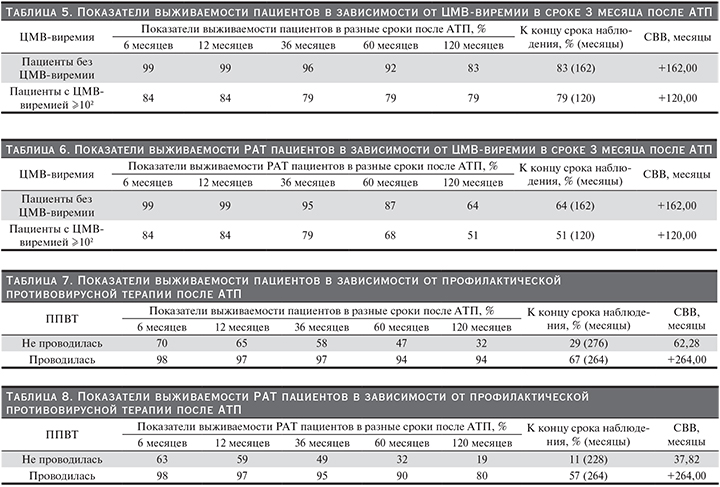
ЦМВ-инфекция. Выявлены связи статуса пациента и ЦМВ-виремии в сроки 30 (k=0,436, р=0,001) и 36 месяцев (k=0,303, р=0,012, Kendall) после АТП: чем выше титр ЦМВ, тем выше риск для жизни пациента. Выявлены достоверные связи статуса РАТ и ЦМВ-виремии в сроки 3 (k=0,271, р<0,006), 30 (k=0,594, р<0,001) и 60 месяцев (k=0,388, р=0,006, Kendall) после АТП: чем выше титр ЦМВ, тем выше риск потери РАТ. Показано статистически достоверное различие в выживаемости пациентов и РАТ между пациентами, у которых не определялась ЦМВ-виремия в срок 3 месяца после АТП, и пациентами, у которых определялась ЦМВ-виремия в титре ≥102 ген.коп./л (р=0,045 для пациентов, р=0,008 для РАТ; Wilcoxon); табл. 5, 6 и рис. 4, 5.
Серологические маркеры ЦМВ. Выявлены связи (р<005; Kendall) статуса пациента и наличия IgM-антител к ЦМВ в сроки 42, 48 и 54 месяца после АТП. Также были выявлены связи (р<005; Kendall) статуса РАТ и IgM-антител к ЦМВ в сроки 48 и 54 месяца. Появление IgM-антител к ЦМВ в данные сроки после АТП ассоциируется с повышенным риском для жизни пациентов и для РАТ. Не выявлено достоверных связей статуса пациента и РАТ и обнаружения IgG-антител к ЦМВ во все сроки наблюдения после АТП.
Вирус простого герпеса. Риск для жизни пациента был связан с ВПГ-виремией в сроки 3 (k=0,286; р=0,04) и 6 месяцев (k=0,195; р<0,001; Kendall) после АТП; а также с IgG-антителами в сроки 1 (k=-0,237; р=0,021) и 108 месяцев (k=-0,724; р=0,014; Kendall) после АТП (чем ниже титр IgG, тем выше вероятность смерти пациента). Риск потери РАТ был связан с ВПГ-виремией в сроки 3 (k=0,195; р=0,04) и 6 месяцев (k=0,228; р=0,032; Kendall) после АТП, а также с IgM-антителами к ВПГ в сроке 78 месяцев (k=0,681; р=0,011) после АТП. Обнаружение IgM к ВПГ связано с плохим прогнозом для РАТ и IgG-антителами к ВПГ в сроки 1 (k=-0,249; р=0,016) и 84 месяца (k=-0,43; р=0,033; Kendall) после АТП: чем ниже титр IgG, тем выше вероятность потери РАТ.
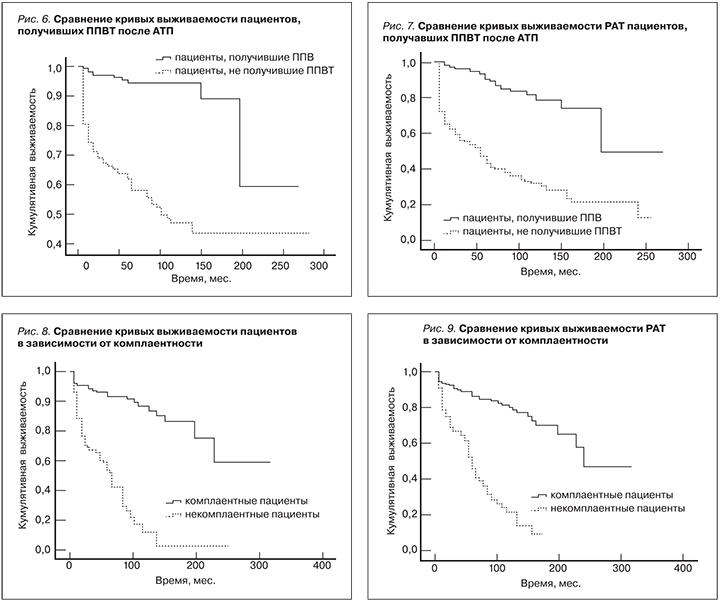
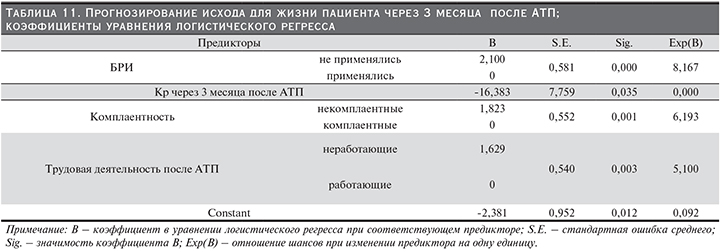
Профилактическая противовирусная терапия. Проведено сравнение 2 групп пациентов: 1-я группа – ППВТ не проводилась (n=75), 2-я группа – ППВТ проводилась (n=133). Выживаемость пациентов и РАТ была значимо выше во 2-й группе (р≤0,001 для пациентов и РАТ; Wilcoxon); табл. 7, 8 и рис. 6, 7.
9. Трудовая реабилитация пациентов. После АТП число работающих составило 161 (61,2%) человек и возросло по сравнению с периодом диализа более чем в 6,7 раза. Продолжительность жизни и функционирования трансплантатов была достоверно выше среди работающих после АТП (р<0,001 для пациентов и трансплантатов; Wilcoxon). Имеется достоверная связь трудовой деятельности после АТП и развития ХДТ (к=-0,26, р<0,001; Kendall): у неработающих после трансплантации риск развития ХДТ достоверно выше.

10. Курение. В исследуемой когорте пациентов до АТП курящих было 52 (14,8%) человека; при этом курящих мужчин – 22%, женщин – 1,7%. После операции часть пациентов оставили данную вредную привычку: курящих после АТП было 42 (12,0%) пациента. Одно-, 5-, 10-летняя выживаемость курящих пациентов была 90, 68, 64%, некурящих – 90, 86, 82% соответственно (р=0,032; Wilcoxon). Одно-, 5-, 10-летняя выживаемость трансплантатов курящих пациентов была 88, 52, 45%, некурящих – 88, 81, 60% соответственно (р=0,007; Wilcoxon). Выявлена связь курения и развития ХДТ (р<0,001; Kendall).
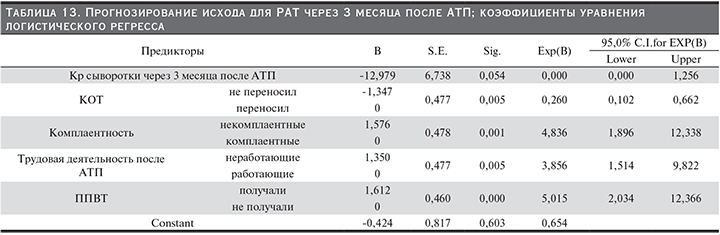
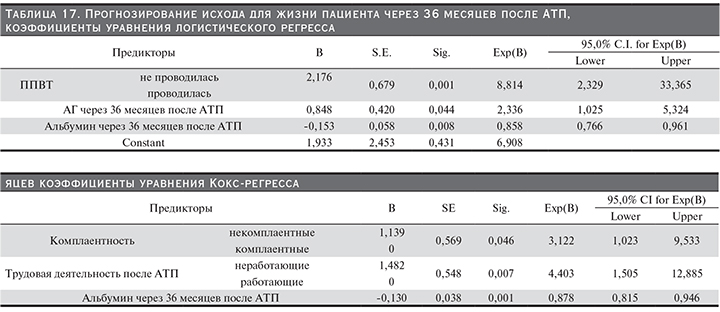
11. Комплаентность пациентов. Пациенты были разделены на 2 группы: 1-я – некомплаентные (n=90) и 2-я – комплаентные (n=157). Комплаентные пациенты имели достоверно лучшие показатели выживаемости пациентов и РАТ по сравнению с некомплаентными (р<0,001 для пациентов и РАТ; Wilcoxon); табл. 9, 10 и рис. 8, 9. Выявлены достоверные связи (р<005; Kendall) комплаентности пациентов и статуса пациентов и трансплантатов, а также ХДТ, КОТ и их числа. Чем ниже комплаентность пациентов, тем выше риск смерти пациентов, потери трансплантатов, развития ХДТ и КОТ. Кроме того, выявлены статистически достоверные связи комплаентности и факта курения: чем ниже степень комплаентности, тем выше вероятность курения пациента. Также выявлена достоверная связь комплаентности и факта трудовой деятельности пациента после АТП: чем выше комплаентность, тем выше вероятность благоприятной трудовой реабилитации реципиентов.
Б. Данные многофакторного анализа
Для построения моделей исходов АТП были взяты предикторы, полученные в однофакторном анализе.
1. Прогнозирование исходов через 3 месяца после АТП. Прогнозирование исхода для жизни пациента через 3 месяца после АТП. Построена модель ЛР прогноза, данные по которой представлены в табл. 12. Выявлены следующие предикторы смерти пациента через 3 месяца после АТП: индукция БРИ – использование БРИ снижает риск смерти, уровень Кр через 3 месяца после АТП: чем выше, тем выше риск смерти; комплаентность – комплаентные имеют меньший риск смерти; трудовая деятельность после АТП – работающие имеют меньший риск смерти.
Формула расчета вероятности смерти пациента через 3 месяца после АТП: y=-2,381+(2,1 – если не применялись БРИ, 0 – если не применялись)–16,383*гемоглобин+(1,823 – если некомплаентный, 0 – если комплаентный)+(1,629 – если неработающий, 0 – если работающий), P (смерть через 3 месяца после АТП)=exp(y)/(1+exp(y)), где y – вспомогательная расчетная характеристика: чем выше y, тем выше вероятность смерти (при y=0 вероятность смерти равна 50%); P (смерти) – вероятность смерти.
Данные модели КР для жизни реципиента представлены в табл. 12. Выявлено 4 предиктора для жизни пациента через
3 месяца после АТП: Кр через 3 месяца после АТП – чем выше, тем выше риск смерти; ППВТ – отсутствие противовирусной терапии ассоциируется с повышением риска смерти; комплаентность – некомплаентность повышает риск смерти; трудовая реабилитация – отсутствие трудовой деятельности после АТП повышает риск смерти через 3 месяца после АТП.
Прогнозирование потери РАТ через 3 месяца после АТП. Построена модель ЛР, данные по которой представлены в табл. 13. Выделено 5 предикторов потери РАТ через 3 месяца после АТП: Кр через 3 месяца после АТП – чем выше уровень, тем выше риск потери РАТ; КОТ – перенесение криза отторжения повышает риск потери трансплантата, комплаентность, трудовая деятельность после АТП – неработающие пациенты имеют больший риск потери РАТ, ППВТ – отсутствие противовирусной терапии повышает риск потери РАТ.
Формула расчета вероятности потери РАТ через 3 месяца после АТП: y=-0,424–12,979*Кр–(1,347 – если не переносил КОТ, 0 – если переносил КОТ)+(1,576 – некомплаентные, 0 – комплаентные)+(1,350 – если не работает после АТП, 0 – если работает)+(1,612 – если ППВТ не применялась, 0 – если применялась), P (потеря РАТ через 3 месяца после АТП)=exp(y)/(1+exp(y)).
Построена модель КР, данные по которой представлены в табл. 14. Выявлено 5 предикторов для РАТ через 3 месяца после АТП: срок нормализации Кр – чем позднее, тем выше риск потери РАТ, ППВТ – отсутствие повышает риск потери РАТ, КОТ и трудовая деятельность после АТП.
Прогнозирование риска развития ХДТ через 3 месяца после АТП. В модели ЛР (табл. 15) получено 5 предикторов развития ХДТ через 3 месяца после АТП: Кр через 3 месяца после АТП, КОТ, уровень АГ через 3 месяца после АТП – чем выше, тем выше риск развития ХДТ, уровень альбумина через 3 месяца после АТП – чем ниже уровень, тем выше риск развития ХДТ, комплаентность.
Формула расчета вероятности развития ХДТ через 3 месяца после АТП: y=2,705–14,580*Кр–(1,377 – если не переносил КОТ, 0 – если переносил КОТ)+0,92*АГ_3 месяца–0,114*Альбумин_3 месяца (1,008 – некомплаентные, 0 – комплаентные), P (развитие ХДТ через 3 месяца после АТП)=exp(y)/(1+exp(y)).
Модель КР (табл. 16) выделила 4 предиктора развития ХДТ через 3 месяца после АТП: отсроченная функция трансплантата – необходимость проведения ГД после операции, применение БРИ (снижает риск развития ХДТ), уровень Кр через 3 месяца после АТП – чем выше уровень, тем выше риск развития ХДТ, комплаентность – некомплаентные пациенты имеют больший риск развития ХДТ.
2. Прогнозирование исхода через 3 года после АТП
Прогнозирование исхода для жизни пациента через 3 года после АТП. Данные модели ЛР представлены в табл. 17. Выявлено 5 предикторов смерти пациента через 36 месяцев после АТП: ППВТ – отсутствие повышает риск смерти, АГ через 36 месяцев после АТП – чем ниже уровень, тем меньше риск смерти реципиента, уровень альбумина сыворотки через 36 месяцев после АТП – чем ниже уровень, тем выше риск смерти.
Формула расчета вероятности смерти через 36 месяцев после АТП: y=1,933+(2,176 – если ППВТ не проводилась, 0 – если проводилась)+0,848*АГ_36 месяцев–0,153*альбумин_36 месяцев, P (смерть через 36 месяцев после АТП)=exp(y)/(1+exp(y)).
В модели КР получено 3 предиктора исхода для жизни реципиента через 36 месяцев после АТП: комплаентность, трудовая деятельность после АТП, альбумин через 36 месяцев после АТП (табл. 18).
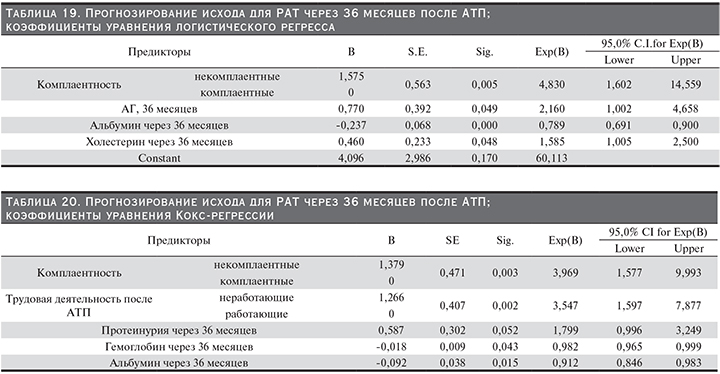
Прогнозирование потери РАТ через 3 года после АТП. При построении модели ЛР (табл. 19) получено 4 предиктора: комплаентность, уровень АГ через 36 месяцев после АТП – чем ниже уровень, тем меньше риск для РАТ, уровень альбумина сыворотки через 36 месяцев после АТП – чем ниже уровень, тем выше риск потери РАТ через 3 года после АТП, и уровень холестерина через 36 месяцев после АТП – чем выше, тем выше риск потери РАТ через 3 года после АТП.
Формула расчета вероятности потери РАТ через 36 месяцев после АТП: y=4,096+(1,575 – некомплаентные, 0 – комплаентные)+0,770*АГ_36 месяцев–0,237*альбумин_36 месяцев+0,460*хол_36 месяцев, P (потеря РАТ через 36 месяцев после АТП)=exp(y)/(1+exp(y)).
В модели КР (табл. 20) получено 5 предикторов потери РАТ через 36 месяцев после АТП: комплаентность, трудовая деятельность, уровень протеинурии через 36 месяцев после АТП – чем ниже уровень, тем меньше риск потери РАТ, уровень гемоглобина через 36 месяцев после АТП – чем ниже уровень, тем выше риск потери РАТ, уровень альбумина сыворотки через 36 месяцев после АТП – чем ниже уровень, тем выше риск потери РАТ через 3 года.
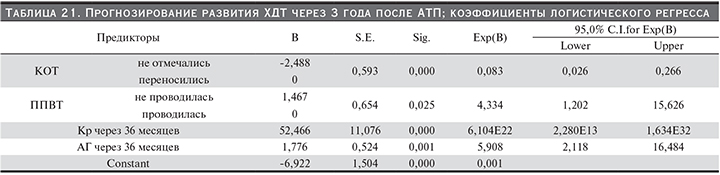
Прогнозирование развития ХДТ через 36 месяцев после АТП. Модель ЛР (табл. 21) вывила 4 предиктора развития ХДТ: кризы отторжения, ППВТ, Кр через 36 месяцев и уровень АГ через 36 месяцев после АТП.

Формула расчета вероятности развития ХДТ через 36 месяцев после АТП: y=-6,922–(2,488 – ППВТ проводилась, 0 – не проводилась)(2,176 – если ППВТ не проводилась, 0 – если проводилась)+52,466*Кр 1,776*АГ_36 месяцев, P (ХДТ через 36 месяцев после АТП)=exp(y)/(1+exp(y)).
В модели КР (табл. 22) получено 3 предиктора развития ХДТ через 36 месяцев после АТП: индукция БРИ, уровень Кр через 36 месяцев после АТП, уровень протеинурии через 36 месяцев после АТП.
Обсуждение
Отечественные и зарубежные исследователи изучают исходы трансплантации почки [29]. И.Г. Ким и соавт. (2012) [30] при сравнении результатов АТП использования протоколов ИМСТ на основе циклоспорина и такролимуса показали, что выживаемость реципиентов через 3 года после АТП составила 95,3% в группе больных, получавших ЦсА, и 89,9% в группе, базовым компонентом ИМСТ которой был Так (p<0,12). Выживаемость РАТ в те же сроки составила 94,3 и 91,7% соответственно (p<0,6). По данным А.С. Webster и соавт. [31], сравнение протоколов на основе ЦсА и Так показало, что через 6 месяцев после АТП потери трансплантатов были значительно ниже в группе Так (RR=0,56, ДИ=0,36–0,86). Через 1 год после АТП в группе пациентов, получавших Так, было меньше эпизодов острого отторжения (RR=0,49, ДИ=0,37–0,64), но больше СД, требующего применения инсулина (RR=1,86, ДИ=1,11–3,09). Не было обнаружено различий в частоте инфекций и малигнизаций в группах.
Данные D.G. Opelz [13] демонстрируют преимущества ИМСТ на основе сочетания ингибиторов кальцинейрина с микофенолатами по сравнению с протоколом на основе ЦсА и азатиоприна. При использовании протокола ЦсА+азатиоприн 1-летняя выживаемость РАТ была – 87%, 3-летняя – 81%, тогда как при использовании протокола ЦсА (Так)+микофенолат выживаемость трансплантатов была: 1-летняя – 92%, 3-летняя – 87%. Мы также обнаружили достоверное улучшение выживаемости РАТ при использовании ИМСТ на основе ингибиторов кальцинейрина+микофенолат по сравнению с ЦсА+азатиприн. Сравнение выживаемости РАТ пациентов при использовании протокола на основе Так и ЦсА показало достоверно большую выживаемость трансплантатов при использовании протокола с Так (р=0,037, Wilcoxon): 1- и 5-летняя выживаемость РАТ при использовании протокола на основе Так составила 96%, на основе ЦсА – 82 и 69%.
Проведенный нами анализ продемонстрировал необходимость мониторирования концентрации ЦсА во все сроки после АТП. В отсутствие возможности регулярного мониторинга концентрации ЦсА возрастал риск как смерти пациентов, так и потери и дисфункции РАТ. С низкими концентрациями ЦсА в ранние сроки после АТП ассоциировались потери трансплантатов, с повышенными концентрациями – потери как пациентов, так и РАТ. По-видимому, это отражает то, что основные потери пациентов происходят от инфекций, обусловленных в т.ч. излишней иммуносупрессией. Кроме того, нефротоксичность ингибиторов кальцинейрина вносит свой вклад в потери, связанные с дисфункцией РАТ.
ОФТ обусловлена повреждением почки во время консервации, а также реперфузионным повреждением после пуска кровотока («ишемически-реперфузионное повреждение»). Морфологические изменения, которые развиваются при этом в трансплантате, имеют картину острого канальцевого некроза. Вклад в данное состояние могут вносить предсуществующие изменения в почке донора: «возрастная» почка, острое почечное повреждение во время реанимации, патология донорской почки [32–36]. Большая часть исследований свидетельствует об отрицательной роли ОФТ для его дальнейшей судьбы [37, 38]. М. Zukowski и соавт. [39] в однофакторном анализе показали достоверно более короткое функционирование РАТ в группе реципиентов с повышенным уровнем Кр во все периоды после операции и у пациентов с ОФТ. Продолжительность диализа после АТП и число процедур ГД оказали значимое влияние на выживаемость РАТ в сторону ее ухудшения. Согласно полученным нами данным, ОФТ имела существенное влияние на результаты АТП: продолжительность жизни пациентов, которые не нуждались в проведении ГД после АТП, и выживаемость их трансплантатов были достоверно выше.
Острое отторжение является критическим фактором риска долговременной выживаемости РАТ [38, 40, 41]. К. Akioka и соавт. [42] привели данные исследования, в котором из 916 пациентов 532 (58,0%) имели острое отторжение. Пяти- и 10-летняя выживаемость трансплантатов у реципиентов с острым отторжением были 75,2 и 55,2% соответственно.
У пациентов без острого отторжения 5- и 10-летняя выживаемость была 80,2 и 70,6% соответственно. Выживаемость РАТ была хуже у реципиентов с поздним отторжением и множественными эпизодами отторжения (р<0,00006). S. Coupel и соавт. [43] показали, что для долговременной выживаемости второго трансплантата кроме DR-несовпадений значимым предиктором служит число эпизодов острого отторжения. По нашим данным, выживаемость пациентов и РАТ были значимо выше в отсутствие КОТ (р<0,05; Wilcoxon). Имелась достоверная связь КОТ, числа КОТ и развития ХДТ (р<0,001; Kendall).
Значение АГ для результатов АТП показано во многих исследованиях [44–46]. В исследовании К. Akioka [42] из 367 пациентов 151 (41,5%) имел систолическую гипертензию через 3 года после АТП. Пяти- и 10-летняя выживаемость РАТ пациентов с гипертензией были 85,6 и 64,7% соответственно. Показатели 5- и 10-летней выживаемости пациентов, не имеющих гипертензии, были 95,6 и 83,8% соответственно. Выживаемость РАТ пациентов с АГ была статистически достоверно ниже выживаемости пациентов без гипертензии (р<0,001). Согласно полученным нами данным, АГ коррелировала с неблагоприятными исходами АТП как для пациентов, так и для РАТ практически во все сроки наблюдения. В срок 3 года после АТП выявлена достоверная разница выживаемости пациентов и РАТ в зависимости от степени контроля АГ: наименьшие показатели выживаемости наблюдались у пациентов с уровнем АД на фоне гипотензивной терапии >160/100 мм рт.ст. (р<0,05; Wilcoxon). Сравнение 2 групп пациентов – с уровнем АД в сроке 36 месяцев после АТП≤140/90 мм рт.ст. и с уровнем АД >140/90 мм рт.ст. показало, что пациенты 1-й группы имеют значимо лучшую выживаемость (р<0,05; Wilcoxon, Log Rank). Таким образом, согласно полученным данным, целевым уровнем АД после трансплантации можно считать уровень ≤140/90 мм рт.ст. По данным многофакторного анализа АГ через 3 месяца после АТП служит предиктором развития ХДТ, а через 36 месяцев после АТП – предиктором как смерти, так и потери РАТ и развития ХДТ.
Нарушение липидного обмена связано с исходами АТП [47–49]. J.I. Roodnat и соавт. [47] показали роль холестерина через год после АТП в когорте 676 реципиентов как независимого предиктора как для пациентов, так и для РАТ.
M.F.S. Carvalho и V. Soares [50] доказывают, что гипертриглицеридемия ассоциируется с дисфункцией трансплантата.
К. Akioka и соавт. [42] продемонстрировали, что из 451 реципиента через 3 года после АТП 176 (39,0%) имели гиперхолестеролемию. Пяти- и 10-выживаемость трансплантатов у пациентов с гиперхолестеролемией были 88,7 и 68,7% соответственно. В то же время реципиенты без гиперхолестеролемии имели данные показатели на уровне 95,2 и 83,9% соответственно (р=0,003). В проведенном нами исследовании гиперхолестеринемия выступила предиктором исходов АТП как в однофакторном, так и в многофакторном анализе. Обнаружены связи уровня холестерина и статуса пациента в сроке 36 месяцев после АТП и статуса РАТ с 12-го по 42-й месяца после АТП. В модели логистического регресса холестерин оказался значимым, независимым предиктором потери трансплантата через 3 года после АТП (р=0,028).
Диагностика вирусных инфекций, имеющих широкое распространение среди пациентов после трансплантации органов, играет большое значение в предупреждении осложнений [51, 52]. Риск вирусных инфекций среди реципиентов РАТ определяется прежде всего приемом ИМСТ, возможностью инфицирования при операции. Трансплантация почки от ЦМВ-позитивного донора ассоциируется со значительным уменьшением выживаемости трансплантата у серонегативных реципиентов [53, 54]. По данным нашего исследования, ЦМВ-виремия в разные сроки после АТП ассоциировалась со смертью пациентов и потерями РАТ. Выживаемость пациентов и РАТ при обнаружении ЦМВ-виремии в сроке 3 месяцев после операции была значимо ниже. Кроме того, положительные IgM-антитела к ЦМВ преимущественно в поздние сроки после АТП ассоциировались с неблагоприятными исходами (развитие ХДТ, потеря РАТ, смерть). Инфицированность вирусом простого герпеса, определяемая ПЦР-методом в сроке 3 и 6 месяцев после АТП также была связана с неблагоприятными исходами операции. Было доказано положительное значение ППВТ для улучшения результатов АТП. При сравнении двух групп пациентов, получавших и не получавших профилактическую противовирусную терапию, оказалось, что выживаемость пациентов и РАТ в отсутствие таковой была достоверно ниже (р≤0,001; Wilcoxon). ППВТ через 3 месяца явилась значимым предиктором для жизни пациента и трансплантата, а также развития ХДТ через 36 месяцев после АТП.
В доступной для нас литературе встретилось небольшое число публикаций, посвященных вопросам трудовой реабилитации пациентов после трансплантации почки. D.L. Manninen и соавт. в исследовании 1991 г. [55], включившем 226 пациентов, пришли к выводу, что исход АТП служит предиктором возможности трудиться после операции. Авторы отметили, что утрата функции трансплантата сопряжена с потерей возможности сохранения трудовой активности. Наши данные вполне согласуются с этим. В исследовании K.F. Chau.. и соавт. [56] показано, что пациенты после трансплантации почки имеют лучший статус занятости и социальной реабилитации по сравнению с пациентами на перитонеальном или ГД. Число пациентов, работавших после АТП, достигло 60%, тогда как на перитонельном диализе их было около 50%, а на ГД не более 40%. После трансплантации почки число работающих в нашей когорте реципиентов составило 64%, что совпадает с данными K.F. Chau и соавт. Продолжительность жизни и функционирования трансплантатов была достоверно выше среди работающих после АТП (р<0,001; Wilcoxon).
Табак, жертвами которого в мире ежегодно становятся более 5 млн человек, остается основной причиной смертей, которые можно было бы предотвратить [57]. По данным С.А. Бойцова [58], распространенность курения в России составляет 57,8%, при этом среди мужчин – 43,9%, среди женщин – 13,9%. Данные, полученные в национальной выборке в 1992 г., показали, что распространенность курения среди мужчин старше 15 лет составляла 60%, среди женщин того же возраста – 9% [59]. Согласно Глобальному опросу взрослого населения о потреблении табака, Российская Федерация, 2009 [57], в целом 39,1% (43,9 млн человек) взрослого населения РФ оказались постоянными курильщиками. Среди мужчин постоянных курильщиков – 60,2% (30,6 млн), среди женщин – 21,7% (13,3 млн). Курящих пациентов в исследуемой нами когорте было 52 (14,8%) человека, при этом курящих мужчин – 22%, женщин – 1,7%. Таким образом, в исследуемой когорте число курящих была ниже, чем в общей популяции в России. Распространенность курения среди нашей когорты пациентов была также меньше, чем среди пациентов в исследовании В. Kasiske и D. Klinger, – 24,7% [60]. Возможно, данные различия объясняются тем, что мы не учитывали т.н. иногда курящих (прибегающие к курению не ежедневно), которые сами часто не относят себя к курящим субъектам. В части исследований сообщалось о недостатке данных для определения связи курения и прогрессирования дисфункции РАТ [61, 62]. В то же время имеются данные о связи курения и судьбы пациентов и РАТ. Так, когортное исследование 645 взрослых реципиентов почечного трансплантата, прооперированных с 1985 по 1995 г., обнаружило связь исходов АТП и курения [63]. На момент АТП курили 24% реципиентов; из них 90% продолжили курить после пересадки. Среди наших пациентов также лишь 12% прекратили курить после операции.
F.P. Hurst и соавт. (2011) провели изучение влияния курения на результаты трансплантации почки ретроспективно в когорте 41 705 взрослых реципиентов почечного трансплантата базы данных USRDS [64]. По сравнению с пациентами, которые никогда не курили после АТП, пациенты, пережившие инциденты курения после пересадки, имели повышенный риск смерти (RR=2,32; ДИ=1,98–2,72; р<0,001) и потери РАТ (RR=1,46; ДИ=1,19–1,79; р<0,001).
Нам представляется важным, что обнаружена достоверная связь курения и факта развития ХДТ. Эти данные могут свидетельствовать как о непосредственном повреждающем воздействии курения на трансплантированную почку, так и об опосредованном неблагоприятном влиянии (курение взаимосвязано и с другими предикторами исходов АТП: альбумин, гемоглобин, комплаентность). Можно утверждать, что отказ от курения увеличит шансы благоприятных исходов АТП.
Некомплаентность пациентов после трансплантации почки, по признанию ряда исследователей, – распространенное явление и приводит как к нежелательным клиническим последствиям, включающим смерть, потерю трансплантата и отторжение, так и значительное повышение расходов на лечение [65–67]. К. Denhaerynck и соавт. приводят в обзоре 2005 г. [68] цифру распространенности данного явления от 2 до 67%, в среднем – 30%. В анализируемой группе мы также обнаружили распространенность некомплаентности на уровне 34%. Некомплаентность ассоциируется с неблагоприятными клиническими исходами: снижение выживаемости как пациентов, так и РАТ (достигнув 16% причин потерь трансплантатов). Мы получили данные, согласно которым 10-летняя выживаемость комлаентных пациентов после АТП составляет 86%, некомплаентных – 48%. Еще большая разница получена для 10-летней выживаемости РАТ. Для трансплантатов комплаентых пациентов она составила 76%, некомплаентных – 26%.
Н. Vlaminck и соавт. [69] показывают, что в группе некомплаентных пациентов частота эпизодов позднего острого отторжения составила 21,2%, в группе комплаентных – 8% (р<0,05). Согласно нашим данным, некомплаентность также ассоциировалась с КОТ (р<0,01). Согласно проведенному нами многофакторному анализу, комплаентность через 3 месяца после АТП является достоверным предиктором исхода для жизни пациента, функционирования РАТ и развития ХДТ. Через 3 года после АТП комплаентность явилась предиктором для жизни и РАТ.
Заключение
Имеется ряд посттрансплантационных факторов, влияющих на результаты АТП. В ряду наиболее значимых из них: отсроченная функция трансплантата, иммуносупрессивная терапия, систематическое мониторирование концентрации ЦсА, протеинурия, кризы отторжения, противовирусная терапия, уровни в крови креатинина, альбумина, гемоглобина, холестерина, АЛТ, а также артериальная гипертензия, комплаентность пациентов, курение, трудовая реабилитация.
В многофакторном анализе определены следующие предикторы исходов АТП:
- через 3 месяца после операции:
- для жизни пациента: применение БРИ, уровень Кр через 3 месяца после АТП, ППВТ, комплаентность и трудовая реабилитация;
- для РАТ: срок нормализации и уровень Кр через 3 месяца после АТП, кризы отторжения, ППВТ, комплаентность и трудовая реабилитация;
- для развития ХДТ: применение БРИ, проведение ГД в послеоперационном периоде, уровень в крови Кр и альбумина через 3 месяца после АТП, КОТ, уровень АГ через 3 месяца после АТП;
- через 3 года после АТП:
- для жизни пациента: ППВТ, комплаентность и трудовая реабилитация, а также уровень альбумина крови через 3 месяца после АТП, как и уровень АГ через 3 месяца после операции;
- для РАТ: уровень в крови альбумина, холестерина, гемоглобина через 3 года после АТП, протеинурия через 3 года, а также уровень АГ, комплаентность и трудовая реабилитация;
- для развития ХДТ: применение БРИ и противовирусной терапии, уровень Кр и протеинурии через 3 года, кризы отторжения, а также уровень АГ через 3 года после АТП.
Выявленные предикторы вносят значимый вклад в исходы АТП и требуют как тщательного мониторирования, так и коррекции с целью улучшения результатов АТП.
Работа Солодушкина С.И. поддержана грантом РНФ 14-35-00005 и программой 02.A03.21.0006 от 27.08.2013.
Остальные авторы заявляют об отсутствии конфликта интересов.

