Введение
Ежегодно отмечается неуклонный прирост больных с терминальной стадией хронической почечной недостаточности, нуждающихся в заместительной почечной терапии. Трансплантация почки остается оптимальным методом лечения таких пациентов. К преимуществам трансплантации почки относятся увеличение продолжительности жизни пациентов, значительное улучшение ее качества, а также заметное снижение затрат на оказываемую им медицинскую помощь [1]. Начиная с 1990-х гг. показатель годичной выживаемости почечных аллотрансплантатов (ПАТ) в нашей стране превышает 80 %, что соответствует международным нормативам. Благодаря достижениям хирургической трансплантологии, совершенствованию протоколов иммуносупрессивной терапии, ранней диагностике посттрансплантационных осложнений выживаемость и пациентов, и почечных трансплантатов за последние годы увеличилась. При этом серьезной проблемой в клинической трансплантологии остаются поздние осложнения посттранстплантационного периода – сердечно-сосудистые, инфекционные, а также хроническая трансплантационная нефропатия, в итоге приводящие к потере почечного трансплантата [2]. Помимо иммунологических факторов, способствующих ухудшению функции ПАТ в отдаленном периоде, существенную неблагоприятную роль играют также артериальная гипертензия, дислипидемия, гипергликемия, ожирение [3–7].
Сочетание артериальной гипертензии, дислипидемии, гипергликемии и абдоминального ожирения объединены международными комитетами экспертов в широко используемое сегодня понятие метаболического синдрома (МС). Согласно данным, публикуемым Всемирной организацией здравоохранения, в индустриальных странах распространенность метаболического синдрома среди лиц старше 30 лет составляет 10–20 %, например в США – 25 %. По результатам исследования T. Elahi et al. (2009) [8], распространенность МС среди пациентов после трансплантации почки в течение первого года составляла 4,5 %, в интервале между 1-м и 5-м годами после трансплантации этот показатель достигал уже 41,3 %.
Хорошо известно, что МС является фактором высокого риска развития ишемической болезни сердца (ИБС), других сердечно- сосудистых заболеваний, а также сахарного диабета (СД) 2 типа. К формированию метаболического синдрома предрасполагают некоторые генетические детерминанты, снижение уровня физической активности и избыточное потребление высококалорийной пищи, приводящие к развитию ожирения. Важную роль в патогенезе осложнений МС безусловно играют дислипопротеидемия и инсулинорезистентность (ИР), при которых реакция инсулин-чувствительных тканей к его действию заметно снижается, что неизбежно влечет за собой интенсификацию продукции этого гормона и повышение его концентрации в крови. Развивающаяся при этом компенсаторная гиперинсулинемия вначале поддерживает углеводный обмен на физиологическом уровне. В дальнейшем при срыве компенсаторных механизмов она способствует развитию ткань-деструктивных фибротических и пролиферативных реакций. Неблагоприятная прогностическая роль ИР почти всегда дополняется расстройствами обмена липопротеидов – увеличением сывороточной концентрации общего холестерина (ОХС), липопротеидов низкой (ЛНП) и очень низкой (ЛОНП) плотности, триглицеридов с одновременным снижением уровня липопротеидов высокой плотности [10].
Применение современных иммуносупрессивных препаратов привело к значительному улучшению выживаемости как реципиентов почечных трансплантатов, так и самих трансплантатов. Тем не менее многие из иммуносупрессивных препаратов, входящих в стандартные протоколы ведения пациентов, которым была выполнена трансплантация почки, оказывают негативное влияние на углеводный, липидный и пуриновый обмены, что обусловливает дополнительные трудности в контроле МС для данной категории больных. При этом следует специально подчеркнуть, что терапевтическое воздействие на составляющие метаболического синдрома является принципиально важным с точки зрения улучшения прогноза пациентов, перенесших трансплантацию почки, с позиций как увеличения продолжительности функционирования почечного трансплантата, так и управления риском сердечно-сосудистых осложнений. Целью настоящего исследования стало изучение частоты метаболических нарушений в раннем послеоперационном периоде после трансплантации почки.
 Материал и методы
Материал и методы
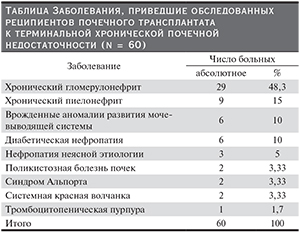
В условиях отделения пересадки почки и поджелудочной железы НИИ скорой помощи им. Н.В. Склифосовского Департамента здравоохранения г. Москвы были обследованы 60 пациентов (из них 36 мужчин и 24 женщины) в течение 30 суток после трансплантации почки. Возраст пациентов варьировался от 20 до 70 лет (в среднем 40,1 года). Спектр заболеваний, приведших к развитию терминальной хронической почечной недостаточности, представлен в таблице.
Все пациенты получали стандартную трехкомпонентную поддерживающую иммуносупрессивную терапию: ингибиторы кальцийнейрина (такролимус – Програф, Адваграф), производные микофеноловой кислоты (микофеноловую кислоту – Майфортик, микофенолата мофетил – Селлсепт), глюкокортикостероиды (преднизолон). С целью профилактики острого отторжения ПАТ использованы анти-CD25 моноклональные антитела (базиликсимаб – Симулект).
Диагностика МС осуществлена с учетом:
- индекса массы тела (ИМТ): при ИМТ 25,0–29,9 кг/м 2 констатировали избыточную массу тела, при ИМТ 30,0–34,9кг/м2–ожирение I степени, при ИМТ 35–39,9 кг/м2 – ожирение II, при ИМТ > 40 кг/м2 III степеней;
- тощаковой гликемии: нарушение толерантности к глюкозе диагностировали, если она составляла > 6,1 ммоль/л, через 2 часа после еды < 10 ммоль/л; у части пациентов наблюдался СД 2 типа, требовавший постоянной пероральной сахароснижающей и или инсулинотерапии;
- показателей, характеризующих обмен липопротеидов: ОХС > 5,5 ммоль/л, ТГ > 1,7, ЛПВП < 1,0, ЛПНП > 3,0 ммоль/л;
- уровня АД > 135/80 мм рт. ст. и/или постоянной потребности в антигипертензивных препаратах.
Кроме того, учитывали наличие гиперурикемии, которую констатировали при концентрации мочевой кислоты в сыворотке крови > 432 мкмоль/л.
С целью коррекции МС всеми пациентами использовались в период пребывания в стационаре, кроме того, им рекомендовались при выписке немедикаментозные методы (низкокалорийная и бессолевая диета, дозированные аэробные физические нагрузки, отказ от курения) и лекарственные препараты (антигипертензивные, пероральные сахароснижающие, статины).
Результаты и обсуждение
Средняя масса тела обследованных реципиентов почечного трансплантата составила 75,7 ± 17,2 кг. У 16 (26,7%) из них диагностирована избыточная масса тела: у 11 (18,3%) – ожирение I, у 3 (5%) – II степеней. Пациентов с ожирением III степени в исследуемой группе не было.
У значительной части обследованных были зарегистрированы расстройства углеводного обмена. Тощаковая гипергликемия выявлена у 15 (25%) реципиентов почечного трансплантата; средняя величина гликемии в данной группе составила 7,8 ± 1,29 ммоль/л. Всем этим больным проведена медикаментозная коррекция углеводного обмена – четырем из них была назначена инсулинотерапия, двоим – пероральные сахароснижающие препараты, в отношении девяти величиной тощаковой гликемии удавалось управлять с помощью диетических мероприятий.
У 30 (50%) реципиентов почечного трансплантата были выявлены нарушения липидного обмена: увеличение сывороточной концентрации ОХС до 6,7 ± 1,1 ммоль/л, ТГ – до 2,3 ± 0,8, ЛПНП – до 2,74 ± 0,50, а также снижение уровня ЛПВП до 1,01 ± 0,15 ммоль/л. Пациенты с нарушениями липидного обмена получали статины и к ним была применена гиполипидемическая диета с ограничением количества потребляемых животных жиров и сахаросодержащих пищевых продуктов, введением в пищевой рацион растворимой клетчатки (зерновые продукты), нежирных сортов мяса или морской рыбы.
Наличие артериальной гипертензии отмечено у 45 (75 %) пациентов. С первых суток после трансплантации почки всем этим больным назначена антигипертензивная терапия: чаще всего использовалась комбинация антагонистов кальция с бета-адреноблокаторами.
Среди пациентов 24 (40 %) продемонстрировали четкую тенденцию к гиперурикемии: средняя величина концентрации мочевой кислоты у них составила 556 ± 83 мкмоль/л. Следует подчеркнуть, что гиперурикемию в настоящее время рассматривают как метаболическое нарушение, четко ассоциируемое с ИР, нарастающее по мере прогрессирования МС и имеющее самостоятельное значение в патогенезе поражения его органов-мишеней.
Таким образом, результаты проведенного нами обследования реципиентов почечного трансплантата свидетельствует, что уже в раннем (не более 30 суток) периоде после вмешательства среди большинства из них регистрируются метаболические нарушения. Очевидно, что при применении многих из иммуносупрессивных препаратов, используемых в качестве медикаментозной защиты функции почечного трансплантата, данные метаболические нарушения (инсулирезистентность, дислипопротеидемии, ожирение) могут существенно усугубляться. В связи с этим уже в раннем послеоперационном периоде реципиенты почечного трансплантата нуждаются в использовании немедикаментозных и лекарственных (антигиперлипидемические, антигипертензивные, сахароснижающие препараты) методов, направленных на коррекцию метаболических расстройств, целью которых является увеличение продолжительности функционирования почечного трансплатата и снижение риска сердечно-сосудистых осложнений.



