Опухоль в трансплантате – достаточно редкое явление: по данным литературы, распространенность колеблется в пределах 0,19–0,5% [1, 2]. Еще в 1995 г. I. Penn отметил, что непосредственно на трансплантат приходится лишь 1/10 часть злокачественных опухолей почек у реципиентов, хотя в целом распространенность злокачественных новообразований (ЗНО) всех локализаций в этой группе выше [3].
Как отмечает D. Xiao, если речь идет именно о трансмиссии опухоли, то чаще всего реципиент «получает» опухоль почки. Авторы работы проанализировали 104 случая подтвержденной трансмиссии опухоли: 20% – злокачественных новообразований почки, 17% – меланомы, 14% – лимфомы, 9% – легкого, 6% – глиобластомы, 5% – хориокарциномы, 23% – другие злокачественные новообразования. Тем не менее исследователи отмечают, что при трансмиссии опухоли почки отмечен наиболее благоприятный исход для пациента: более 70% пациентов жили как минимум 24 месяца после получения трансплантата, для меланомы и рака легкого этот показатель оказался ниже 50%. В абсолютном большинстве (85%) случаев опухоль почки была локализованной, в то время как при выявлении меланомы, лимфомы или рака легкого в 80–90% случаев процесс был метастатическим [4].
 F. Gomez-Veiga et al., анализируя данные по 79 случаям de novo опухолей трансплантата, отмечают меньшую агрессивность этих новообразований по сравнению с общей популяцией. Учитывая относительную благоприятность прогноза при выявлении опухоли в трансплантированной почки, авторы считают возможным лечить этих пациентов так же, как если бы они были «обычными» больными. То есть отказаться от трансплантатэктомии, которая существенно ухудшает качество жизни и требует перевода на гемодиализ, повторной постановки в лист ожидания и ретрансплантации. В будущем стоит ожидать увеличения таких пациентов с учетом как увеличения возраста донора и реципиента, так и длительной медианы времени от трансплантации до выявления de novo опухоли трансплантированной почки (около 11 лет) [5].
F. Gomez-Veiga et al., анализируя данные по 79 случаям de novo опухолей трансплантата, отмечают меньшую агрессивность этих новообразований по сравнению с общей популяцией. Учитывая относительную благоприятность прогноза при выявлении опухоли в трансплантированной почки, авторы считают возможным лечить этих пациентов так же, как если бы они были «обычными» больными. То есть отказаться от трансплантатэктомии, которая существенно ухудшает качество жизни и требует перевода на гемодиализ, повторной постановки в лист ожидания и ретрансплантации. В будущем стоит ожидать увеличения таких пациентов с учетом как увеличения возраста донора и реципиента, так и длительной медианы времени от трансплантации до выявления de novo опухоли трансплантированной почки (около 11 лет) [5].
По данным литературы, при выявлении опухоли в трансплантате чаще всего проводится трансплантатэктомия. Проспективные данные о возможности органосохраняющего лечения в таких случаях отсутствуют. Многие специалисты считают, что если опухоль обнаружена в пересаженной почке через несколько лет после трансплантации, то стандартная тактика – немедленное удаление трансплантата. Такое единство мнений объясняется как небольшим числом пациентов с почечным трансплантатом по сравнению другими странами, так и неудовлетворительным состоянием системы мониторинга пациентов с пересаженной почкой – во многих случаях пациенты просто «исчезают» из поля зрения врачей и перестают наблюдаться.
В 1997 г. V. Krishnamurthi и A.C. Novick описали успешное излечение после резекции у пациентки с наличием в пересаженной почки двух очагов почечно-клеточного рака (ПКР) спустя 18 лет после трансплантации, отметив благоприятные онкологические и функциональные результаты операции. Последующие годы ознаменовались накоплением опыта и сопровождались публикацией ряда единичных наблюдений или результатов небольших серий, указывающих на допустимость и безопасность данного подхода [6]. D. Chambade et al. (2008) представили результаты лечения пяти пациентов с ПКР размерами от 1,5 до 3 см, указав на 100%-ную выживаемость без рецидива и отсутствие снижения функции трансплантата при медиане наблюдения 17,4 месяца [7].
В 2014 г. опубликованы результаты мультицентрового исследования, оценившие исходы органосохраняющего лечения 43 пациентов с ПКР в трансплантате. Показанием к резекции считалось кортикальное расположение опухоли и размер <4 см.
 При медиане наблюдения 35,2 месяца не выявлено ни одного рецидива, а отсутствие значимого ухудшения почечной функции отмечено у 41 (95,3%) пациента [8].
При медиане наблюдения 35,2 месяца не выявлено ни одного рецидива, а отсутствие значимого ухудшения почечной функции отмечено у 41 (95,3%) пациента [8].
Li et al. доложили о больной, у которой через 11 лет после трансплантации почки, по данным УЗИ, в трансплантате была выявлена опухоль размером до 3,3 см, крайне подозрительная в отношении ПКР. Несмотря на стандартную в данном случае тактику – удаление трансплантата, они выполнили органосохраняющее лечение, опубликовав в 2009 г. результаты трехлетнего наблюдения: рецидив и необходимость в заместительной почечной терапии отсутствовали [9].
По данным исследования испанских ученых, включившего 41 случай de novo ПКР (до 5 см) в аллографте, при медиане наблюдения 37,5 месяцев сохранная функция трансплантата имела место у 65,9% больных. У одного пациента через три года после операции выявлены рецидив и локальное прогрессирование опухоли, по поводу чего была выполнена трансплантатэктомия. Авторы отметили низкую морбидность и продолжительность госпитализации после органосохраняющего лечения [10]. Чуть позже R. Gonzalez-López et al. обобщили данные о 51 случае резекции пересаженной почки с опухолью, также отметив хорошие результаты: выживаемость трансплантата составила 88%, частота рецидивов – 6%. Авторы указали, что у 77% пациентов с опухолью в трансплантате режим иммуносупрессии включал циклоспорин А, отметив, что его замена на ингибитор m-TOR может быть адекватной дополнительной лечебно-профилактической мерой [11].
В обзоре литературы был суммирован опыт органоуносящего и органосохраняющего лечения уже 201 de novo новообразования в функционирующем трансплантате, отметив, что в общем данная патология характеризуется низкой специфической смертностью (2,6%), имевшей место при наличии распространенного ПКР. По их мнению, агрессивность опухолей в трансплантате ниже, чем в общей популяции, и при технической возможности органосохраняющее лечение, в т.ч. радиочастотная абляция и криоабляция, должно быть методом выбора [12].
Достоверно неизвестно происхождение опухолей в трансплантате: они могут быть переданы от донора, могут иметь метастатический характер при опухолях нативных органов реципиента, а также представлять собой de novo почечно-клеточный рак, развивающийся уже после трансплантации.
В литературе встречаются противоположные мнения, в которых результаты генетического анализа указывают как на донорский генез ПКР в пересаженной почке, так и на его развитие из клеток реципиента [13, 14].
Также отсутствуют рекомендации относительно ведения пациента после резекции трансплантата. Предполагается, что в течение 3–6 месяцев пациент должен пройти базовое обследование брюшной полости и грудной клетки (компьютерная томография и магнитно-резонансная томография, КТ или МРТ), В дальнейшем ультразвуковое исследование, КТ или МРТ должны проводиться каждые 6 месяцев в течение как минимум трех лет [15].
Приводим краткое описание случая возникновения и успешного лечения почечно-клеточной карциномы в пересаженной почке через 23 года после трансплантации.
Б о л ь н а я М. 1959 г.р. поступила в отделение 13.10.2014. с диагнозом: Злокачественное новообразование донорской почки.
В 1990 г. диагностирован хронический диффузный гломерулонефрит, ХПН-II. С 1992 г. отмечено повышение АД до 180/100 мм рт.ст. Сr крови 1250 ммоль/л. Ur 46,3 ммоль/л. Гиперкалиемии нет. С сентября 1992 г. начато лечение систематическим гемодиализом. Гр. крови АВ(IV) пол. НвSAg пол.
 В ноябре 1992 г. выполнена трансплантация правой донорской почки. Смерть донора наступила от ЧМТ. Назначена 3-компонентная имуносупрессия: ЦиклоспоринА 3 мг/кг, азатиоприн 200 мг/сут, преднизолон 35 мг/сут, в/в капельно вводился метилпреднизолон, суммарная доза которого (включая интраоперационное применение) составила 2,25 г. Послеоперационный период осложнился ОКН трансплантата в течение 10 суток, что потребовало проведения 4 сеансов гемодиализа. К 11-м суткам наступило восстановление диуреза до 2500 мл. Выписана домой в удовлетворительном состоянии через 35 суток после операции. Креатинин сыворотки крови при выписке – 0,07–0,08 ммоль/л. Hb – 98 г/л.
В ноябре 1992 г. выполнена трансплантация правой донорской почки. Смерть донора наступила от ЧМТ. Назначена 3-компонентная имуносупрессия: ЦиклоспоринА 3 мг/кг, азатиоприн 200 мг/сут, преднизолон 35 мг/сут, в/в капельно вводился метилпреднизолон, суммарная доза которого (включая интраоперационное применение) составила 2,25 г. Послеоперационный период осложнился ОКН трансплантата в течение 10 суток, что потребовало проведения 4 сеансов гемодиализа. К 11-м суткам наступило восстановление диуреза до 2500 мл. Выписана домой в удовлетворительном состоянии через 35 суток после операции. Креатинин сыворотки крови при выписке – 0,07–0,08 ммоль/л. Hb – 98 г/л.
В 2014 г. через 22 года после трансплантации почки при плановом обследовании при УЗИ выявлено гипоэхогенное округлое образование в нижнем полюсе трансплантата. 11.09.2014 выполнено КТ брюшной полости. В правой подвздошной области определена донорская почка. Паренхима почки несколько утолщена. В нижнем полюсе трансплантата визуализируется объемное образование пониженной плотности с четкими, ровными контурами диаметром 31 мм. Образование занимает всю толщу паренхимы донорской почки, распространяется экстраренально, деформируя латеральный контур почки, и переднее латеральной поверхностью тесно прилежит к внутренней поверхности брюшной стенки (рис. 1).
Больная была госпитализирована для оперативного удаления опухоли трансплантата с диагнозом: Хронический гломерулонефрит, ХПН-III, аллотрансплантация трупной почки от 1992 г., хроническая трансплантационная нефропатия, вторичный иммунодефицит, папиллярная карцинома ренального трансплантата. Поскольку опухолевый узел не более 3 см, расположен периферически, в нижнем полюсе трансплантата и кровообращение в трансплантате хорошее, функция трансплантата удовлетворительная, планируется выполнение органосохраняющей операции (энуклеации опухолевого узла или резекции нижнего полюса трансплантата).
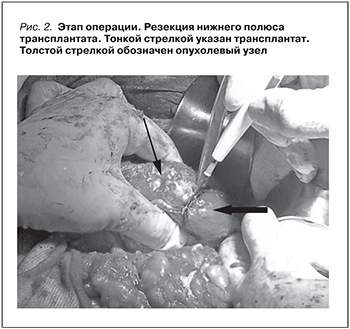
22.10.2014 выполнена операция: резекция нижнего полюса трансплантированной почки (рис. 2).
На операции выявлено, что в нижнем полюсе имеется округлое опухолевидное образование диаметром около 3 см, расположенное частично экстраренально и вплотную подходящее к воротам почки. После мануального обжатия паренхимы, отступив от края опухоли на 0,5 см, произведен циркулярный окаймляющий разрез электроножом. В дальнейшем опухоль вместе с участком паренхимы была выделена и удалена.
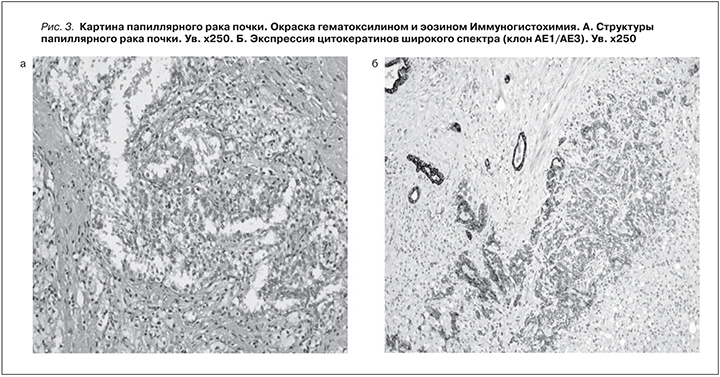
Гистология от 22.11.2014. № 47297/07. В резецированной ткани трансплантированной почки обширный очаг некроза, по периферии которого обнаружены обширные очаги продуктивного воспаления с обилием ксантомных клеток, часть которых многоядерная. Под утолщенной фиброзированной капсулой обнаружены небольшие очаги почечноклеточной карциномы папиллярного варианта I типа, инвазии псевдокапсулы опухоли не обнаружено (рис. 3). Резекция опухоли произведена в пределах здоровых тканей, практически по псевдокапсуле некротизированного опухолевого узла. Картина папиллярного рака почки. Данные ИГХ (иммуногистохимии): клетки опухоли экспрессируют цитокератины широкого спектра (клон АЕ1/АЕ3, рис. 3Б), виментин, АМСАR, РАХ8, слабо – ЭМА; Ксантомные клетки экспрессируют CD68, клетки обильного лимфоидного инфильтрата – общий лейкоцитарный антиген (CD45). С помощью CD68 иCD45 в окружающей ткани выявляются масса ксантомных клеток и клеток моноцитарно-макрофагального ряда, а также обильный лимфоидный инфильтрат. Заключение: картина и иммунофенотип папиллярного рака почки.
Поставлен окончательный диагноз: Папилярноклеточный рак нижнего полюса трансплантированной почки низкой степени злокачественности, рTI, N0,M0. Фурман I, Cтадия I.
Диурез 2000 мл, рост 160 см, вес 63 кг, мочевина 5,3 ммоль/л; креатинин 0,04 ммоль/л, креатинин мочи 3,6 ммоль/л, суточная протеинурия 0,3 г, СКФ 130 мл/мин. Концентрация циклоспорина А в крови 138 нг/мл. Пациентка была выписана из урологического стационара 13.11.2014 в удовлетворительном состоянии. С января 2015 г. была начата конверсия на препарат группы ингибиторов пролиферативного сигнала: назначен эверолимус, отменен микофенолат натрия, снижена доза циклоспорина А. Назначен также аторвастатин для коррекции гиперлипидемии. Функция трансплантата остается удовлетворительной (креатинин сыворотки 0,08–0,1 ммоль/л), протеинурия минимальна. В дальнейшем с целью вторичной профилактики онкологических осложнений планируется полная отмена циклоспорина и продолжение иммуносупрессии двумя препаратами – эверолимусом и преднизолоном.
Представленное наблюдение иллюстрирует вероятность возникновения опухоли пересаженной почки в позднем (через 23 года) посттрансплантационном периоде отлично функционирующего ренального трансплантата. Показана возможность сохранения почечного трансплантата, несмотря на раковое поражение пересаженного органа. Судить о том, является ли возникшая опухоль из клеток донора или реципиента, не представляется возможным из-за давности возникновения процесса. Поскольку новообразование появилось через 23 года после трансплантации, с большой вероятностью можно предположить возникновение опухоли из самих клеток реципиента под воздействием длительно существующей иммуносупрессии.
Органосохраняющее лечение – стандартный подход не только при небольших новообразованиях собственных почек, но и при злокачественной опухоли в трансплантате. Пациенты с опухолью в трансплантате встречаются редко, однако в данном случае на кону стоит не только онкологический результат, но и функция пересаженного органа. Потерять хорошо функционирующую пересаженную почку из-за опухоли – серьезное физическое и психологическое испытание для больного. Следование онкологическим клиническим рекомендациям и выполнение органосохраняющего оперативного вмешательства – оптимальный подход, имеющий потенциал для решения обеих дилемм.
Одна из главных проблем для трансплантации почки – и трансплантации в целом – это несоответствие между числом реципиентов и гораздо меньшим количеством органов, необходимых для трансплантации. Как следствие – больные с почечной недостаточностью должны ждать в течение длительного времени аллотрансплантат. В связи с этим во многих трансплантационных центрах дискутируется крайне важный вопрос о возможности трансплантации донорской почки пораженной опухолью. По причине нехватки доноров во многие трансплантационные программы были внесены коррективы, согласно которым можно осуществлять трансплантацию донорских органов при продолжительности без рецидивного периода более 5 лет после проведения лечения по поводу злокачественного новообразования. После чего произвести тщательную оценку риска/пользы – соотношении риска передачи злокачественного новообразования и пользы от трансплантации по жизненным показаниям. На сегодняшний день имеются описания успешной трансплантации почек после полного иссечения почечно-клеточного рака с низкой степенью злокачественности и небольших размеров [16].
В информированном согласии, подписываемом реципиентом перед трансплантацией, должна содержаться информация о наличии у донора в анамнезе злокачественного новообразования. В послеоперационном периоде реципиент должен регулярно наблюдаться у онколога [17, 18].
Проанализированы 43 больных, которым выполнена трансплантация почки донорским органом с предварительно резецированными почечно-клеточными карциномами менее <3 см. Автор отметил всего один случай рецидива опухоли в трансплантате, который развился через 9 лет после трансплантации. Причем больной отказался от лечения и через 1,5 года опухоль увеличилась всего на 0,2 см [19]. Описан опыт трансплантации четырех донорских почек от живых доноров после выполненной резекции по поводу почечно-клеточного рака на стадии ТI. Отмечаются удовлетворительные результаты и отсутствие рецидива новых опухолей при наблюдении до 5 лет [20]. В Испании, где донорство наиболее развито, описывают опыт 11 трансплантаций почек от доноров с опухолевыми новообразованиями собственных почек. Восьмерым выполнена резекция опухоли перед трансплантацией. Семерым – на стадии pTIa, одному – на стадии pTIb. Во всех случаях не было диагностировано рецидивов опухолей при наблюдении более 3 лет [21].
Почечно-клеточный рак составляет 2–3% всех опухолей с высоким уровнем заболеваемости. На долю ПКР приходится около 90% всех злокачественных опухолей почек, обладающих специфическими патогистологическими и генетическими характеристиками [22]. Для трансплантации почки с клинической точки зрения важны три основных гистологических подтипа ПКР: светлоклеточный, папиллярный (типы I и II) и хромофобный. Частота встречаемости светлоклеточного, папиллярного и хромофобного рака составляет 80–90%, 6–15%, 2–5% соответственно. Во всех гистологических подтипах ПКР прогноз ухудшается в зависимости от стадии и гистологической степени. Пятилетняя раково-специфическая выживаемость светлоклеточного рака составляет 91, 74, 67, 32% для больных с клинической стадией ТI, T2, T3 и Т4 соответственно [23]. По сравнению со светлоклеточным папиллярный ПКР имеет более высокий уровень опухолей, ограниченных органом, и высокий уровень 5-летней раково-специфической выживаемости – 85,1 против 76,9% соответственно [24]. Для хромофобного типа ПКР характерен относительно благоприятный прогноз, 5-летняя безрецидивная выживаемость – 89,3%, а также 5- и 10-летняя раково-специфическая выживаемость составляет 93,0 и 88,9% соответственно [25]. Как показывают результаты однофакторного анализа, имеет место тенденция к получению более благополучного прогноза для больных хромофобным раком по сравнению с таковыми у пациентов с папиллярным или светлоклеточным ПКР [26].
Для гистологической верификации опухоли необходима экстренная биопсия перед трансплантацией [27]. Тем более что современные консервирующие растворы (Кустодиол) позволяют сохранять донорскую почку в течение 48 часов. Таким образом, в случае обнаружения у донора ПКР в стадии рТIа небольшой опухоли до 3 см, не выходящей за пределы капсулы почки, возможна трансплантация такого органа. Перед трансплантацией органа выполнение резекции донорской почки, пораженной опухолью, обязательно. Однако при этом необходимо известить реципиента о наличии у донора вышеуказанной патологии и при согласии больного выполнить трансплантацию почки. В случае обнаружения опухоли почки и невозможности выполнения резекции трансплантата и экстренной гистологии следует отказаться от трансплантации [28].
В настоящее время наличие в анамнезе злокачественного новообразования не расценивается как абсолютное противопоказание к донорству. В случае обнаружения в трансплантате небольшой опухоли <3 cм на стадии рTIа последнее не должно быть причиной отказа от донорства органа. Риск передачи злокачественного новообразования от донора к реципиенту оценивается на уровне 0,2% [29]. При этом он увеличивается при пересадке органов от пожилых и маргинальных доноров. Доноры могут быть распределены на три группы:
- Доноры, не имеющие злокачественных новообразований.
- Доноры с интраоперационно диагностированными злокачественными новообразованиями.
- Доноры с наличием в анамнезе злокачественных новообразований.
Однако даже в первой группе существует небольшой риск того, что у донора имеется недиагностированное злокачественное новообразование [30]. Донорами могут быть неоперированные больные немеланомным раком кожи низкой степени злокачественности. Противопоказанием к донорству не является базально-клеточная карцинома, неметастатическая спиноцеллюлярная карцинома кожи, рак шейки матки in situ, рак голосовых связок in situ. При обнаружении злокачественных образований у донора после трансплантации почки не стоит сразу выполнять трансплантатэктомию и отменять иммуносупрессивную терапию. Следует обсудить риски и возможные преимущества с реципиентом и уже после этого принимать окончательное решение о дальнейшей тактике [31]. Так, итальянскими клиницистами были представлены данные 337 (4,4%) с предположительно злокачественными новообразованиями из 7608 доноров. При обследовании 131 донор был признан для трансплантации. Был изъят 241 орган без случаев передачи онкологического процесса от донора реципиенту [32]. В другом исследовании, по данным 1069 доноров с наличием в анамнезе злокачественных новообразований, наиболее частыми нозологиями отсутствия случаев передачи новообразований являлись рак кожи (не меланома) (31%), опухоли ЦНС (25%), рак тела и шейки матки (13%) [33, 34] .
Донорство почки возможно при определенных видах опухолей головного мозга низкой степени злокачественности и метастазирования. Однако, если у потенциального донора имеется кровоизлияние в вещество головного мозга неясной этиологии, целесообразно исключить метастатическое поражение, т.к. метастазы в головной мозг могут определяться как первичные опухоли головного мозга. Необходимо проведение дифференциально диагностических мероприятий, поскольку метастатический онкологический процесс служит противопоказанием к донорству.
Приводим описание редкого случая трансплантации почки от донора с невыявленным раковым поражением печени.
Б о л ь н а я А. 45 лет. Гр. крови 0(I). И.Б. № поступила в отделение трансплантологии для выполнения экстренной операции трансплантации трупной почки. Больна с 2005 г., страдает хроническим диффузным гломерулонефритом, ХБП-V, нефрогенной анемией, нефрогенной гипертензией. На лечении перитонеальным диализом с 2011 г. 28.01.2015 выполнена трансплантация трупной почки. Донор Ж. 23 лет погибла от ОНМК. Гр. крови 0(I)+ Совпадение по групповой совместимости и по системе HLA по трем лейкоцитарным антигенам: A2, B45, DR4 полное. После включения донорской почки в кровоток отмечено выделение мочи частыми каплями. Функция донорской почки удовлетворительная. Перед операцией с целью индукции введен Симулект 20,0; во время операции введен метилпреднизолон 500,0. Больная получает 3-компонентную иммуносупрессивную терапию: преднизолон, програф, мофетила микофенолат.
Во время операции было обращено внимание на увеличенный лимфатический узел в воротах донорской почки, взятый на гистологическое исследование. Гистологическое исследование лимфоузла из ворот донорской почки от 28.01.2015: в лимфоузле метастаз аденокарциномы сосочкового строения с внеклеточным накоплением слизи с полным замещением лимфоидной ткани. При иммуногистохимическом исследовании в клетках опухоли отмечается экспрессия цитокератина 7, муцина 5А, р53, очагово – CDX2. Экспрессии цитокератинов 17 20, муцина 2-го типа, СА 125, WT1, рецепторов к эстрогену и прогестерону не обнаружено. Заключение: наиболее вероятна метастатическая муцинозная карцинома яичников. Нельзя исключать муцинозно-кистозную опухоль поджелудочной железы и аденокарциному желудка (иммунофенотип опухолей совпадает).
Учитывая удовлетворительную функцию трансплантированной почки, решено трансплантатэктомию не выполнять и перевести больную на лечение m-ТоR-препаратами (сертикан) с целью предотвращения развития опухолевого процесса в трансплантате.
Больная выписана домой с удовлетворительной функцией трансплантата. Cr крови 95 ммоль/л, Ur крови 12,3 ммоль/л. Гиперкалиемии нет. Мочи за сутки до 2500,0 мл.
С января 2015 г. отмечено ухудшение функции пересаженной почки. По данным УЗИ – гидронефроз трансплантата (рис. 4).
По данным КТ трансплантата – стриктура с/3 и терминального отдела донорского мочеточника (рис. 5). Решено выполнить реконструкцию донорского мочевого тракта. Во время операции обнаружено, что донорский мочеточник сдавливает окружающая ткань. Ткань настолько плотная, «каменистой плотности», что выделить мочеточник не представлялось возможным. Решено выполнить уретеропиелоанастомоз при помощи собственного мочеточника больного.
Гистологическое исследование фрагмента некротизированного донорского мочеточника больной А. Диффузный фиброз всех слоев, очаги некроза, местами на всю толщу стенки с инфильтрацией из нейтрофилов и лимфоцитов. В просветах сосудов организованные тромбы. Опухолевых клеток в стенке мочеточника не выявлено. Заключение: Ишемический некроз стенки мочеточника.
Выполнена нефрэктомия на стороне трансплантации, выделен собственный мочеточник, анастомозированный с лоханкой трансплантата. Операция была очень травматичной в связи с выраженным спаечным процессом в области паренефральной клетчатки. Послеоперационный период осложнился ОПН трансплантата. В связи с резким ухудшением состояния больной решено выполнить трансплантатэктомию. В послеоперационном периоде у больной развились полиорганная недостаточность, ДВС-синдром. 15.01.2016 больная погибла.
Гистология нефротрансплантата больной А. В жировой ткани почечного синуса, стенки лоханки и паренхиме удаленного нефротрансплантата определяются разрастания умеренно дифференцированной муцинозной аденокарциномы с внеклеточным накоплением слизи, очагами некроза; в просветах сосудов лоханки, прилоханочного жира, внутрипочечных вен определяются опухолевые тромбы – признаки сосудистой инвазии. Заключение: метастазы умеренно муцинозной аденокарциномы в жировую ткань почечного синуса, лоханку и паренхиму нефротрансплантата с сосудистой инвазией.
Несомненно, при выявлении метастаза муцинозной аденокарциномы в лимфоузле донорской почки необходимо было немедленно выполнять трансплантатэктомию, т.к. данный вид опухоли крайне злокачественный. Кроме того, патологоанатомический диагноз донора был следующий: злокачественное новообразование печени (гистологически – низкодифференцированный гепатоцелюлярный рак), лимфогенное и гематогенное метастазирование: метастазы рака в лимфотические узлы ворот печени, висцеральные листки плевры, легочную ткань, в бифуркационные лимфатические узлы. Причина смерти: нарастающая печеночная недостаточность, коагулопатия, массивное внутримозговое кровоизлияние с дислокацией ствола головного мозга.
Выраженный воспалительный процесс в связи с опухолевой инвазией в паранефральной и паравезикальной клетчатке привел к разрастанию плотной соединительной ткани, которая сдавливала донорский мочеточник, лоханку донорской почки. Паренхима трансплантата была патологически изменена из-за разрастания соединительной ткани, которая не позволяла адекватно выделить как сам трансплантат, так и мочеточник и лоханку, что привело к травме трансплантата. Проникновение опухолевых клеток в сосуды трансплантата привело к коагулопатии, повторному кровотечению. Поскольку у донора обнаружен незкодифференцированный гепатоцелюлярный рак, можно предположить метастатическое поражение артерий головного мозга, что привело к разрыву средней мозговой артерии и возникновению массивного кровоизлияния, что и привело к смерти донора. Таким образом, наличие у донора гепатоцелюлярного рака и как следствие – метастатического процесса в головном мозг послужило абсолютным противопоказанием к изъятию донорских органов. В случае трансплантации такого органа и выявления вышеуказанной патологии у донора необходимо экстренное удаление трансплантата, несмотря на удовлетворительную функцию пересаженного органа.
Учитывая ограниченное по времени обследование донора, тщательная оценка донора на отсутствие злокачественной опухоли не всегда представляется возможным. Растущий возраст доноров может также увеличить риск ранее невыявленных злокачественных новообразований у донора. Тем не менее частота передачи злокачественных новообразований от донора к реципиенту остается низкой [35].
В дальнейшем для данной категории реципиентов могут быть произведены изменения иммуносупрессивной терапии, поскольку применение ингибиторов m-TOR позволяет снижать частоту возникновения злокачественных образований. Модификация иммуносупрессивной терапии таких пациентов предполагает снижение дозы или по возможности полную отмену ингибиторов кальцинейрина и начало приема m-TOR-ингибиторов (сиролимуса или эверолимуса) с учетом противоопухолевого эффекта данной группы иммуносупрессантов [1, 11].
На основании данных литературы и собственных исследований в случае обнаружения опухоли в трансплантированной почке при малейшей возможности необходимо выполнять резекцию трансплантата, что исключает перевод больного на гемодиализ и тем самым улучшает качество жизни [16, 36].
Важное значение имеет строгая приверженность интенсивному наблюдению перенесших трансплантацию больных, что позволяет выявлять новообразования на ранней стадии, когда органосохраняющее лечение выполнимо и эффективно.
Лечение опухолей в трансплантате должно проводиться согласно имеющимся рекомендациям по лечению рака почки, и при небольших размерах предпочтение должно отдаваться резекции, которая обеспечивает оптимальный баланс между онкологическим результатом и сохранением почечной функции. Выбор техники вмешательства должен быть основан на индивидуальных особенностях клинического случая и опыте хирурга, при этом лапароскопическая или робот-ассистированная резекции являются выполнимыми и хорошо зарекомендовавшими себя методиками.



