Успешная трансплантация почки оказывает нормализующее влияние на эндокринно-метаболические расстройства, свойственные хронической болезни почек (ХБП). Однако у некоторой категории реципиентов ренального трансплантата сохраняются те или иные отклонения в минерально-костном метаболизме. К наиболее частым диагностическим «находкам» относится повышенная функция околощитовидных желез (ОЩЖ) – персистирующий или третичный гиперпаратиреоз (ГПТ), гиперкальциемия и гипофосфатемия [1–3].
В крупном ретроспективном обсервационном исследовании в первый год после успешной трансплантации почки из 607 больных 108 (18 %) имели повышенный уровень паратиреоидного гормона (ПТГ) и 47 (8 %) – повышенный уровень ПТГ в сочетании с гиперкальциемией [4]. Группа бельгийских ученых, проанализировав естественное течение функции ОЩЖ и кальций-фосфорного обмена у 861 реципиента почечного трансплантата на протяжении 4 лет, показала, что у 17 % либо регистрировался уровень ПТГ, превышающий верхнюю границу нормы в 2,5 раза, либо была выполнена паратиреоидэктомия (ПТЭ). Авторы установили факторы риска персистирующего после трансплантации почки ГПТ, коими оказались высокие уровни в крови ПТГ, кальция, фосфора и/или щелочной фосфатазы, а также длительная диализная терапия в предтрансплантационном периоде, причем реализация перечисленных факторов в большей степени проявлялась при субоптимальной функции трансплантированной почки [2]. Влияние длительности диализной терапии до пересадки почки на развитие персистирующего ГПТ в посттрансплантационном периоде установлено и в исследовании P. Kinnaert et al. [1]. Обсуждаются другие возможные факторы риска возникновения посттрансплантационного ГПТ – использование некоторых иммуносупрессивных препаратов, дефицит 25(ОН)- и 1,25(ОН)2 витамина D3, изменение экспрессии витамин D- и кальций-чувствительных рецепторов, однако их участие подтверждено не во всех исследованиях [5, 6].
Другое частое нарушение минерального обмена у больных после пересадки почки – гиперкальциемия, которая регистрируется более чем в 50 % случаев первые три месяца и в 5–10 % случаев в течение первого года. Высказывались предположения о возможном развитии посттрансплантационной гиперкальциемии вследствие рассасывания очагов внескелетной кальцификации, уменьшения запасов фосфора в организме, восстановления кальциемического ответа кости на действие ПТГ. В своем исследовании, включившем 34 реципиента почечного трансплантата от живого донора, японские авторы показали, что сывороточная концентрация кальция после своего снижения в первую пострансплантационную неделю достигает максимального пика в пределах референсных значений к 4-й неделе и у некоторых больных сохраняется таковой на протяжении года – это пациенты с нормокальциемией, а у других продолжает нарастать – это пациенты с гиперкальциемий. В многофакторном анализе единственным фактором, ответственным за посттрансплантационную гиперкальциемию, оказался уровень ПТГ в крови (р < 0,001) [3].
Развитие посттрансплантационной гипофосфатемии связывают с несколькими причинами – подавлением канальцевой реабсорбции фосфатов в трансплантированной почке, влиянием циркулирующих фосфотонинподобных субстанций, приемом некоторых лекарственных препаратов. Вышеупомянутое японское исследование продемонстрировало следующее [3]. Сывороточная концентрация фосфора очень быстро снижалась первые дни после операции, затем несколько нарастала параллельно плавному снижению в крови уровня фактора роста фибробластов-23 (ФРФ-23), однако корреляционная связь между обоими параметрами была слабой (р = 0,08) и только первые два месяца. При многофакторном анализе сывороточная концентрация фосфора первый посттрансплантационный год находилась в тесной отрицательной корреляционной зависимости только с содержанием в крови ПТГ (р < 0,001).
 Таким образом, третичный ГПТ, протекающий с гиперкальциемий и гипофосфатемией, представляет собой нередкую патологию среди реципиентов почечного трансплантата. Клинические проявления третичного ГПТ многообразны и напоминают таковые при первичном ГПТ. К ним относятся формирование костной патологии, в частности снижение минеральной костной массы, преимущественно в костях с кортикальным типом строения, предрасполагающее к возникновению костных переломов, поражение почечного трансплантата (нефролитиаз, нефрокальциноз) и желудочно-кишечного тракта (пептические язвы желудка, панкреатит), развитие внескелетной кальцификации (мягких тканей, сосудов), психоэмоциональные сдвиги, расстройства углеводного, липидного обменов и др. [5, 7–9].
Таким образом, третичный ГПТ, протекающий с гиперкальциемий и гипофосфатемией, представляет собой нередкую патологию среди реципиентов почечного трансплантата. Клинические проявления третичного ГПТ многообразны и напоминают таковые при первичном ГПТ. К ним относятся формирование костной патологии, в частности снижение минеральной костной массы, преимущественно в костях с кортикальным типом строения, предрасполагающее к возникновению костных переломов, поражение почечного трансплантата (нефролитиаз, нефрокальциноз) и желудочно-кишечного тракта (пептические язвы желудка, панкреатит), развитие внескелетной кальцификации (мягких тканей, сосудов), психоэмоциональные сдвиги, расстройства углеводного, липидного обменов и др. [5, 7–9].
Морфологический субстрат посттрансплантационного ГПТ чаще представлен ассиметричной гиперплазией всех четырех, реже – одной-двух ОЩЖ, скорее всего вследствие неравномерной инволюции желез после успешной пересадки почки. Одинарная или двойная аденома ОЩЖ также обнаруживается у реципиентов почечного трансплантата и может иметь двоякое происхождение – спорадический первичный ГПТ или аденоматозная трансформация гиперплазированной при вторичном ГПТ железы [1, 10].
Специальные клинические рекомендации по лечению третичного ГПТ пока не разработаны. Но, так же как при первичном ГПТ, показанием к активной терапевтической тактике являются стойкая гиперкальциемия и/или высокий уровень ПТГ. Остается неясным, особенно при сохраняющейся нормокальциемии, какой уровень ПТГ следует считать повышенным и начинать лечение: возможно, как и при вторичном ГПТ – 2–9 верхних границ нормы. Специалисты подчеркивают, что восстановление гомеостаза кальция, фосфора и витамина D у реципиентов ренального трансплантата продолжается несколько месяцев после операции, и предостерегают от раннего (если не развился гиперкальциемический криз) активного лечения ГПТ. Диагностическая стратегия для этих больных включает мониторинг сывороточной концентрации фосфора как информативного критерия потенциального развития гиперкальциемии, функции почечного трансплантата, минерализации костей методом двухэнергетической рентгеновской абсорбциометрии, активности щелочной фосфатазы (костноспецифической и/или общей) [11, 12].
До недавнего времени основным способом лечения третичного ГПТ и во взрослой и в детской популяциях было хирургическое пособие – ПТЭ. Потребность в ПТЭ среди реципиентов почечного трансплантата не превышает 5 %. При 15-летнем наблюдении за 996 больными, перенесшими трансплантацию почки, ПТЭ подверглись 45 (4,5 %) [1]. Последняя может быть субтотальной или тотальной с и без аутотрансплантации фрагмента ОЩЖ под кожу или в мышцу. Выбор операции остается за хирургом и определяется индивидуально в каждом конкретном случае [13, 14]. T.M. Hsieh et al. [15] наблюдали 14 прооперированных из 488 реципиентов почечного трансплантата с третичным ГПТ: 7 больным выполнена тотальная и 7 – субтотальная ПТЭ. Авторы не обнаружили различий между двумя группами в длительности операции и стационарного лечения, а также лабораторных показателей, за исключением кальция и фосфора крови. Больные, подвергшиеся тотальной ПТЭ, имели более низкую сывороточную концентрацию кальция и более высокую сывороточную концентрацию фосфора, нежели больные, перенесшие субтотальную ПТЭ. На основании этого авторы сделали следующий вывод: субтотальная ПТЭ предпочтительнее, т.к. снижает риск развития послеоперационной гипокальциемии. В другом исследовании представлены результаты тотальной без аутотрансплантации фрагмента ОЩЖ ПТЭ 26 реципиентам почечного трансплантата, получавшим после операции 1-α-кальцидиол: через 5 лет были живы все, через 9 лет – 20 пациентов. И через 5, и через 9 лет сывороточная концентрация кальция и уровень ПТГ в крови сохранялись нормальными, на основании чего авторы заключили: выполнение тотальной без аутотрансплантации фрагмента ОЩЖ ПТЭ предупреждает и персистирование, и рецидив ГПТ [16]. Ранее предполагалось, что развитие рецидива ГПТ после перенесенной ПТЭ реципиентам с удовлетворительно функционирующим почечным трансплантатом невозможно. Но K. Schlosser et al. [17] наблюдали 24 таких больных из 69, перенесших ПТЭ в посттрансплантационном периоде, причем у 8 рецидив ГПТ был обусловлен аутотрансплантатом ОЩЖ. При удалении последнего в нем были обнаружены изменения, свойственные нодулярной гиперплазии и аденоматозной трансформации ОЩЖ, по мнению авторов, исходно имевшие место в трансплантируемом фрагменте железы, несмотря на тщательный отбор этих фрагментов. Поэтому тотальная ПТЭ без аутотрансплантации фрагмента ОЩЖ представляется наилучшей хирургической стратегией при третичном ГПТ.
Во избежание персистирования и развития рецидива после ПТЭ при третичном ГПТ некоторые авторы считают целесообразным, как и при первичном ГПТ, проведение интраоперационного мониторинга ПТГ [10]. Но в отличие от первичного ГПТ у некоторых больных с третичным ГПТ более чем 50 %-ное снижение ПТГ регистрируется не через 10, а через 25 минут после адекватной резекции ОЩЖ.
В ряде исследований проведен анализ функционального состояния почечного трансплантата у реципиентов после первичной и повторных операций на ОЩЖ. Так, L. Rostaing et al. [18] диагностировали увеличение сывороточного креатинина в послеоперационном периоде у 8 из 34 пациентов, связав это с наличием у них длительной артериальной гипертензии.
P.P. Lee et al. [19] наблюдали 22 реципиента почечного трансплантата в течение года после ПТЭ и отметили явное увеличение сывороточного креатинина по сравнению с уровнем, наблюдаемым на протяжении двух лет до операции. Однако, учитывая тесную функциональную связь между ОЩЖ и почкой, трудно определить, связано ли снижение функции почечного трансплантата с хирургическим вмешательством и/или изменением кальций-фосфорного метаболизма после ПТЭ. Напротив, K. Schlosser et al. [17], подвергшие 8 больных повторной операции в связи с обусловленным в аутотрансплантате ОЩЖ рецидивом ГПТ, подчеркнули стабильность функции почечного трансплантата на протяжении 6 месяцев послеоперационного периода.
В отдаленном периоде (38 ± 6 месяцев) они зафиксировали увеличение сывороточного креатинина, которое, по-видимому, было уже результатом прогрессирования хронической трансплантационной нефропатии.
Представляем собственное наблюдение хирургического лечения третичного ГПТ.
Клиническое наблюдение 1. Пациентка А. 1964 г.р. страдает поликистозом почек, впервые выявленным в 1996 г. при развитии острого пиелонефрита. В течение последующих 15 лет нерегулярное наблюдение у терапевта и уролога. Нефропротективная терапия, диагностика и коррекция метаболических и гомеостатических нарушений, сопутствующих ХБП, не проводились. В июне 2011 г. в связи с достижением ХБП 5-й стадии (креатинин крови 1426 мкмоль/л, расчетная скорость клубочковой фильтрации [рСКФ] – 3 мл/мин) пациентка переведена на лечение программным гемодиализом. С целью подготовки к трансплантации донорской почки 16.11.2011 выполнена левосторонняя нефрэктомия.
Уже в тот период пациентка имела выраженные клинико-лабораторные проявления вторичного ГПТ тяжелого течения. У нее определялись костно-суставной болевой синдром, изменение походки по типу «утиной», деформация грудной клетки, высокий уровень в крови ПТГ, стойкая гиперфосфатемия, склонность к гиперкальциемии (табл. 1). При МРТ-исследовании левого коленного сустава, выполненного в связи с возникновением сильной боли при ходьбе, выявлены признаки хондромаляции в области центральных отделов надколенника, дегенеративные изменения менисков и диффузно-очаговые изменения в дистальной трети бедренной кости. В течение нескольких месяцев пациентка получала лечение цинакалцетом с некоторым эффектом.
Аллотрансплантация трупной почки произведена 09.09.2012, функция трансплантата первичная. Индукционная иммуносупрессивная терапия включала введение базиликсимаба в суммарной дозе 40 мг, базисная – ингибитор кальцинейрина (такролимус в стартовой дозе 0,13–0,18 мг/кг/сут и далее под контролем плазменной концентрации препарата), препарат группы микофенолатов (1,0–1,5 г/сут), преднизолон (30 мг/сут с последующим снижением дозы до поддерживающей – 5–10 мг/сут). На 6-е сутки посттрансплантационного периода в связи с развитием криза отторжения почечного трансплантата проведены пульс-терапия метилпреднизолоном в суммарной дозе 1,5 г и 3 сеанса каскадной плазмофильтрации. На протяжении полугода функция почечного трансплантата удовлетворительная и стабильная. Пациентка вернулась к трудовой деятельности, однако ее продолжали беспокоить костно-суставные боли в покое и при ходьбе, изменение походки по типу «утиной».
При обследовании в феврале 2013 г. показатели крови: Нв 137 г/л, креатинин 78 мкмоль/л, (рСКФ 65 мл/мин), мочевина 7 ммоль/л, мочевая кислота 238 мкмоль/л, ПТГ 2786 пг/мл (норма 11–62), ЩФ 1327 ЕД/л (норма 80–306), кальций (ионизированный) 1, 4 ммоль/л, фосфор 0,7 ммоль/л. При рентгенографии кистей установлены снижение рентгенопрозрачности костной ткани, выраженная субпериостальная резорбция медиальных поверхностей средних фаланг 1–5-го пальцев и основной фаланги 2-го пальца правой кисти и акростеолиз ногтевой фаланги 2-го пальца левой кисти; кальциноз сосудов кистей и предплечий. При двухэнергетической рентгеновской абсорбциометрии скелета минеральная плотность костной ткани (МПКТ) составила в дистальном отделе костей предплечья -4,1SD по Т-критерию, в шейке бедренной кости – -3,8SD по Т-критерию, в поясничном отделе позвоночника – -4,1SD по Т-критерию. При эхокардиографии определен кальциноз фиброзного кольца аортального и митрального клапанов.

В связи с наличием у пациентки тяжелого третичного ГПТ обсуждался вопрос об оперативном лечении. Проведена комплексная топическая диагностика ОЩЖ. При УЗИ передней поверхности шеи в левой доле щитовидной железы определены множественные образования диаметром 4–7 мм; также визуализировано 3 узловых образования – в проекции правых верхней и нижней (размером соответственно 11×6×8 и 14×9×12 мм) и в проекции левой нижней (размером 16×8×12 мм) ОЩЖ. Выполнена тонкоигольная аспирационная биопсия этих узловых образований. При цитологическом исследовании выявлены признаки выраженной пролиферации ОЩЖ: скопления в виде тяжей и фолликулподобных структур плотно лежащих темных паратироцитов, а в пунктате из узлового образования в проекции левой нижней ОЩЖ также скопления светлых паратироцитов с базофильными гранулами в цитоплазме и обилие базофильных гранул во внеклеточном пространстве.
При мультиспиральной компьютерной томографии шеи: cзади и cнизу от правой доли щитовидной железы визуализируется объемное образование с паратрахеальным, параэзофагальным и частично превертебральным расположением достаточно однородной структуры, размером 15×8×17,5 мм; при контрастировании структура образования неоднородная, менее выраженная, чем у щитовидной железы. Внизу от левой доли щитовидной железы определяется объемное образование, аналогичное вышеописанному, размером 16×14×14,5 мм, расположенное между трахеей медиально, внутренней яремной веной латерально и общей сонной артерией сзади. В щитовидной железе больше в левой доле визуализируются очаги пониженной плотности максимальным диаметром до 5 мм, не накапливающие контрастный препарат. При исследовании в костном режиме определяется диффузное изменение структуры костной ткани в основном за счет ее уплотнения с наличием на этом фоне очагов разряжения. Стенки крупных бронхов кальцинированы. Выраженный кальциноз коронарных артерий, аорты. Заключение: объемные образования вблизи правой и левой долей щитовидной железы соответствуют аденомам ОЩЖ. Очаги пониженной плотности в обеих долях щитовидной железы. Изменения костного скелета обусловлены гиперпаратиреоидной остеодистрофией.
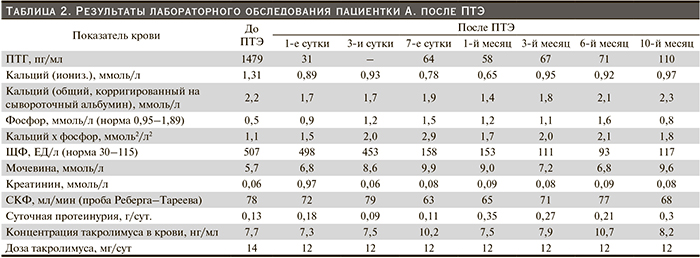
 При радионуклидном исследовании ОЩЖ: в паратиреоидной области определяются очаги аномального, выше средней интенсивности накопления радиофармпрепарата, прилежащие к нижним полюсам обеих долей щитовидной железы.
При радионуклидном исследовании ОЩЖ: в паратиреоидной области определяются очаги аномального, выше средней интенсивности накопления радиофармпрепарата, прилежащие к нижним полюсам обеих долей щитовидной железы.
В проекции средостения фокальные аномалии распределения радиофармпрепарата не контрастируют (рис. 1).
С целью хирургического лечения третичного ГПТ пациентка госпитализирована в отделение трансплантологии и диализа ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» 26.03.2013. Операция ПТЭ выполнена 28.03.2013. При интраоперационной ревизии у нижнего полюса левой доли щитовидной железы обнаружено образование (2,5×1,5 см) коричнево-желтого цвета, напоминающее аденоматозно измененную гиперплазированную ОЩЖ; за нижним полюсом правой доли между сонной артерией и трахеей – узловое образование (2,5×2,0 см), интимно связанное с левым возвратным нервом; правая и левая верхние увеличены соответственно до 1,8×1,3 и 2,0×1,5 см. Выполнено удаление всех ОЩЖ; ½ гомогенизированной правой верхней ОЩЖ аутотрансплантирована в левую кивательную мышцу.
Патологоанатомическое заключение: все ОЩЖ-узлы в капсуле, мягко-эластичной консистенции, округло-овальной формы: левая нижняя − 1,5×1,0×1,2 см массой 2 г, правая нижняя − 2,2×1,5×0,8 см массой 2 г, левая верхняя – 1,5×0,7×0,3 см массой менее 2 г (ОЩЖ в норме: длина 2–8 мм, ширина 3–4 мм, толщина 1,5–3 мм; вес всех желез 0,25–0,5 г). При гистологическом исследовании во всех ОЩЖ определена нодулярно-аденоматозная гиперплазия из светлых, темных и оксифильных паратироцитов.
Течение послеоперационного периода удовлетворительное, без осложнений (табл. 2). Проводилась коррекция гипокальциемии: альфакальцидол 1,0–1,5 мкг/сут, кальций-Д3 Никомед форте 2 табл/сут, карбонат кальция 10–12 г/сут, внутривенные инфузии глюконата кальция (по клиническим показаниям). Выписана на 8-е сутки после ПТЭ в удовлетворительном состоянии с рекомендациями динамического контроля уровня в крови кальция, ПТГ и продолжения коррекции гипокальциемии. Обследована через 1, 3, 6 и 10 месяцев, состояние удовлетворительное.
В представленном наблюдении тяжелый ГПТ развился у пациентки с наследственной почечной патологией (поликистоз почек) еще на додиализном этапе ХБП. При переводе пациентки на лечение гемодиализом (возможность динамического наблюдения) у нее зарегистрированы высокий уровень ПТГ, эпизодическая гиперкальциемия, постоянная гиперфосфатемия, которые сочетались с выраженными изменениями со стороны костно-суставной системы: болевой синдром; деформация грудной клетки, МРТ-выявленные изменения в области левого коленного сустава. Наш опыт показывает, что эти неспецифические клинико-лабораторные признаки даже при маленьком диализном «стаже», но длительном почечном анамнезе, что имело место у нашей пациентки, свидетельствуют в пользу узловой трансформации ОЩЖ и формирования «третичного» ГПТ [20]. ПТЭ таким больным должна выполняться до пересадки почки.
Учитывая «отягощенный по ГПТ тяжелого течения» предтрасплантационный период и результаты обследования, выполненные через 5 месяцев после пересадки почки, отражающие наличие третичного ГПТ, пациентке было предложено хирургическое лечение. ПТЭ, выполненная через 6,5 месяцев после пересадки почки, привела к нормализации в крови уровня ПТГ, повышению и нормализации сывороточной концентрации фосфора, но развитию тяжелой гипокальциемии (синдром «голодной кости»), потребовавшей проведения длительной коррекции. Функция почечного трансплантата не изменилась.
Другое направление в лечении третичного ГПТ у реципиентов почечного трансплантата сформировалось несколько лет назад, когда появился принципиально новый класс лекарственных средств – кальцимиметики (цинакалцет). Вызывая аллостерическую модуляцию кальций-чувствительных рецепторов, расположенных на поверхности главных клеток (паратироцитов) ОЩЖ, и тем самым снижая порог реакции этих рецепторов на внеклеточный кальций, цинакалцет ингибирует синтез, секрецию ПТГ, а также гиперплазию желез. Цинакалцет доказал свою высокую эффективность и служит препаратом выбора для лечения вторичного ГПТ у диализной категории больных [21–23]. Он нашел применение и в лечении первичного ГПТ с целью коррекции гиперкальциемии у пациентов, которым невозможно выполнение хирургического пособия [24]. В настоящее время накапливается опыт использования цинакалцета при третичном ГПТ у реципиентов ренального трансплантата (табл. 3).
Сообщается об эффективном снижении сывороточной концентрации кальция и уровня в крови ПТГ, улучшении костного метаболизма, т.е. успешном контроле третичного ГПТ. При этом в большинстве наблюдений функциональное состояние ренального трансплантата сохранялось стабильным. Клиницисты подчеркивают, что снижение содержания в крови ПТГ при лечении цинакалцетом достигается практически всеми больными, хотя степень этого снижения сильно варьируется. Может быть, процесс снижения уровня ПТГ у реципиентов с функционирующим почечным трансплантатом зависит от своеобразия фармакокинетики и/или фармакодинамики препарата, однако доказано, что введение цинакалцета вызывает быстрое, но непродолжительное по времени (до 8 часов) снижение гормона в крови. А может быть, степень снижения ПТГ отражает степень гиперплазии и узловой трансформации ОЩЖ [24, 27]. Так, например, японские авторы наблюдали 5 трансплантированных больных третичным ГПТ, оказавшихся резистентными к лечению цинакалцетом в дозе 25–75 мг/сут. Все эти больные имели нодулярную гиперплазию ОЩЖ (по результатам гистологического исследования, проведенного после ПТЭ), клиническим эквивалентом которой при УЗИ, по мнению авторов, служит диаметр железы более 1 см [33].

Нормализация содержания кальция в крови, наблюдаемая на фоне лечения цинакалцетом, по мнению K.A. Borchhardt et al. [34], происходит вследствие уменьшения реабсорбции кальция в петле Генле и увеличения его мочевой экскреции на фоне снижения плазменной концентрации ПТГ, хотя не у всехобнаружена такая взаимосвязь. Отсутствие нарастания мочевой экскреции кальция может быть результатом уменьшения его клубочковой фильтрации при снижении сывороточного кальция, а следовательно, и уменьшения канальцевой реабсорбции. Вероятен и другой механизм нормализации сывороточного кальция – подавление интенсивности костного метаболизма на фоне снижения секреции ПТГ [25, 32].
Информация о влиянии терапии цинакалцетом на обмен фосфора при третичном ГПТ остается противоречивой. Одни авторы отметили нарастание уровня фосфора в крови, другие не увидели подобной закономерности [25, 27, 32, 34]. Предположительно, увеличение сывороточной концентрации фосфора может быть следствием снижения контролируемой ПТГ и фосфотонинподобными субстанциями его почечной экскреции, а может быть, и других механизмов, в частности функционального состояния пересаженной почки. Коррекция гипофосфатемии в ответ на прием цинакалцета у реципиентов с удовлетворительно функционирующим почечным трансплантатом полезна, в то время как у реципиентов со сниженной и/или нестабильной функцией почечного трансплантата требуется динамический контроль сывороточной концентрации фосфатов.
Лечение цинакалцетом приводит к стабилизации минеральной костной массы, а у некоторых больных – к уменьшению ее дефицита [32, 35]. Возможность цинакалцета улучшать костный метаболизм и костную структуру подтверждена костной цитоморфометрией в исследовании K.A. Borchhardt et al. [36], а также в многоцентровом открытом дескриптивном исследовании BONAFIDE [37]. Улучшение структуры костной ткани, скорее всего, является следствием нормализации уровня ПТГ в крови, влекущей за собой восстановление кальций-фосфорного гомеостаза и костного метаболизма. В то же время предполагается наличие прямого позитивного воздействия цинакалцета на костный метаболизм [38].
 В отношении влияния цинакалцета на функцию пересаженной почки сохраняется неясность. Сообщается как об отсутствии изменения содержания креатинина в крови, так и о его повышении [25–32, 40]. Однако последнее, по мнению J.M. El-Amm et al. [32], закономерно и связано с хронической трансплантационной нефропатией процессом, поскольку ежемесячный темп увеличения сывороточной концентрации креатинина оказался одинаков и до начала приема цинакалцета, и на этапе лечения этим препаратом. В то же время установлено, что цинакалцет оказывает влияние на фармакокинетику современных иммуносупрессивных препаратов: снижает плазменную концентрацию такролимуса и вызывает накопление одного из метаболитов циклоспорина А, являющегося нефротоксичным [39].
В отношении влияния цинакалцета на функцию пересаженной почки сохраняется неясность. Сообщается как об отсутствии изменения содержания креатинина в крови, так и о его повышении [25–32, 40]. Однако последнее, по мнению J.M. El-Amm et al. [32], закономерно и связано с хронической трансплантационной нефропатией процессом, поскольку ежемесячный темп увеличения сывороточной концентрации креатинина оказался одинаков и до начала приема цинакалцета, и на этапе лечения этим препаратом. В то же время установлено, что цинакалцет оказывает влияние на фармакокинетику современных иммуносупрессивных препаратов: снижает плазменную концентрацию такролимуса и вызывает накопление одного из метаболитов циклоспорина А, являющегося нефротоксичным [39].
Заслуживают внимания результаты, полученные A.E. Kruse et al. [40]. Авторы в течение трех месяцев после отмены цинакалцета наблюдали 10 пациентов, которые ранее получали этот препарат с хорошим эффектом на протяжении года. Содержание в крови ПТГ, кальция, фосфора практически не изменилось, а содержание 1,25-дигидроксивитамина D увеличилось с 69,8 ± 7,5 пмоль/л в период лечения цинакалцетом, до 93,7 ± 10,1; 105,8 ± 13,5 и 101,3 ± 11,7 пмоль/л соответственно через 2 недели, 2 и 3 месяца после отмены препарата. Механизм подавляющего функцию ОЩЖ эффекта после отмены цинакалцета остается неясным. Высказывается предположение о повышении экспрессии витамин-D-чувствительных рецепторов, расположенных на поверхности паратироцитов, в ответ на введение кальцимиметика, которое сохраняется и после его отмены. Наблюдаемое увеличение содержания в крови 1,25-дигидроксивитамина D после отмены цинакалцета делает такую гипотезу привлекательной.
Колебания рСКФ до начала, в период и после отмены лечения оказались недостоверными, но при этом концентрация цистатина С в крови после отмены цинакалцета существенно снизилась (р < 0,01), достигнув референсных границ показателя. Обратимость почечных нарушений отрицает развитие структурных изменений в трансплантате и скорее свидетельствует в пользу возможного возникновения кальций- и ПТГ-опосредованного гемодинамического эффекта, вызывающего снижение СКФ. По-видимому, именно кальций- и ПТГ-опосредованным гемодинамическим эффектом объясняется наблюдаемое некоторыми специалистами ухудшение функции трансплантата после ПТЭ. Опираясь на полученные данные, авторы предложили обсудить разумность прерывистого лечения третичного ГПТ у реципиентов ренального трансплантата.
В целом полученные к сегодняшнему дню данные позволяют обсуждать перспективность альтернативы применения цинакалцета для ПТЭ при третичном ГПТ у реципиентов ренального трансплантата. В то же время накопленный клинический опыт весьма невелик как по числу пациентов, так и по длительности наблюдения.
Обоснованно проведение крупных контролируемых рандомизированных исследований по нескольким направлениям:
- сравнение эффективности и безопасности цинакалцета и ПТЭ при лечении третичного ГПТ у реципиентов почечного трансплантата;
- влияние терапии цинакалцетом на костную систему, сердечно-сосудистую заболеваемость и функцию почечного трансплантата (почечную выживаемость) в долгосрочной перспективе;
- oбоснование длительности лечения цинакалцетом третичного ГПТ у больных после трансплантации почки.
Представляем собственное наблюдение лечения третичного ГПТ цинакалцетом.
Клиническое наблюдение 2. Пациентка Г. 1972 г.р. Диагноз системной красной волчанки поставлен в 1998 г., проводились курсы пульс-терапии циклофосфаном и метилпреднизолоном. Прогрессирование ХБП с 2002 г., лечение программным гемодиализом с 2004 г. Развитие вторичного ГПТ с 2007–2008 гг., с весны 2011 г. лечение цинакалцетом (30 мг/сут) в сочетании с альфакальцидолом (0,5 мкг через день) с положительным эффектом (табл. 4).
Аллотрансплантация трупной почки выполнена 22.09.2011, функция почечного трансплантата первичная. Индукционная иммуносупрессивная терапия включала введение базиликсимаба в суммарной дозе 40 мг, базисная – ингибитор кальцинейрина (такролимус в стартовой дозе 0,13–0,18 мг/кг/сут и далее под контролем плазменной концентрации препарата), препарат группы микофенолатов (1,0–1,5 г/сут), преднизолон (30 мг/сут с последующим снижением дозы до поддерживающей – 5–10 мг/сут). Функция почечного трансплантата в течение первого года после операции стабильно удовлетворительная.
В пострансплантационном периоде цинакалцет отменен и продолжена монотерапия альфакальцидолом (0,5 мкг/сут).
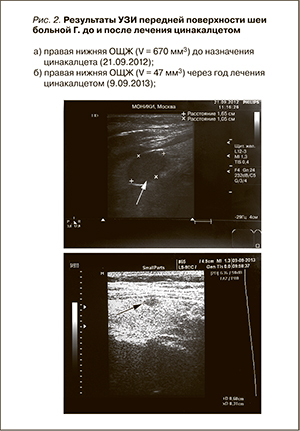
С начала 2012 г. выявлено стойкое увеличение в крови уровня кальция (альфакальцидол отменен) и ПТГ. При рентгенографии кистей определена начальная субпериостальная резорбция медиальных поверхностей средних фаланг 2-го и 3-го пальцев правой кисти; при двухэнергетической рентгеновской абсорбциометрии – снижение минеральной плотности костной ткани (МПКТ) во всех отделах скелета в наибольшей степени в дистальном отделе костей предплечья (-3,5 SD по Т-критерию); при эхокардиографии – кальциноз фиброзных колец аортального и митрального клапанов. При УЗИ передней поверхности шеи обнаружено единичное узловое образование в проекции правой нижней ОЩЖ размером 16×10×8 мм, объем – 670 мм3 (рис. 2). При цитологическом исследовании материала, полученного в результате тонкоигольной аспирационной биопсии, определены единичные группы пролиферирующих темных паратироцитов, наличие светлых паратироцитов с базофильными гранулами в цитоплазме и обилие базофильных гранул во внеклеточном пространстве.
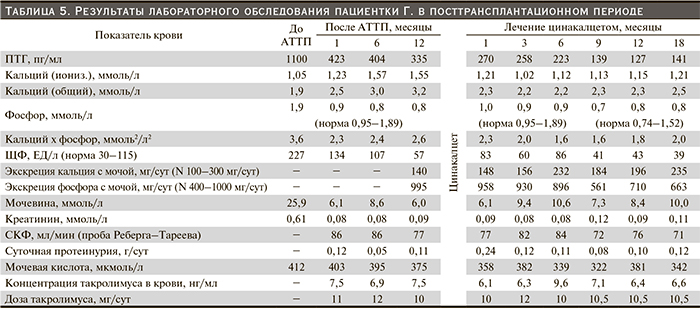
Пациентка отказалась от хирургического лечения; ей был назначен цинакалцет в начальной дозе 30 мг/сут., через 3 месяца доза увеличена до 60 мг/сут, во втором полугодии она составила 60–75 мг/сут. Начиная с 4-го месяца пациентка принимала альфакальцидол в дозе 0,5 мкг/сут во втором полугодие – в дозе 0,75 мкг/сут. Динамика показателей кальций-фосфорного обмена, костного метаболизма и функционального состояния почечного трансплантата представлена в табл. 5. Обращала на себя внимание при используемой схеме лечения нормализация: быстрая (через месяц) – сывороточной концентрации кальция, медленная – сывороточной концентрации фосфора и медленное снижение уровня в крови ПТГ. Мочевая экскреция кальция имела тенденцию к увеличению, мочевая экскреция фосфора – к снижению, но оба показателя соответствовали референсным значениям методики их определения. Функция почечного трансплантата оставалась стабильной, плазменная концентрация такролимуса колебалась в пределах целевых значений (с соответствующим выбором дозы препарата).
При динамическом обследовании через год регистрировалось следующее. УЗИ передней поверхности шеи – узловое образование в проекции правой нижней ОЩЖ значительно меньших размеров: 6×3×5 мм, объем 47 мм3 (рис. 2). Рентгенография кистей – умеренная положительная динамика – субпериостальная резорбция кортикального слоя медиальных поверхностей средних фаланг 2-го и 3-го пальцев менее выражена (рис. 3). Денситометрия скелета – увеличение МПКТ во всех отделах скелета (табл. 6).
Состояние пациентки удовлетворительное, функция почечного трансплантата стабильная, продолжает прием цинакалцета (30–45 мг/сут) и альфакальцидола (0,75 мкг /сут).
В представленном наблюдении, как и в первом, пациентка, получавшая лечение программным гемодиализом, страдала тяжелым вторичным ГПТ. После успешной трансплантации почки гиперфункция ОЩЖ, нарушения кальций-фосфорного обмена и костного метаболизма частично регрессировали.
В пользу формирования третичного ГПТ свидетельствовали повышение уровня ПТГ, не соответствующее СКФ, гиперкальциемия, гипофосфатемия, поражение костной системы, внескелетная кальцификация.
Визуализированная при УЗИ правая нижняя ОЩЖ имела диаметр более 1 см, что, по мнению М. Okada et al. [33], указывает на аденоматозную трансформацию железы.
Назначение цинакалцета привело к быстрой нормализации сывороточного кальция, более медленной – сывороточного фосфора, без грубых нарушений мочевой экскреции этих электролитов, снижению уровня ПТГ к концу первого года лечения на 53 %, положительным сдвигам со стороны костной системы и существенному уменьшению объема правой нижней ОЩЖ. В целом терапия цинакалцетом данной пациентки оказалась высокоэффективной, хотя по результатам других исследований при подобных исходных размерных характеристиках железы (диаметр более 1 см, объем более 500 мм3) эффект лечения либо отсутствовал, либо был слабовыраженным [23, 33]. Функция почечного трансплантата сохранялась стабильной, пациентке регулярно проводилась коррекция дозы такролимуса по результатам плазменной концентрации препарата. Нежелательных явлений при лечении цинакалцетом не наблюдалось. Полученные результаты подтверждают перспективность применения цинакалцета для лечения третичного ГПТ и возможности отказа от ПТЭ.
Третичный ГПТ – одно из осложнений, развивающихся у больных ХБП после трансплантации почки. Наиболее частой причиной его развития служит тяжелый вторичный ГПТ, неадекватно корригируемый в предтрансплантационном периоде – на додиализном и диализном этапах лечения ХБП. К клинико-лабораторным проявлениям третичного ГПТ относятся не соответствующий функции почечного трансплантата плазменный уровень ПТГ, гиперкальциемия, гипофосфатемия и разнообразная органная патология, наблюдаемая при вторичном ГПТ. При топической диагностике визуализируется одна или несколько увеличенных ОЩЖ. Лечебная тактика при третичном ГПТ предполагает главным образом выполнение ПТЭ. Исследования последних лет свидетельствуют об эффективной альтернативе ПТЭ – использовании препарата класса кальцимиметиков – цинакалцета.



