Помимо эндогенной интоксикации, вызванной нарушением нормальной функции почек, жизненно важной проблемой для пациентов с хронической почечной недостаточностью (ХПН) является хроническая гипоксия разной степени выраженности, обусловленная главным образом анемией вследствие низкой концентрации гемоглобина, хронического воспаления и метаболических нарушений [1–4].
Хронический гемодиализ (ГД) позволяет успешно корректировать некоторые характерные для терминальной стадии ХПН нарушения метаболизма: снижает содержание азотсодержащих уремических метаболитов, нормализует электролитный состав крови, компенсирует метаболический ацидоз. Однако даже применение программного ГД полностью не устраняет, а в ряде случаев даже усугубляет нарушения аэробного метаболизма за счет снижения содержания общего кислорода, неадекватного его транспорта к тканям и изменения сродства гемоглобина к кислороду [5–7].
В процессе трансплантации донорский орган подвергается длительной ишемии, гипоксии и последующей реоксигенации, что способствует активации процессов перекисного окисления липидов (ПОЛ) и изменению антиоксидантных свойств крови. Эти нарушения проявляются усиленной генерацией свободных радикалов кислорода посредством нескольких механизмов, включая окислительное фосфорилирование митохондрий, активацию ксантиноксидазы, фагоцитов, высвобождение железа и кальция, снижение концентрации глутатиона, инактивацию металлоэнзимов, что вызывает дестабилизацию клеточных структур и нарушение проницаемости клеточных мембран. При восстановлении кровотока из тканей трансплантата в кровяное русло поступают патологически измененные продукты метаболизма. Наблюдаемое вследствие этого ухудшение микроциркуляции и функции органа называют реперфузионным синдромом [8–11]. В настоящее время общепризнанно, что вызываемые свободными радикалами кислорода окислительные повреждения мембран занимают важное место среди ишемических и реперфузионных осложнений и оказывают существенное влияние на результаты трансплантации [4, 12].
Целью исследования было изучение метаболических нарушений, возникающих во время трансплантации почки, а также оценка эффективности их коррекции посредством проведения плазмафереза (ПА) в раннем послеоперационном периоде.
Материал и методы исследования
Обследованы 18 реципиентов (12 мужчин и 6 женщин) в возрасте от 19 до 48 лет. Всем больным выполнена типичная трансплантация трупной донорской почки. Причины развития терминальной стадии хронической почечной недостаточности: хронический гломерулонефрит (12 реципиентов), хронический пиелонефрит (3 реципиента), гипертонический нефросклероз (2 реципиента), поликистоз (1 реципиент). Всем больным в предтрансплантационном периоде проведен программный гемодиализ (ГД) в течение от 2 до 6 лет.
Операция трансплантации выполнялась по стандартной методике. Во всех случаях использовали гипотермическую консервацию аллогенных почек в растворе «Кустодиол» от 14 до 28 (18,1 + 4,6) часов. Время вторичной тепловой ишемии не превышало 45 минут. Во время операции пациентам переливали различные кристаллоидные растворы (0,9 %-ный раствор хлорида натрия, раствор Рингера, дисоль, 5 %-ный раствор глюкозы), свежезамороженную плазму, коллоидный раствор ХАЕС, эритроцитарную массу. Состав интраоперационной инфузионной терапии подбирали исходя из артериального давления, диуреза, степени гипергидратации, кровопотери, электролитного состава плазмы крови и т.д. Средняя кровопотеря на протяжении операции составила 0,31 + 0,07 литра, диурез – от 0,15 до 2,1 (0,78 + 0,73).
Больным проведена общая анестезия с искусственной вентиляцией легких. Методом анестезии стала инфузия пропофола по целевой концентрации в эффекторной камере по модели Schnider. Концентрация поддерживалась в пределах 4,0–4,5 мкг/мл. Анальгетический компонент общей анестезии поддерживался болюсным введением фентанила. Миоплегия осуществлялась болюсным введением тракриума или эсмерона по необходимости. Важно отметить, что при использовании концентраций пропофола в эффекторной камере 4,5–5,0 мкг/мл потребности в введении миорелаксантов, как правило, не возникало. Искусственная вентиляция легких кислородо-воздушной смесью проводилась наркозно-дыхательным аппаратом Penlon Prima SP2. Дыхательный объем устанавливался из расчета 8 мл/кг веса. Минутный объем определен из расчета 100 мл/кг. С целью предотвращения ателектазирования рутинно у всех пациентов выставлено PEEP 5 мбар. Поток свежего газа выставлен равным минутному объему вентиляции. Пробуждение, как правило, происходило на операционном столе, экстубация выполнялась по стандартным критериям. Необходимости в продленной искусственной вентиляции легких в послеоперационном периоде при неосложненном течении операции не возникало. В раннем послеоперационном периоде в течение 3–5 часов больным проводилась ингаляция увлажненного кислорода через лицевую маску 3–5 литров в минуту.

Непосредственно в посттрансплантационном периоде (начало сеанса – не позднее 3 часов после реперфузии) проведен сеанс ПА длительностью от 1,5 до 5,0 часов с заменой от 1,25 до 3,50 (2,61 + 0,66) литров плазмы реципиента. В качестве плазмозамещающих растворов использованы раствор Рингера, трисоль, 0,9 %-ный раствор хлорида натрия, 10 %-ный раствор альбумина, ХАЕС и свежезамороженная плазма. Состав инфузионной заместительной терапии каждого больного также колебался в зависимости от конкретной ситуации.
В послеоперационном периоде все больные получали иммуносупрессию, которая включала ингибитор кальциневрина (циклоспорин А или такролимус), микофенолаты и преднизолон. В качестве индукции иммуносупрессии больные получали базиликсимаб и метилпреднизолон.
В гепаринизированной цельной крови исследовали параметры кислотно-основного состояния (КОС) – рН, рО2, рСО2, ВЕ, SВС, уровень гемоглобина, степень насыщения гемоглобина кислородом (sО2); показатели водно-электролитного баланса – концентрации калия, натрия и ионизированного кальция, а также глюкозы. В плазме крови определяли содержание малонового диальдегида (МДА). Свободнорадикальные и антиоксидантные свойства исследовали с помощью метода индуцированной хемилюминесценции (ХЛ). Регистрировали максимальную интенсивность пика индукции ХЛ, отражающую генерацию свободных радикалов кислорода, а также скорость гашения ХЛ, характеризующую антиоксидантную активность (коэффициент антиоксидантной активности – Каоа).
Исследования проведены в артериальной и венозной крови на следующих этапах: Т1 – в начале общей анестезии; Т2 – за 15 минут до пуска кровотока в трансплантате; Т3 – через 15 минут после пуска кровотока в трансплантате; Т4 – через час после пуска кровотока в трансплантате; Т5 – до начала сеанса ПА; Т6 – после сеанса ПА.
На этапе Т3, когда показатели измеряли непосредственно в артериальной и венозной крови трансплантированной почки, рассчитывали утилизацию кислорода по формуле: 100 % х [sО2(артерия) – sО2(вена)/sО2(артерия)] (в %).
Различия между этапами оценивали при помощи дисперсионного анализа с повторными измерениями и апостериорными критериями Тьюки и Фишера. Все данные имели распределение, близкое к нормальному, и представлены как среднее и стандартное отклонение. При значении p < 0,05 различия считали статистически значимыми.
Результаты исследования. Результаты исследования показателей КОС, газов крови, содержания глюкозы и электролитов представлены в табл. 1.
Средние величины pH артериальной и венозной крови в начале общей анестезии находились на нижней границе нормальных значений, затем еще больше снижались, оставаясь таковыми на протяжении всей операции, и нормализовались только после сеанса ПА.
Показатели газового состава – pO2 и pCO2 – в артериальной и венозной крови во время операции не претерпевали значительных изменений. Расчетные параметры КОС крови – BE и SBC, исходно сниженные у пациентов с ХПН, на протяжении операции также существенно не менялись. Однако следует отметить тенденцию к нормализации этих показателей после проведения сеанса ПА.
Средние значения гемоглобина крови, исходно сниженные по сравнению с нормальными, еще больше снижались на протяжении всего исследования, максимально (на 11,9 %) – к концу операции.
 Насыщение гемоглобина кислородом в артериальной крови практически составляло 100 % и соответствовало фракции кислорода в газово-наркотической смеси FiO2 = 0,4–0,5. При этом утилизация кислорода на этапе пуска кровотока в трансплантате была существенно ниже нормальной (26 + 2 %) и составляла всего 14,5 %.
Насыщение гемоглобина кислородом в артериальной крови практически составляло 100 % и соответствовало фракции кислорода в газово-наркотической смеси FiO2 = 0,4–0,5. При этом утилизация кислорода на этапе пуска кровотока в трансплантате была существенно ниже нормальной (26 + 2 %) и составляла всего 14,5 %.
Cредние концентрации калия и натрия на протяжении всего исследования существенно не менялись и оставались в нормальных пределах. Следует отметить тенденцию к повышению значений калия, наиболее выраженную на этапе пуска кровотока в трансплантате (на 5,2 % в артерии и на 13,8 % в вене, оттекающей от трансплантата). Средний уровень ионизированного кальция на начальных этапах операции находился на нижней границе нормальных значений, несколько увеличивался (на 13,1 % в артерии и на 18,3 % в вене) после пуска кровотока в трансплантате и возвращался к исходному к концу сеанса ПА.
Наибольшие отклонения обнаружены в содержании глюкозы, которое равномерно нарастало на протяжении всего исследования и к концу операции превышало исходное в 1,9 и 1,3 раза в артериальной и венозной крови соответственно, оставаясь практически на том же уровне и после сеанса ПА.
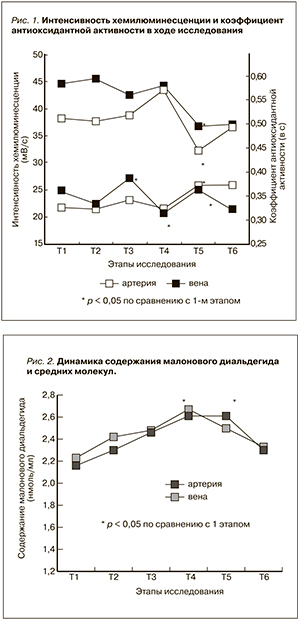
Результаты исследования интенсивности свободнорадикальных процессов и антиоксидантных свойств крови представлены на рис. 1, 2.
На начальных этапах операции интенсивность ХЛ (рис. 1), отражающая генерацию свободных радикалов кислорода, и скорость ее гашения, характеризующая антиоксидантную активность, практически не менялись. Через час после пуска кровотока выявлен некоторый (на 13,8 % по сравнению с этапом общей анестезии) рост интенсивности ХЛ в артериальной крови, затем отмечено выраженное снижение этого показателя (на 26 % в артериальной и 19,5 % в венозной крови по сравнению с предыдущим этапом) к началу ПА и возвращение практически к исходному уровню после сеанса ПА. Следует отметить увеличение значений Каоа (на 17,1 %) в крови, оттекающей от трансплантата, после пуска кровотока и их снижение (на 19,9 %) к концу операции. К началу сеанса ПА значения Каоа несколько повышались (на 15,2 % в артерии и на 12,4 % в вене), а к концу ПА оставались на том же уровне в артериальной крови и незначительно снижались (на 6,8 %) в венозной.
Содержание МДА в артериальной и венозной крови (рис. 2) постепенно и равномерно нарастало (на 20,4 и 12,1 % соответственно) до начала сеанса ПА, после проведения которого практически возвращалось к исходному.
Достоверных различий между содержанием МДА в артериальной и венозной крови на протяжении всего исследования не выявлено.
Обсуждение результатов
В начале операции у всех обследованных пациентов были выявлены характерные для больных ХПН нарушения гомеостаза: метаболический ацидоз, дефицит буферных оснований, сниженное содержание гемоглобина и ионизированного кальция. Метаболический ацидоз еще более усугублялся на протяжении оперативного вмешательства, что объяснялось, по нашему мнению, поступлением из трансплантата накопленных за период ишемии недоокисленных продуктов. Тем же, по нашему мнению, можно объяснить и нарастание содержания ионизированного кальция крови на протяжении операции, максимально выраженное в вене (на 18,3 %) после включения трансплантата в кровоток, а также тенденцию к повышению концентрации калия (на 13,8 %) на том же этапе в крови, оттекающей от трансплантата.
Некоторое снижение уровня гемоглобина, наиболее выраженное к концу операции (на 11,9 %), было обусловлено значительной гемодилюцией и отчасти кровопотерей.
Выявленная гипергликемия на протяжении всего исследования была, по-видимому, связана с использованием больших доз метилпреднизолона.
Стабильные показатели КОС и газового состава крови на протяжении всей операции подтверждали сохранность дыхательной функции легких и на первый взгляд адекватность анестезиологического обеспечения. Однако, несмотря на это, расчет утилизации кислорода на этапе пуска кровотока в трансплантате выявил наличие выраженного дефицита кислорода, что, на наш взгляд, подчеркивает патологический характер метаболических процессов, протекающих в трансплантате сразу после реперфузии.
Известно, что тотальная и длительная ишемия трансплантата характеризуется полным прекращением доставки кислорода, а дефицит кислорода играет главную роль в патогенезе ишемических повреждений, одним из существенных механизмов которых является активация кислородозависимых процессов ПОЛ.
В нашем исследовании на начальных этапах операции отмечена стимуляция процессов ПОЛ, что подтверждено нарастанием уровня МДА на фоне неизменных значений интенсивности ХЛ и Каоа. Более высокие показатели, характеризующие процессы генерации свободных радикалов кислорода и антиоксидантной активности, выявленные в венозной крови по сравнению с артериальной, были, вероятно, обусловлены как тяжестью общего состояния реципиента и самим хирургическим вмешательством, так и ишемическим и реперфузионным повреждением.
Отмеченное через 15 минут после включения донорской почки в кровоток усиление антиоксидантной активности в оттекающей от органа крови свидетельствовало о поступлении в кровь внутриклеточных антиоксидантов, по-видимому, из-за реперфузионного повреждения трансплантата. Выявленное через час после пуска кровотока некоторое нарастание свободнорадикальной активности в артериальной крови было, по нашему мнению, обусловлено истощением факторов антиоксидантной защиты, что подтверждено снижением значений Каоа.
На основании полученных данных можно полагать, что на протяжении всей операции вплоть до начала сеанса ПА в организме реципиента происходило накопление токсических продуктов ПОЛ, что подтверждено значительным увеличением концентраций МДА (промежуточного продукта процессов ПОЛ). Снижение интенсивности свободнорадикальных процессов и повышение активности антиоксидантной защиты на фоне высоких значений МДА к моменту начала процедуры ПА свидетельствовали, по нашему мнению, о нарушениях метаболизма, обусловленных изменением антиоксидантных защитных свойств, и о продолжавшемся накоплении недоокисленных продуктов, токсичных для организма.
Применение ПА способствовало коррекции гомеостаза: подавлялась активность свободных радикалов кислорода и существенно снижалось содержание токсических продуктов, что подтверждено неизменной интенсивностью ХЛ и значительным падением концентрации МДА. Некоторое уменьшение значений Каоа, выявленное в венозной крови после сеанса ПА и, вероятно, обусловленное вымыванием низкомолекулярных антиоксидантов в процессе ПА, компенсировалось адаптивным повышением факторов антиоксидантной защиты в артериальной крови, что было, по нашему мнению, связано внутривенным введением 10 %-ного раствора альбумина во время ПА.
Альбумин, являясь основным осмотическим компонентом плазмы, выполняет также антиоксидантную и транспортную функцию. Взаимодействуя с жирными кислотами, в первую очередь с ненасыщенными, альбумин предохраняет их от пероксидации. С другой стороны, альбумин способен связывать и таким образом инактивировать продукты их окисления, защищая клеточные структуры от повреждающего воздействия свободных радикалов кислорода [13, 14].
Однако, говоря о защитных свойствах альбумина плазмы у больных ХПН, необходимо помнить, что в условиях уремии связывающая способность альбумина резко снижается, поскольку центры связывания блокируются (по механизму конкурентного ингибирования) эндогенными токсинами [15, 16]. Кроме того, следует учитывать, что при стимуляции свободнорадикальной активности окислительной модификации подвергаются также и белковые компоненты антиоксидантной системы, что приводит к потере ими антиоксидантных свойств [17, 18]. Частичная замена во время ПА альбумина плазмы реципиента со сниженными антиоксидантными свойствами на неповрежденный альбумин способствовала, по нашему мнению, коррекции работы системы антиоксидантной защиты.
Заключение
Таким образом, полученные результаты свидетельствуют о следующем: во время трансплантации почки на фоне нарушения аэробного метаболизма, проявляющегося гипоксией, ацидозом и накоплением глюкозы в крови, в организме реципиента имеет место стимуляция свободнорадикальной активности и как следствие – процессов ПОЛ.
В этих условиях трансплантат, ослабленный гипотермической консервацией, подвергается обратимому реперфузионному повреждению, на что указывает выброс в кровь внутриклеточных антиоксидантов и повышение концентрации ионизированного кальция через 15 минут после пуска кровотока в трансплантате. Высокий уровень пероксидации во время операции существенно затрудняет восстановление функции трансплантата, что проявляется в ухудшении утилизации кислорода. Сеанс ПА, проведенный сразу после операции, нивелировал негативное воздействие токсических недоокисленных продуктов, способствовал нормализации процессов ПОЛ и как следствие – способствовал более быстрому восстановлению трансплантированной почки и улучшению общего состояния реципиента.



