Сегодня не вызывает сомнений, что почка действительно играет ведущую роль в патогенезе гипертонии [1] и одновременно является одним из приоритетных ее органов-мишеней. В 1970-х гг. K. Dahl в своих исследованиях [2–4] показал, что первичное нарушение, которое происходит в транспортной системе почек, может стать причиной гипертонии. Данные морфологических исследований почечных биоптатов пациентов с гипертонической болезнью (ГБ) демонстрируют выявление гипертонического нефросклероза от 1,8 до 2,5% [5, 6], однако даже в случае морфологической верификации нефросклероза выживаемость этой категории больных невысока. Так, по данным B.E. Vikse [7], у 32% леченых пациентов с гипертоническим нефросклерозом, подтвержденным гистологически, на протяжении 13 лет развивается терминальная почечная недостаточность [8]. Этот факт обращает внимание клиницистов на важность выявления фиброза почечной ткани на ранних этапах заболевания и с помощью менее инвазивного метода. Так, в 1968 г. R.A. Risdon [9] впервые показал, что снижение уровня клубочковой фильтрации коррелирует главным образом со степенью тубулоинтерстициальных, а не клубочковых повреждений и большинство изменений, определяющих исход заболеваний почек, происходит именно в почечном интерстиции [9–11].
Одним из важнейших элементов, отражающих функцию тубулоинтерстициальной ткани (ТИТ) почек, является уровень экскреции натрия. Натрийурез служит маркером поражения ТИТ почек [12–14]. Как известно, активность ангиотензина II (АТII) в значительной степени влияет на задержку натрия: активность АТII растет пропорционально снижению натрийуреза [15–17] и как следствие – приводит к повышению АД. Большое значение имеет пикообразный натрийурез [18, 19], который способствует усиленной ретенции натрия и отложению его в стенках сосудов, что увеличивает их жесткость [18, 20].
Таким образом, целью исследования стало выявление взаимосвязи избыточного потребления соли с признаками поражения ТИТ почек (степень воспаления, фиброза, степень активации переносчиков натрия) у пациентов с гипертонической болезнью.
Структура исследования
Проведен забор морфологического материала – почек, тонкой кишки, миокарда. Материал фиксировался в 10%-ном растворе забуференного формалина. Гистологическое и иммуногистохимическое исследования забранного материала проведены в Федеральном научно-клиническом центре детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева.
При проведении иммуногистохимического исследования потребовался набор полярных образцов для верификации полученных данных, составлявших группу контроля (практически здоровые и имевшие ГБ III стадии).
Критерии включения:
- Мужчины и женщины в возрасте от 18 до 60 лет.
- Досуточная смерть.
- Внезапная смерть.
- Абдоминальное ожирение.
- Наличие гипертонической болезни 1-й стадии.
- Отсутствие патоморфологических и гистологических признаков ишемической болезни сердца, сердечной недостаточности и другой сердечно-сосудистой патологии.
- Отсутствие патоморфологических и гистологических признаков поражения почек.
Критерии невключения:
- Мужчины и женщины младше 18 лет и старше 60 лет.
- Смерть в течение более суток.
- Признаки гнилостных изменений.
- Смерть от сердечно-сосудистых событий, онкологических заболеваний; передозировки токсических веществ.
- Наличие патоморфологических и гистологических признаков ишемической болезни сердца, сердечной недостаточности и другой сердечно-сосудистой патологии.
- Наличие патоморфологических и гистологических признаков поражения почек.
Характеристика пациентов
В исследование было включено всего 18 умерших, из них двое имели гипертоническую болезнь 3-й стадии, 5 практически здоровых, по всем остальным параметрам соответствовали критериям включения. Одиннадцать человек, включенных в исследование, полностью соответствовали критериям включения.
Из 18 умерших, включенных в исследование пациентов, 10 мужчин и 8 женщин. В среднем возраст умерших составил 40±10 лет, объем талии в среднем – 102±12,5 см, рост – 170±7,7 см, масса миокарда – 319±53 г. При вскрытии у всех умерших отмечено различной степени утолщение подкожной жировой клетчатки, отложение ее в брыжейке, сальнике и забрюшинном пространстве. В остаточной моче клинически значимой альбуминурии не определялось (<30 мг/г). Основные причины смерти: падение с высоты (33,3%), железно-дорожная травма (27,7%), внезапная асфиксия (27,7%). Другие причины внезапной смерти составили 11,3% (автомобильная травма, колотое ранение в сердце).

Методы исследования
Абдоминальное ожирение
Абдоминальное ожирение определяли путем измерения окружности талии, располагая сантиметровую ленту посередине между краями реберной дуги и гребнями подвздошных костей. Абдоминальным ожирением считали, если окружность талии более 88 см для женщин и более 102 см для мужчин [21].
Гистологическое исследование
Проведено гистологическое исследование забранного материала. Окраска препаратов: гематоксилином-эозином. Определяли наличие морфологических изменений соответствующих первой стадии гипертонической болезни (гипертрофия мышечного слоя и эластических структур артериол и мелких артерий, спазм артериол). При наличии выраженных распространенных морфологических изменений артериол и артерий и вторичных изменений внутренних органов, обусловленных изменениями сосудов и нарушением внутриорганного кровообращения, при наличии других признаков поражений почек, ишемической болезни, онкологических заболеваний образец исключался из исследования.
Иммуногистохимическое исследование
Проведено иммуногистохимическое исследование забранных образцов, определены следующие маркеры: тубулярный NF-kB, TGF-β1, МСР-1, остеопонин, Na+,K+-АТФаза, ТНР (Tamm-Horsfall protein), NHE-3.
Применяли непрямой двухшаговый метод (первичные антитела и система визуализации):
- Для определения перегрузки эпителия проксимальных канальцев натрием и белком определяли активированный тубулярный нуклеарный фактор (NF-kB). Использовали кроличьи античеловеческие антитела к р105 NF-kappa-B (NF-kappa-B p105 subunit 1) «Cusabio», США (кат. №: CSB-PA10354A0Rb), и к NF kappa B/p65 (Rel A) Ab-1 «Thermo Fisher Scientific», США (кат. №: RB-1638-P).
- Для косвенного определения перитубулярной мононуклеарной инфильтрации, а также интерстициального фиброза определяли трансформирующий фактор роста (TGF-β1). Использовали кроличьи античеловеческие антитела к CD105 (Endoglin – TGF beta 1) «Thermo Fisher Scientific», США (кат. №: RB-9291-P).
- Для определения активности интерстициального воспаления определяли экспрессию тубулярными эпителиальными клетками и мононуклеарными клетками инфильтрата в зонах интерстициального воспаления, определяли моноцитарный хемоаттрактантный протеин-1 (МСР-1). Использовали кроличьи античеловеческие антитела к МСР-1 «Cusabio», США (кат. №: CSB-PA025616GA01HU).
- Для определения активности хемотаксиса макрофагов в ткани определяли остеопонин. Использовали кроличьи античеловеческие антитела к Osteoponin «Thermo Fisher Scientific», США (кат. №: RB-9097-P0).
- Для определения активности Na+/K+-АТФазы плазматических мембран использовали кроличьи античеловеческие антитела к Na+/K+-ATPasa «Thermo Fisher Scientific», США (кат. №: RB-7712-P2).
- Для определения адаптации почечных канальцев к гипернатриемии определяли белок Тамма–Хорсфала (ТНР (Tamm-Horsfall protein)), использовали THP elisa kit: Human T H glycoprotein ELISA Kit.
- Для определения активности изоформы 3 белка Na/H-антипортера (Na/H-exchanger isoform 3, NHE3) использовали Phospho-NHE3 pSer522 Antibody (14D5), «Thermo Fisher Scientific», США.
Методы статистической обработки материалов
Для статистической обработки полученных данных использовали программное обеспечение Statistica 10.0. Нормальность распределения определялась с помощью критерия Шапиро–Уилка и критерий Колмогорова–Смирнова. При изложении результатов пользовались методами непараметрической и параметрической статистики. Количественные показатели представлены в форме среднее значение (M)±стандартное отклонение (S) или медиана, 25-й и 75-й процентиль. Для сравнения групп применялся t-критерий Стьюдента при правильном распределении, критерий Вилкоксона – при неправильном. Для сравнения результатов между независимыми выборками применяли критерий Манна–Уитни, для сравнения бинарных распределений использовался χ-квадрат Пирсона. С целью выявления связи факторов между собой были использованы однофакторная и многомерная регрессионные модели, для бинарных данных логит регрессионная модель, непараметрический метод ранговый коэффициент конкордантности Кендалла, непараметрический метод ранговой корреляции Спирмена. Для решения задач классификации и кластеризации данных использовался модуль Data Mining методом к-средних, k-ближайших соседей (модуль MARSplines). При проверке статистических гипотез нулевую гипотезу отвергали при уровне значимости менее 0,05.
Результаты исследования
Изучение активности маркеров воспаления тубулоинтерстициальной ткани почек
Все изучаемые образцы были разделены на три квартили в зависимости от массы миокарда, поскольку морфологические проявления ГБ, в частности масса миокарда, зависят от длительности гипертонического анамнеза и характера течения ГБ. В верхний квартиль включены образцы с массой миокарда более 350 г (как ожидалось, они соответствовали двум контрольным образцам с ГБ 3-й стадии), в средний квартиль включены образцы с массой миокарда более 270 г и менее 350 г (n=11), в нижний квартиль включены образцы с массой миокарда менее 270 г (5 образцов, соответствовавших практически здоровым умершим).
При анализе показателей экспрессии иммуногистохимических маркеров воспаления в ТИТ почек (табл.1) показано, что образцы, составлявшие среднюю квартиль (n=11), – основная исследуемая группа, имели достоверно более интенсивную окраску по сравнению с образцами нижней квартили и менее выраженную окраску по сравнению с образцами верхней квартили. Установлено, что маркеры, отвечающие за воспалительные процессы в ТИТ почек, обладали более высоким процентом экспрессирующих клеток и интенсивностью иммуногистохимической реакции: TGF-β1, МСР-1 и в большей степени ТН, по сравнению с маркерами фиброза – тубулярный NF-kB и остеопонин (остеопонин может экспрессироваться за счет многих факторов). Интенсивность экспрессии по сравнению с контрольной группой увеличилась в 1,9 раза для тубулярного NF-kB, в 2,1 – для TGF-β1, в 1,6 – для МСР-1, в 3,8 – для ТНР и в 1,6 раза – для остеопонина. Таким образом, в изучаемой группе статистически значимо увеличивается интенсивность экспрессии маркеров воспаления, при этом менее выражена экспрессия маркеров фиброза в ТИТ почек.
 Изучение активности маркеров переносчиков натрия
Изучение активности маркеров переносчиков натрия
Анализ экспрессии маркеров переносчиков натрия: NHE-3 и Na+,K+-АТФаза (в почках и кишке), в исследуемых образцах показал более выраженную экспрессию клеток с маркером NHE-3 (табл.2). Обращает на себя внимание сравнительно одинаковая интенсивность экспрессии маркеров Na+,K+-АТФаза в почках и кишке.
Активность переносчиков в изучаемой группе по сравнению с контрольной возрастала: Na+,K+-АТФаза в почке возросла в 1,3 раза, NHE-3 в кишке – в 1,8 раз и Na+,K+-АТФаза в кишке – в 3 раза. Полученные результаты позволяют судить о повышенном потреблении соли прижизненно.
Изучение взаимосвязи маркеров воспаления тубулоинтерстициальной ткани почек и маркеров переносчиков натрия
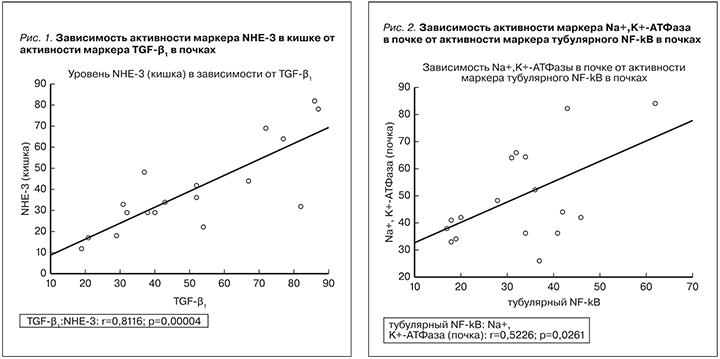
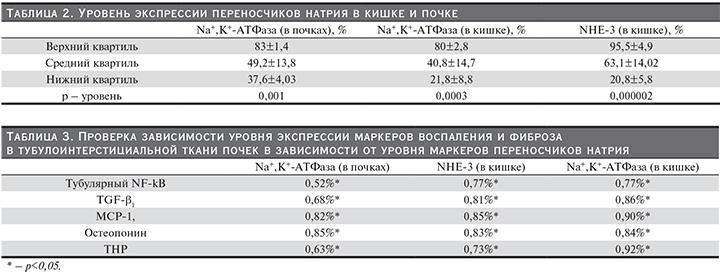
С целью изучения возможности зависимого изменения друг от друга уровня маркеров воспаления, фиброза в ТИТ почек и уровня маркеров избыточного потребления натрия был проведен корреляционный анализ. Было установлено: все маркеры достоверно высокозначимо коррелируют друг с другом (табл. 3). Наиболее сильная корреляция была выявлена между «ТНР и Na+,K+-АТФаза (в кишке)» и «МСР-1 и Na+,K+-АТФаза (в кишке)». На рис. 1 и 2 для большей наглядности графически представлены результаты корреляционного анализа. Можно заключить, что существует зависимость между этими параметрами.
Для изучения зависимости уровня воспаления от уровня потребления натрия проведен однофакторный и многофакторный регрессионный анализ. В качестве зависимых переменных выбраны маркеры переносчиков натрия и маркеры воспаления в почках.
При проведении однофакторного анализа в качестве маркера воспаления в ТИТ почек был выбран ТНР, в связи с тем что он обладал наибольшей интенсивностью иммуногистохимической реакции в изучаемой группе. Установлен наибольший уровень связи ТНР с Na+,K+-АТФазой в кишке: b*=0,92; r2=0,84 (p<0,00001), в меньшей степени – с NHE-3 в кишке: b*=0,73; r2=0,50 (p<0,00055), и Na+,K+-АТФазой в почках: b*=0,63; r2=0,36 (p<0,0046).
Многофакторный анализ показал следующие результаты:
- зависимость ТНР от Na+,K+-АТФазы в кишке и почках и NHE-3 в кишке составила r2=0,88, p=0,000051;
- зависимость тубулярного NF-kB от Na+,K+-АТФазы в кишке и почках и NHE-3 в кишке составила r2= 0,61, p=0,011;
- зависимость тубулярного TGF-β1 от Na+,K+-АТФазы в кишке и почках и NHE-3 в кишке составила r2=0,65, p=0,008;
- зависимость тубулярного МСР-1 от Na+,K+-АТФазы в кишке и почках и NHE-3 в кишке составила r2=0,87, p=0,00006;
- зависимость тубулярного остеопонина от Na+,K+-АТФазы в кишке и почках и NHE-3 в кишке составила r2=0,86, p=0,000083.
Установлено, что уровень всех маркеров воспаления в ТИТ почек взаимосвязан в той или иной степени с уровнем маркеров переносчиков натрия. Однако выявлена наиболее значимая статистическая зависимость уровня маркеров ТНР и МСР-1 с активностью маркеров переносчиков натрия.
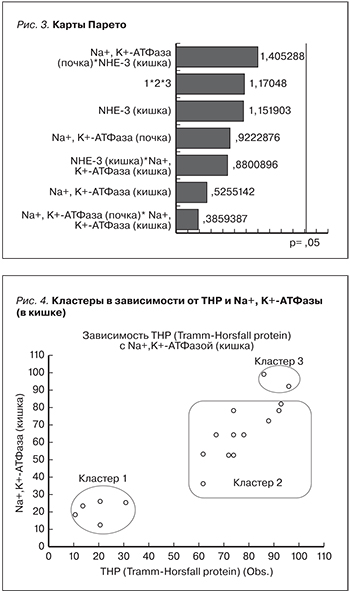
Для выявления наиболее значимых и существенных маркеров, влияющих на поражение в ТИТ почек, построены карты Парето (рис. 3). На рисунке показано ранжирование маркеров в порядке значимости. Наиболее значимыми маркерами, уровень которых влияет на интенсивность воспаления в ТИТ почек, оказалось сочетание высокого уровня маркеров – переносчиков натрия: Na+,K+-АТФазы в почке и NHE-3 в кишке.
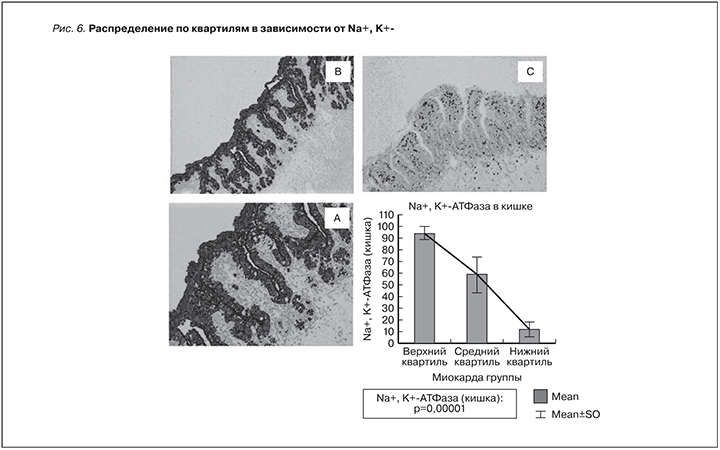
С целью более точной независимой классификации полученных результатов проведен многомерный регрессионной анализ MARSplines. Установлено, что наиболее точным предиктивным значением обладали ТНР и Na+,K+-АТФаза (в кишке). Были сформированы кластеры в зависимости от данных маркеров, фактически совпадающие с ранее сформированными квартилями в зависимости от объема миокарда (рис. 4): 1-й и 3-й кластеры соответствуют полярным образцам, 3-й кластер – основной изучаемой группе.
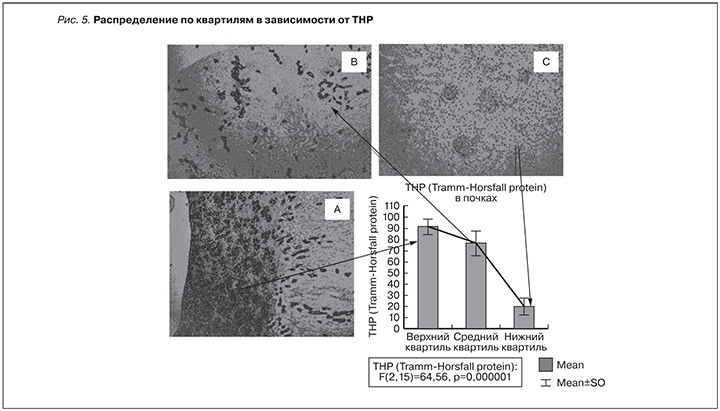
Рис. 5 и 6 иллюстрируют полученные данные: иммуногистохимическая окраска маркеров воспаления в ТИТ почек (THP) и переносчиков натрия в кишке (Na+,K+-АТФаза), наиболее интенсивная в образцах верхней квартили (А), в средней квартили (B) окраска средней интенсивности, в нижней квартили (С) окраска имеет наименьшую интенсивность.
Обсуждение
Как известно, ТИТ почек выполняет ряд важных функций, вовлекается в патологический процесс при кардиальной патологии раньше клубочкового аппарата [22], о чем свидетельствуют прямая корреляция выраженности интерстициального фиброза со снижением клиренса креатинина и наличие «атубулярных» нефронов. Таким образом, относительно сохранная клубочковая структура не подразумевает нормального функционирования нефрона, поэтому при оценке почечной функции и ранней диагностике поражения почек при ГБ важно использовать методы, оценивающие как функцию клубочка, так и состояние ТИТ почек. На различных уровнях кардиоренального континуума выявляются различные маркеры поражения почки. Чем раньше будет распознан патологический процесс, тем быстрее возможно будет на него воздействовать, тем самым замедляя прогрессирование поражения почек, а может быть, и останавливая его.
Как известно, для диагностики поражения почек при ГБ используются следующие показатели: креатинин сыворотки крови, клиренс креатинина и расчетная скорость клубочковой фильтрации (СКФ), нагрузочные пробы, экскреция белка с мочой и др. В настоящее время о поражении ТИТ почек нельзя судить по рутинным показателям, требуются более сложные и чувствительные маркеры. Большинство из них было изучено при гломерулонефритах, в то время как исследованию ТИТ почек при ГБ посвящено крайне мало работ. Особое внимание привлекает определение мочевой экскреции отдельных медиаторов фиброгенеза, в частности трансформирующего фактора роста-β1 [TGF-β1], его продуктов (коллаген IV типа), сосудисто-эндотелиального фактора роста (VEGF) и компонентов эндотелий-зависимого звена гемостаза (ингибитор активатора плазминогена типа 1 – PAI-1).
TGF-β – мультифункциональный цитокин, впервые выделенный из тромбоцитов в 1990-х гг. [23]. Свое название TGF-β получил благодаря способности стимулировать рост клеток и вызывать их трансформацию in vitro. TGF-β в норме является важным регулятором клеточной пролиферации, дифференцировки, апоптоза, иммунного ответа, ремоделирования экстрацеллюлярного матрикса [24]. Высокий уровень TGF-β найден в тромбоцитах и костной ткани, in vitro он продуцируется клетками многих типов [25]. Выделено три типа специфических высокоаффинных рецепторов для TGF-β (I, II и III типа), которые экспрессируются многими клетками [23]. Несмотря на то что in vitro три изоформы TGF-β оказывают однонаправленный эффект на клетки, считают, что in vivo наиболее профиброгенным является TGF-β1, так как повышение синтеза этой изоформы показано у человека при заболеваниях, сопровождающихся выраженным фиброзом ткани почек. У пациентов с различными нефропатиями степень экспрессии TGF-β1 в ткани почек коррелирует с площадью интерстициального фиброза [26]. T. Yamamoto [27] полагает, что все три изоформы TGF-β играют роль в прогрессировании гломерулосклероза и интерстициального фиброза. Иммуногистохимическим методом была отмечена выраженная экспрессия трех изоформ TGF-β в гломерулах и интерстиции при различных формах нефрита (IgA-нефропатии, фокально-сегментарном гломерулосклерозе, нефрите с полулуниями и диффузном пролиферативном волчаночном нефрите), сопровождающихся накоплением фибронектина, а также ингибитора активатора плазминогена-1 (PAI-1). Повышение количества мРНК TGF-β всех изоформ отмечено в клубочках, а также в перигломерулярных и тубулоинтерстициальной областях, местах макрофагальной инфильтрации и отложений эндоплазматического ретикулума. В интерстиции TGF-β экспрессировался макрофагами, а также клетками канальцев с перитубулярной мононуклеарной инфильтрацией и артерий с утолщенной интимой [27].
МСР-1 был впервые идентифицирован как продукт секреции моноцитарных лейкемических клеток, стимулированных липополисахаридом, а также мононуклеарных клеток периферической крови [28]. МСР-1 является не только хемоаттрактантом, обеспечивающим миграцию и экстравазацию мононуклеарных клеток в очаг воспаления, но и медиатором воспаления, при этом активируя резидентные клетки. Увеличение количества МСР-1 в моче выявлено у животных с прогрессирующими почечными заболеваниями, его уровень в моче коррелирует с экскрецией альбумина [29]. С помощью иммуногистохимических методов и гибридизации in situ показано, что в ткани почек человека МСР-1 экспрессируется тубулярными эпителиальными клетками, мононуклеарными клетками инфильтрата в зонах интерстициального воспаления и эндотелиальными клетками сосудов [30, 31]. Таким образом, согласно большинству исследований, проведенных при заболеваниях почек у животных и человека, МСР-1 играет важную роль в прогрессировании гломерулонефрита и развитии почечной недостаточности, главным образом за счет формирования тубулоинтерстициального повреждения. Активация синтеза МСР-1 служит общим патофизиологическим механизмом прогрессирования тубулоинтерстициального повреждения и фиброза как при воспалительных нефропатиях, так и при невоспалительных заболеваниях почек, протекающих без выраженных обострений [32], например при ГБ.
Большой интерес представляет тубулярный NF-kB. Он присутствует в неактивной форме в цитоплазме большинства клеток и активируется после протеолитической деградации субъединицы IB. Избыток белков в эпителии проксимальных канальцев и перегрузка натрием активируют NF-kB. Фактор NF-kB играет ключевую роль в образовании провоспалительных цитокинов, а также молекул адгезии. Кроме того, NF-kB стимулирует ангиотензиноген-предшественник для местного производства АТ II [33, 34].
Морфологическим маркером избыточного потребления соли можно считать Na-K-АТФазу. При избыточном потреблении соли количество Na-K-АТФазы в канальцах возрастает [35, 36]. На экспериментальных моделях гипертензивных крыс Milan показано, что манифестации гипертонии предшествует задержка натрия, при этом экскреция натрия остается на том же уровне и причиной служит увеличение активности ферментов переносчиков [37]. Также была показана роль Na-K-АТФаза в формировании соль-чувствительности на модели Dahl соль-чувствительных крыс [38]. Наиболее значимым в отношении Na-K-АТФазы было исследование, проведенное D. Kennedy [39], в котором показано, что диета с высоким содержанием жиров приводит к увеличению экспресии Na-K-АТФазы и формированию воспаления в ТИТ почек.
ТНР (Tamm-Horsfall protein) – крупный гликопротеид, синтезирующийся в толстой восходящий петле Генле [40]. Существуют работы [41–43], показывающие, что выраженность воспаления в интерстиции почек зависит от активности ТНР. В своем исследовании Kottgen [44] изучал прогностическую роль ТНР в отношении развития хронической болезни почек (ХБП). Автор показал высокую достоверную взаимосвязь снижения СКФ и уровня экскреции ТНР.
В исследовании, проведенном С. Brett [45], показано, что плотность экспрессии NHE-3 увеличивается под влиянием увеличения потребления натрия. В исследовании J. Lewis [46] показана роль NHE-3 в формировании соль-чувствительности. Наиболее интересно исследование K.L. Aldred [47], в котором показано увеличение плотности экспрессии под влиянием высокосолевой диеты не только NHE-3, но Na-K-АТФазы.
Еще одним маркером поражения ТИТ почек можно считать остеопонтин. В исследовании Giachelli [48] доказана роль остеопонтина в АТII-индуцированном тубулоинтерстициальном нефрите. Увеличение экспрессии остеопонтина может быть при ряде нефрологических заболеваний, например при гломерулонефрите [49], мочекаменной болезни [50], однако он может повышаться и при различных онкологических заболеваниях, поэтому его нельзя считать специфичным для поражения ТИТ почки [51].
Таким образом, при всей важности значения общего количества клубочков в развитии ГБ, по-видимому, существуют структуры в нефроне, поражение которых происходит намного раньше, чем снижение количества клубочков. Наиболее интересна тубулоинтерстициальная ткань почек, т.к. ее повреждение может возникнуть даже уже вследствие избыточного потребления натрия. Влияние избыточного потребления натрия на функцию интерстициальной ткани почек показано в экспериментальном исследовании, проведенном M.I. Roson [33]. Было показано, что диета с повышенным содержанием натрия в диете крыс приводила к повышенной экспрессии в ТИТ таких маркеров, как NF-kB, TGF-β1, RANTES и ИЛ-6. Однако для современного общества характерна хроническая перегрузка солью, как правило, связанная с особенностями диеты, в отличие от данных моделей крыс, получавших острую перегрузку натрием. В своем исследовании J. Park [52] изучал как острую перегрузку натрием, так и хроническую, создавая экспериментальные модели. Было показано, как и в предыдущей работе, что перегрузка натрием приводила к возникновению воспаления в ТИТ почек: увеличение экспрессии маркеров MCP-1, SMA, TGF-β1, коллагена III типа. При изменении диеты на низкосолевую в моделях с хронической перегрузкой регресса воспалительных процессов не происходило, в отличие от моделей с острой перегрузкой натрием. Наше исследование, проведенное на внезапно умерших пациентах с установленным гипертоническим анамнезом, также показывает, что увеличение экспрессии маркеров воспаления в ТИТ почек зависит от стадии ГБ: у образцов, имевших ГБ 3-й стадии, интенсивность экспрессии маркеров воспаления была значительно выше. Самым чувствительным маркером оказался ТНР (76±10,9% – в основной исследуемой группе образцов vs 91±7,07% и 19,6±7,7% в полярных образцах; р=0,0000004). Поскольку определить количество потребляемой соли у умерших было технически не возможно, в доказательство высокого потребления соли при жизни всем образцам был определен уровень маркеров переносчиков натрия в почках и кишке. Была установлена четкая зависимость между увеличением экспрессии переносчиков натрия и уровнем воспаления в почках. В работе [36] R. Yilmaz показал влияние высокосолевой диеты на уровень не только АД, но и системного воспаления. У пациентов, перенесших трансплантацию почки, также было показано, что перегрузка натрием и гипернатриемия приводят к ухудшению функции почек [53].
Таким образом, результаты проведенного исследования показывают наличие четкой зависимости между уровнем экспрессии маркеров переносчиков натрия и таковым экспрессии маркеров воспаления в ТИТ почек, что в свою очередь связано с тяжестью ГБ. Было показано, что при ГБ 1-й стадии уже существует поражение ТИТ почек.



