Введение
Данные о частоте и характере поражения почек пациентов со спондилоартритами (СпА) неоднозначны. К наиболее распространенным вариантам поражения почек относятся вторичный амилоидоз почек (АА), нефропатия, индуцированная приемом нестероидных противовоспалительных средств (НПВС), гломерулонефрит, реже – нефролитиаз. Отдельные признаки поражения почек (микрогематурия, микроальбуминурия, повышение сывороточного креатинина) встречаются достаточно часто – до 35% [1].
В 2018 г. опубликованы результаты исследования ASAS-COMOSPA (22 страны, 2098 пациентов с СпА), в ходе которого изучалась распространенность и взаимосвязь различных факторов с нарушением почечной функции. Выявлена связь почечной дисфункции с возрастом, носительством HLA-В27 и уровнем СРБ, а связи с факторами кардиоваскулярного риска, тяжестью заболевания и приемом НПВС не обнаружено [1].
Частота различных видов поражения почек при анкилозирующем спондилите (АС) составляет 5–20%, наиболее распространенными вариантами почечного поражения являются вторичный амилоидоз почек (62%), IgA-нефропатия (29%), мезангиопролиферативный гломерулонефрит (5%), фокальный сегментный гломерулосклероз (1%) и фокальный пролиферативный гломерулонефрит (1%), НПВС-нефропатия (2%) [2].
Внедрение генно-инженерных биологических препаратов (ГИБП) в терапию пациентов с СпА позволило улучшить контроль активности заболевания, снизить число осложнений и повысить качество жизни пациентов. В настоящее время нет точных данных о влиянии ГИБП на функцию почек и рекомендаций по мониторингу почечной функции пациентов, получающих биологическую терапию как при СпА, так и при ревматоидном артрите (РА), хотя внедрение ГИБП при РА произошло раньше [3].
Цель – оценить состояние почек пациентов со спондилоартритами (СпА), получавших терапию ГИБП в течение года.
Материал и методы
В исследование включены 18 пациентов (мужчин 72,2%) с СпА: 15 (83,3%) пациентов с АС, соответствующим международным Нью-Йоркским критериям 1984 г., 3 (16,7%) пациента с псориатическим артритом (ПсА), соответствующим критериям CASPAR 2006 г. В течение года все пациенты получали терапию ГИБП: 14 (77,8%) – инфликсимаб, 2 (11,1%) – этанерцепт, 2 (11,1%) пациента – голимумаб.
В ходе исследования учитывали возраст пациента в дебюте заболевания и его возраст при начале терапии ГИБП, активность заболевания по индексам BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) и ASDAS (Ankylosing Spondylitis Disease Activity Score), характер терапии до начала и через год применения ГИБП.
Определяли скорость оседания эритроцитов (СОЭ), уровень C-реактивного белка (СРБ), уровень сывороточного креатинина, мочевины, рассчитывали скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI, выполнялся общий анализ мочи (ОАМ), при наличии патологии в ОАМ – суточная протеинурия, ультразвуковое исследование (УЗИ) почек.
Статистическая обработка данных проводилась с использованием ПО Statistica 6.0. Описание количественных признаков с ненормальным распределением проводилось с указанием медианы, нижнего и верхнего квартилей. Для оценки динамики активности заболевания и СКФ использовали критерий Вилкоксона, статистически значимыми считали различия при р<0,05.
Результаты
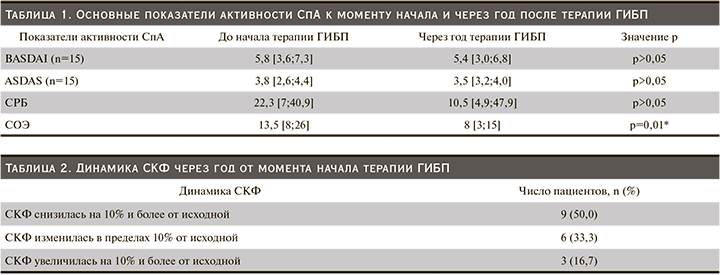
Возраст пациентов в дебюте СпА составил 20 (16–27) лет, длительность заболевания до начала терапии ГИБП – 14,5 (9–23) года. Показатели активности СпА на момент старта терапии ГИБП представлены в табл. 1.
Большинство (14–77,8%) пациентов в составе комбинированной терапии получали базисные противовоспалительные препараты (БПВП), 4 (22,2%) принимали только НПВС или комбинацию НПВС и глюкокортикостероидов (ГКС). Все пациенты на момент начала терапии ГИБП получали НПВС; один пациент самостоятельно принимал несколько НПВС в дозах, превысивших рекомендованные суточные в связи недостаточной эффективностью базисной терапии; одной пациентке требовалось введение трамадола из-за неэффективности НПВС.
В динамике на фоне терапии ГИБП число пациентов, нуждавшихся в ГКС, уменьшилось с 17 до 10, продолжался прием БПВП и НПВС. Применение ГИБП позволило пациентке, получавшей трамадол, снизить дозу препарата, пациенту, нуждавшемуся в сверхвысоких дозах НПВС, выполнена корригирующая остеотомия, достигнуто уменьшение активности АС.
Медиана СКФ до начала терапии ГИБП составила 105,5 (89–118) мл/мин/1,73 м2. При этом СКФ больше 89 мл/мин/1,73 м2 отмечена у 13 (72,2%) пациентов, в диапазоне от 60 до 89 мл/мин/1,73 м2 – у 3 (16,7%), СКФ меньше 60 мл/мин/1,73 м2 – у 2 (11,1%) пациентов (один с НПВС-нефропатией, одна – с нормальным уровнем сывороточного креатинина при наличии низкого удельного веса мочи, лейкоцитурии).
Через год от начала терапии ГИБП медиана СКФ снизилась (р=0,045) и составила 86,5 (79–109) мл/мин/1,73 м2. Характер изменений СКФ на фоне терапии ГИБП представлен в табл. 2. У 5 (27,8%) пациентов с исходно нормальной СКФ отмечено ее снижение до диапазона от 60 до 89 мл/мин/1,73 м2. Пациент с НПВС-нефропатией прекратил прием НПВС, что на фоне терапии ГИБП привело к частичному восстановлению функции почек.
Патология почек выявлена у 7 (38,9%) пациентов (табл. 3). Перед началом терапии значимых изменений в ОАМ пациентов не отмечено. Через год от момента назначения ГИБП у одного пациента выявлены следы белка в ОАМ, у одного – микрогематурия и конкременты по данным УЗИ почек.

Перед началом терапии ГИБП 14 пациентам выполнено УЗИ почек: у 8 (57,1%) пациентов выявлены диффузные изменения почек (у одного в сочетании с конкрементом), у 1 (7,1%) – кисты, у 5 (35,8%) пациентов патологии не выявлено. В динамике через год из 9 пациентов с выявленными изменениями почек УЗИ выполнено 8 пациентам: у пациента с кистами зарегистрированы диффузные изменения, у 1 пациента выявлено увеличение размеров одной из почек и конкремент в ней; у 1 их пациентов в динамике изменений не выявлено.
Представлено два клинических наблюдения, демонстрирующих применение ГИБП пациентами с исходно имеющейся патологией почек: НПВС-нефропатией и АА-амилоидозом.
Клиническое наблюдение 1
Пациент Н. страдает АС с 16 лет, когда впервые стали беспокоить боль и скованность в поясничном отделе позвоночника и левом тазобедренном суставе. Периодически принимал НПВС, получал физиотерапевтическое, санаторно-курортное лечение с кратковременным положительным эффектом. C 42 лет отмечал прогрессирующее снижение зрения, диагностирован увеит, рецидивы которого возникали 2 раза в год. В 45 лет начал прием сульфасалазина. В связи с отсутствием эффекта через 3 месяца самостоятельно отменил препарат, после чего отметил нарастание болевого синдрома и скованность в позвоночнике. Наблюдался ревматологом амбулаторно, продолжал прием НПВС. В 46 лет выполнена лазерная иридэктомия правого глаза. Через 2 месяца начал прием сульфасалазина, преднизолона 20 мг/сут с последующим снижением до 10 мг/сут.
Улучшения состояния не отмечал, ежедневно принимал НПВСП. При обследовании в ревматологическом отделении ГУЗ «Областная клиническая больница» Саратова в апреле 2013 г. индекс BASDAI составил 5, ASDAS –2,57, СОЭ – 7 мм/ч, уровень СРБ – 28,6 мг/мл. В связи с высокой активностью заболевания, прогрессирующим ухудшением зрения, неэффективностью терапии НПВС в максимальных дозах принято решение о начале терапии инфликсимабом в дозе 5 мг/кг (400 мг). При обследовании перед введением препарата выявлено повышение уровня креатинина до 142,7 мкмоль/л, мочевины до 11,5 ммоль/л, в ОАМ лейкоциты – 3–4 в поле зрения. При УЗИ почек – диффузные изменения. Повышение уровня креатинина на фоне ежедневного приема НПВС в течение полугода в максимальных дозах с дальнейшим снижением его до нормы (115,3 мкмоль/л, мочевина 11,2 ммоль/л) расценено в рамках НПВС-нефропатии. На фоне терапии ГИБП болевой синдром в спине уменьшился. На момент второго введения ГИБП индекс BASDAI – 2,4, ASDAS – 1,7; уровень креатинина – 128 мкмоль/л, мочевины – 10,9 ммоль/л. В дальнейшем наблюдалась положительная клинико-лабораторная динамика, отменены НПВС. Через полгода терапии ГИБП диаскин-тест – 19 мм, туберкулез исключен, однако задержка введения ГИБП привела к нарастанию активности АС и рецидиву увеита. Под прикрытием специфической терапии возобновлено введение ГИБП. Через год терапии ГИБП индекс BASDAI – 3,5, ASDAS – 2,47, уровень креатинина – 100 мкмоль/л, мочевины – 5,6 ммоль/л. С учетом нерегулярности введения ГИБП в течение 6 лет неоднократно рецидивировал увеит, прогрессировал полиартрит, что требовало увеличения дозы и уменьшения интервалов введения ГИБП, периодического проведения пульс-терапии и внутрисуставного введения ГКС, добавления к терапии метотрексата с постепенной эскалацией дозы. Пациент вынужден ежедневно принимать НПВС, на фоне чего выявлялась транзиторная гиперазотемия (максимально креатинин до 182 мкмоль/л, мочевина – до 9,9 ммоль/л), купирующаяся после отмены НПВС.
Клиническое наблюдение 2
Пациент П. с 20 лет отмечает боль в позвоночнике. Диагноз АС выставлен в 24 года. Принимал НПВС ежедневно в максимальных дозах, на фоне этой терапии произошло развитие язвы 12-перстной кишки, осложнившейся кровотечением. Применял сульфасалазин, ГКС, проводились паравертебральные блокады без стойкого эффекта. В возрасте 31 год произошел перелом бедренной кости с остеосинтезом, осложненный формированием ложного сустава. Выполнено тотальное эндопротезирование сустава, повторный остеосинтез. Пациента беспокоил выраженный болевой синдром, постоянно принимал НПВС, ГКС, миорелаксанты с минимальным эффектом. В 36 лет отметил появление отеков стоп. При дуплексном исследовании вен нижних конечностей патологии не выявлено, рекомендовано ношение компрессионного трикотажа и назначены петлевые диуретики (фуросемид), на фоне чего отеки уменьшались на некоторое время. В возрасте 40 лет при амбулаторном обследовании выявлены анемия средней степени, протеинурия нефротического уровня (3,5 г/сут) при нормальном уровне креатинина (110 мкмоль/л). При биопсии слизистой оболочки щеки и подкожно-жировой клетчатки передней брюшной стенки амилоидоз не выявлен. Отменены НПВС, продолжена терапия ГКС. Через месяц уровень креатинина составил 143 мкмоль/л, выполнена нефробиопсия, морфологически – вторичный АА-амилоидоз, констатирована первая степень хронической почечной недостаточности (ХПН). Через 3 месяца – нарастание отеков, общей слабости, сохранялись боль и скованность в суставах, продолжен прием ГКС в низких дозах. Через полгода – развернутый нефротический синдром, что потребовало госпитализации, суточная протеинурия — 4,57 г, прогрессирование ХПН (креатинин – 194 мкмоль/л), СКФ – 36 мл/мин/1,73 м2. Сохранялась активность АС, индекс BASDAI – 3, ASDAS – 2,92. Начато введение инфликсимаба в дозе 300 мг, прием диуретиков. На фоне терапии отмечалось уменьшение общей слабости, отеков, боли в позвоночнике и суставах, купирование скованности. Ко второму введению индекс BASDAI составил 1,2; ASDAS – 2,51; СКФ – 50 мл/мин/1,73 м2. В течение полугода наблюдалась положительная динамика в виде значительного уменьшения болевого синдрома, утренней скованности и отеков, однако прогрессировала ХПН (креатинин – 246 мкмоль/л), сохранялась протеинурия (1,95 г/сут.),
ХБП С4 (СКФ – 27 мл/мин/1,73 м2). Проводилась коррекция дозы ГИБП, однако отмечено нарастание азотемии (креатинин – 272 мкмоль/л), суточная протеинурия – 5,64 г, что, вероятно, обусловлено прогрессированием амилоидоза.
Обсуждение
В ходе исследования у пациентов, получавших ГИБП, выявлено субклиническое снижение функции почек: уменьшилась СКФ, уровень сывороточного креатинина при этом остался нормальным. Неясно: связано это непосредственно с назначением ГИБП, длительным приемом синтетических БПВП или НПВС? Малый объем выборки и невозможность в связи с этим сформировать группы для сравнения терапии БПВП не позволяют однозначно оценить вклад ГИБП в снижение почечной функции. В литературе имеются единичные случаи описания ГИБП-индуцированной нефропатии при терапии различных аутоиммунных заболеваний [4, 5]. По некоторым данным, применение иФНО-α может быть причиной развития IgA-нефропатии [6]. Описано развитие фокального сегментарного гломерулосклероза, ассоциированного с терапией инфликсимабом, у пациентов со СпА [7].
Представленные клинические наблюдения демонстрируют трудности трактовки изменений состояния почек пациентов со СпА, болеющих в течение длительного времени и вынужденных в течение многих лет принимать различные препараты, включая НПВС.
В первом случае на фоне назначения ГИБП пациенту с НПВС-нефропатией удалось избежать постоянного приема НПВС, однако периодическое нарастание активности АС вызывало необходимость применения коротких курсов НПВС, что приводило к транзиторному нарушению функции почек. Данное наблюдение подтверждает возможность доброкачественного течения НПВС-нефропатии и восстановления почечной функции после отмены нефротоксичного препарата [8].
В последние годы ГИБП с успехом применяются пациентами с СпА, осложненных вторичным амилоидозом почек [9–12]. Имеются указания на уменьшение частоты встречаемости амилоидоза у пациентов с РА после начала применения ГИБП [3], однако нет данных о частоте встречаемости амилоидоза у пациентов с СпА после начала терапии ГИБП. Согласно исследованию P. Verschueren et al., у пациентов с АС и амилоидозом на фоне приема инфликсимаба отмечено быстрое и стойкое снижение протеинурии, увеличение СКФ, прекращение формирования амилоидных депозитов по данным сцинтиграфии с меченым I123 SAP [10]. В представленном клиническом наблюдении применение ГИБП позволило уменьшить активность АС, но не остановило прогрессирования почечной недостаточности у пациента с амилоидозом, что, вероятно, связано с поздней диагностикой амилоидоза.
Заключение
На фоне применения ГИБП пациентами с высокой активностью СпА через год отмечено некоторое снижение СКФ. Применение ГИБП почти половиной (41,2%) пациентов позволило снизить потребность в ГКС. Своевременное применение ГИБП в большинстве случаев позволяет достигать лучшего контроля активности СпА и предотвращать или уменьшать тяжесть развивающихся осложнений, однако требуется дальнейшее изучение влияния ГИБП на функцию почек.



