Первая биопсия почки выполнена датскими нефрологами P. Iversen и C. Brun в 1951 г. и с того времени считается «золотым» стандартом диагностики гломерулярных заболеваний [1]. За последние десятилетия, тем не менее, изменились и способы подготовки препаратов, и используемые окраски, и дополнительные методы исследования, которые сегодня рассматриваются как обязательный компонент биопсийного исследования. На сегодняшний день диагностика почечной патологии является комплексным процессом, включающим анализ клинических данных, светооптической картины, результатов иммунофлуоресцентного исследования, в ряде случаев и электронной микроскопии. При этом для получения адекватного заключения должны выполняться строгие требования к методике подготовки препарата, обязательным окраскам и структуре заключения, включающей описание характера изменений всех элементов почечной ткани [2–5]. Такой подход позволяет объективизировать результаты почечных биопсий, что в свою очередь делает возможным ведение единого регистра почечной патологии и сравнение его данных с регистрами других стран для оценки эпидемиологии заболеваний почек в целом. Морфологическая диагностика почечной патологии на базе Московского городского научно-практического центра нефрологии и патологии трансплантированной почки (МГНЦ) в полном объеме проводится с 2002 г., однако в данном исследовании были использованы результаты биопсий, выполненных с 2013 г., анализ которых проводился с учетом современных критериев диагностики основных заболеваний почек.
Целью настоящего исследования стал ретроспективный анализ данных Регистра почечных биопсий, выполненных с 2013 по 2020 г. в МГНЦ на базе ГКБ № 52.
Материал и методы
Патоморфологическому изучению подвергались кусочки ткани, полученные при пункционной биопсии трансплантата. Морфологическое исследование биоптатов включало световую микроскопию на срезах толщиной 3–4 мкм, окрашенных гематоксилином и эозином по Массону и Шифф-реактивом, а также иммунофлуоресцентное исследование, выполненное на замороженных срезах толщиной 4 мкм с моноклональными FITC-мечеными антителами к иммуноглобулинам-G (IgG), IgM, IgA, C3 и С1q-фрагментам комплемента и легким цепям каппа и лямбда (DAKO).
За 7 лет выполнено 8911 биопсий, включая 2149 биопсий почечных трансплантатов. Из 6763 биопсий нативных почек адекватный материал получен в 6387 случаях.
Соотношение мужчинам и женщин составило 57/43%. Распределение пациентов по полу и возрасту представлено в табл. 1 и рис. 1.
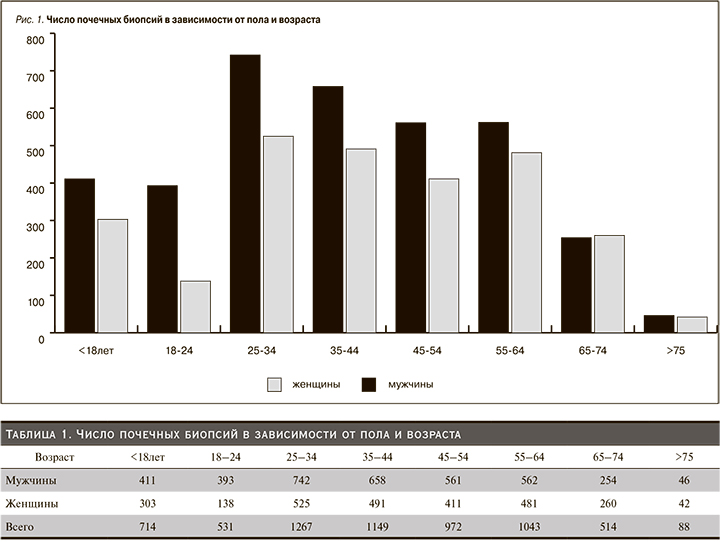
Наибольшее число биопсий выполнено пациентам среднего возраста, что отражает высокую частоту почечной патологии в этой возрастной категории. Во всех возрастных группах до 65 лет преобладали мужчины, тогда как у лиц старшего возраста частота выявления почечной патологии не зависела от пола.
Результаты
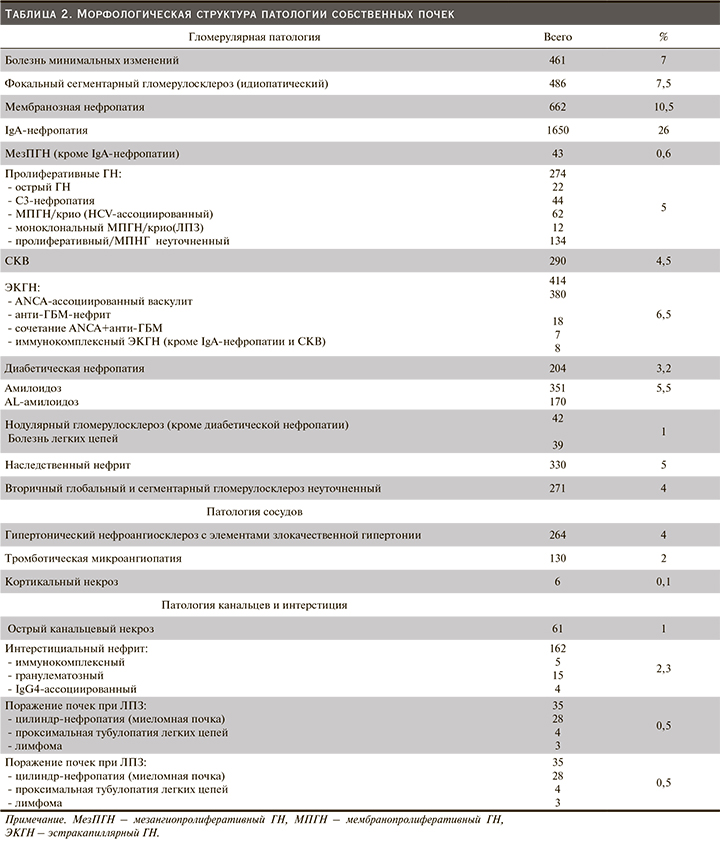
Наиболее частым показанием к биопсии почек были изолированный мочевой синдром (МС) и нефротический синдром (НС), которые послужили причиной выполнения биопсии в 33,0 и 32,5% случаев соответственно. Впервые выявленная почечная недостаточность (ПН) отмечена у 27% пациентов. Острый нефритический синдром (ОНС) является относительно редким показанием к биопсии почки (3,5%), что связано с небольшой частотой выявления данного симптомокомплекса в целом. Примерно с такой же частотой (4%) биопсия выполнялась для уточнения морфологической картины уже диагностированного заболевания, чаще всего системной красной волчанки (СКВ), ANCA-ассоциированного и геморрагического васкулита (рис. 2).
В подавляющем большинстве случаев по данным биопсии выявлялись гломерулярные заболевания (5637/88%) (табл. 2). Сосудистая патология и тубулоинтерстициальные изменения были причиной выполнения биопсии в 394 (6,2%) и 224 (3,5%) случаях соответственно. Еще у 137 (2%) пациентов заболевание почек было выявлено на поздней стадии, проявившееся распространенным нефросклерозом, верифицировать природу которого не представлялось возможным, и в 70 случаях по имеющемуся материалу патологии почек не было выявлено.
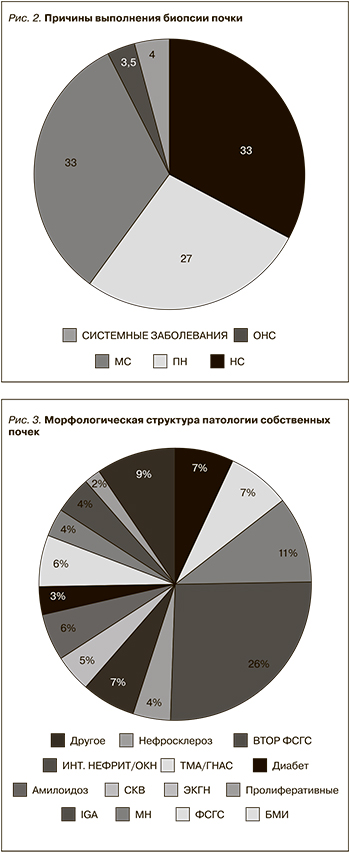 Таким образом, в структуре гломерулярной патологии первичные гломерулопатии выявлены у 51% пациентов, более половины (26%) из которых составили случаи IgA-нефропатии (рис. 3). Значительно реже отмечались мембранозная нефропатия, идиопатический ФСГС и болезнь минимальных изменений (10,5%, 7,5 и 7% соответственно). Вторичные гломерулопатии, на долю которых суммарно пришлось 31% случаев, наиболее часто отмечались при аутоиммунных заболеваниях, среди которых преобладали случаи ANCA-ассоциированного васкулита (7%) и СКВ (5%); лимфопролиферативных заболеваний – ЛПЗ (3,6%), в большинстве случаев представленных AL-амилоидозом (2,5%), а также поражение почек при сахарном диабете (3,2%) и наследственных нефропатиях (2,7%). Частота гломерулопатий, достоверно ассоциированных с инфекцией (в подавляющем большинстве случаев вирусным гепатитом С), не превышала 2% (85 случаев). В остальных случаях достоверно определить связь с каким-либо заболеванием или состоянием не представлялось возможным в силу как объективных, так и субъективных причин, таких как отсутствие проявлений либо невозможность верификации основного заболевания на момент биопсии и отсутствие полноценной информации о дальнейшем течении заболевания, а также невозможность выполнения в ряде случаев всех необходимых методов, включая электронную микроскопию.
Таким образом, в структуре гломерулярной патологии первичные гломерулопатии выявлены у 51% пациентов, более половины (26%) из которых составили случаи IgA-нефропатии (рис. 3). Значительно реже отмечались мембранозная нефропатия, идиопатический ФСГС и болезнь минимальных изменений (10,5%, 7,5 и 7% соответственно). Вторичные гломерулопатии, на долю которых суммарно пришлось 31% случаев, наиболее часто отмечались при аутоиммунных заболеваниях, среди которых преобладали случаи ANCA-ассоциированного васкулита (7%) и СКВ (5%); лимфопролиферативных заболеваний – ЛПЗ (3,6%), в большинстве случаев представленных AL-амилоидозом (2,5%), а также поражение почек при сахарном диабете (3,2%) и наследственных нефропатиях (2,7%). Частота гломерулопатий, достоверно ассоциированных с инфекцией (в подавляющем большинстве случаев вирусным гепатитом С), не превышала 2% (85 случаев). В остальных случаях достоверно определить связь с каким-либо заболеванием или состоянием не представлялось возможным в силу как объективных, так и субъективных причин, таких как отсутствие проявлений либо невозможность верификации основного заболевания на момент биопсии и отсутствие полноценной информации о дальнейшем течении заболевания, а также невозможность выполнения в ряде случаев всех необходимых методов, включая электронную микроскопию.
Обсуждение
Подходы к формированию регистра почечной патологии могут в значительной степени различаться. Тем не менее существуют общие принципы, соблюдение которых позволяет сравнивать распространенность заболеваний почек в разных странах. Так, в большинстве европейских регистров принято выделять четыре основные группы патологии, включая первичные и вторичные гломерулопатии, сосудистую патологию и тубулоинтерстициальные заболевания [6–10], а также анализировать частоту встречаемости различных ГН в зависимости от морфологического профиля [11]. Предметом специального изучения может быть структура патологии в зависимости от показаний к биопсии [12, 13], пола и возраста [6], а также динамика ее изменения с течением времени [12, 14]. При этом в отдельных странах могут использоваться и другие подходы к классификации; так, в китайском регистре в отдельную категорию наряду с первичными и вторичными гломерулопатиями выделяют врожденные и наследственные заболевания, а также гломерулосклероз неуточненной природы [14]. Данные о заболеваемости и частоте различных форм почечной патологии также во многом зависят от показаний к биопсии и, соответственно, от частоты ее выполнения [11].
При анализе собственного материала, по данным 6387 биопсий собственных почек, оказалось, что гломерулярная патология, на долю которой приходится 88% всех случаев, была представлена более чем в половине (51%) случаев первичными гломерулопатиями, наиболее частой из которых оказалась IgA-нефропатия, выявленная в 26% всех выполненных биопсий. Эти данные согласуются с представлениями о высокой распространенности этого гломерулонефрита (ГН) не только в странах Юго-Восточной Азии, где на его долю приходится 38–54% [15–17], но и в странах Европы, где IgA-нефропатия встречается с частотой до 35–37% [10, 18]. Частота выявления других ГН была значимо более низкой, составив для мембранозной нефропатии 10,5%, фокального сегментарного гломерулосклероза (ФСГС) и болезни минимальных изменений по 6% соответственно, что в целом согласуется с данными исследований. На долю вторичных ГН в нашем исследовании пришлось 31%, что также сопоставимо с данными других исследований [18].
В целом соотношение первичных и вторичных гломерулопатий зависит от структуры заболеваемости в целом. Так, высокая частота вторичных форм в регистрах стран Юго-Восточной Азии во многом определяется высокой распространенностью диабетической нефропатии в этих странах и, соответственно, высокой выявляемостью, по данным почечных биопсий составляющей 5,2–12,3 [8, 17].
Помимо этого структура почечной патологии зависит от подходов к интерпретации результатов биопсий. Так, ЭКГН, будучи достаточно распространенной патологией в ряде регистров, относится к первичным ГН, тогда как в других сообщениях его относят к вторичным формам. Еще более противоречивы подходы к оценке пролиферативных вариантов гломерулярной патологии, которые в зависимости от причины возникновения могут относиться как к первичным, так и к вторичным формам, а в части случаев определить природу ГН было возможно лишь после проведения дополнительных исследований. Так, по нашим данным, на момент биопсии природа МПГН осталась неуточненной примерно в половине всех случаев (134 из 274). Всего же на долю пролиферативных ГН, включая МПГН, суммарно приходилось лишь 4,3% всех случаев. Еще более низкой была частота выявления МезПГН, не ассоциированного с IgA-нефропатией, С3-нефропатией и СКВ. На его долю приходилось лишь 43 случая из 6387, что составило менее 1%. Данные других авторов также свидетельствуют о небольшой распространенности этих форм ГН, тем не менее находившейся в широких пределах (от 0 до 25%), тем самым отразив различия в подходах к диагностике этих заболеваний.
Амилоидоз почек выявлен у 5,5% пациентов, при этом в половине всех случаев диагностирован AL-амилоидоз как проявление ЛПЗ. Другие проявления ЛПЗ, такие как цилиндр-нефропатия (миеломная почка), болезнь отложения моноклональных иммуноглобулинов и проксимальная тубулопатия легких цепей, встречались значительно реже. Тем не менее поражения почек при ЛПЗ суммарно выявлены у 270 пациентов, что составило 4,2% от всех биопсий.
В 11% случаев гломерулярная патология была проявлением системных заболеваний, таких как СКВ (4,5%) и ANCA-ассоциированный васкулит (6,5%). Изолированная диабетическая нефропатия выявлена в 3,2% почечных биопсий, что отражает, с одной стороны, достаточно высокую настороженность врачей-нефрологов в отношении недиабетических причин поражения почек пациентов с сахарным диабетом, с другой – подтверждает полиморфность клинических проявлений диабетической нефропатии и большую распространенность атипичных ее форм.
Сосудистая патология послужила причиной биопсии для 394 (6%) пациентов и проявилась в большинстве случаев гипертоническим нефроангиосклерозом либо тромботической микроангиопатией – 264 и 130 случаев соответственно. Тем не менее данное соотношение не отражает истинной распространенности этих патологий в общей популяции, поскольку пациентам с длительным анамнезом артериальной гипертензии и характерными клиническими проявлениями гипертонического нефроангиосклероза биопсия, как правило, не выполняется, тогда как при подозрении на тромботическую микроангиопатию биопсию зачастую назначают даже в отсутствие выраженной клинической картины для верификации диагноза и уточнения характера экстраренальнальной патологии.
Обращает на себя внимание низкая частота интерстициального нефрита в структуре почечной патологии. Так, тубулоинтерстициальные заболевания отмечены лишь в 3,3% случаев, включая острое канальцевое повреждение ишемической и токсической природы, а также острый и хронический интерстициальный нефрит, включая специфические его варианты в рамках ЛПЗ и системных заболеваний.
Вероятно, в ряде случаев сосудистая патология и тубулоинтерстициальные поражения были причиной глобального и сегментарного гломерулосклероза неуточненной природы, на долю которых пришелся суммарно 271 (4%) случай. Примерно в половине из них заболевание почек выявлялось уже в стадии распространенного нефросклероза, что не позволяло достоверно верифицировать диагноз. Биопсия почки в этих случаях выполнялась скорее для исключения потенциально обратимых и подлежащих лечению причин впервые выявленной почечной недостаточности. В случаях же выявления нефросклероза дальнейшее уточнение диагноза было невозможно.
Заключение
Таким образом, наши данные о частоте встречаемости основных вариантов почечной патологии согласуются с частотой этих гломерулопатий по данным регистров других стран, однако в отношении более редких вариантов почечной патологии результаты могут в значительной степени различаться в зависимости от критериев диагноза и показаний к выполнению биопсии.



