Введение
В структуре нефрологической патологии мембранозный гломерулонефрит (мГЛН) сохраняет свою актуальность вследствие высокой заболеваемости, значительной частоты осложнений, приводящих к терминальной хронической почечной недостаточности [1–3]. Патогенетические механизмы развития мГЛН и нефротического синдрома изучались на протяжении десятилетий. Последние годы ознаменовались широким внедрением молекулярно-генетических методов исследования в нефрологию, что привело к расширению горизонтов в понимании патогенеза многих заболеваний почек и мГЛН в т.ч. [4]. Настоящее исследование служит продолжением ранее опубликованной нами работы по проблемам мГЛН [5]. Цель данной обзорной статьи состояла в проведении анализа литературных данных по вопросам эпидемиологии, этиопатогенеза мГЛН с акцентом на клинико-прогностическое значение антигенов А2-рецептора фосфолипаза (PLA2R1, M-type phospholipase A2 receptor) и тромбоспондина 1-го типа (THSD7A, Thrombospondin Type 1 Domain Containing 7A), особенно при вторичных формах этого аутоиммунного заболевания, в контексте междисциплинарного подхода. Нами был выполнен поиск в базе данных научной электронной библиотека eLIBRARY.RU (на русском языке) и PubMed (на английском). В обзор были включены 90 российских и зарубежных источников литературы.
Эпидемиология мГЛН
Распространенность вторичного мГЛН различается в зависимости от социально-экономических, географических условий и расовой принадлежности. По данным отдельных работ, первичный мГЛН у лиц моложе 20 лет встречается редко [2]. Несмотря на широкое распространение вторичного мГЛН в детской популяции, заболевание также хорошо изучено и во взрослой когорте. В 20–25% случаев вторичный мГЛН выявляется среди лиц в возрасте 30–50 лет [6, 7]. При ретроспективном исследовании, охватившем 7-летний период, В.А. Добронравов и соавт. установили морфологический диагноз мГЛН у 201 пациента, причем у 50 (24,9%) пациентов была определена вторичная этиология процесса. Распространенность всех случаев мГЛН среди всех индикационных нефробиопсий и случаев морфологически подтвержденных гломерулопатий составила 12,8 и 14% соответственно, из которых первичный мГЛН – 9,6 и 10,4% соответственно [2]. Часто мГЛН, дебютируя в зрелом и пожилом возрасте, требует исключения вторичных причин своего развития, в частности онкологического процесса [8]. По данным И.Е. Тареевой, Н.А. Мухина и Е.М. Шилова, именно при мГЛН достаточно часто (у 30–35% больных) удается установить связь с известными антигенами: вирусом гепатита В, опухолевыми и лекарственными агентами [9]. Ранее Z. Rihova et al. провели ретроспективное исследование 1874 пациентов, которым были выполнены нефробиопсия в 1991–2002 гг. При этом наличие морфологических признаков мГЛН отмечено у 129 пациентов. Как указывают исследователи, в 45% случаев мГЛН было вызвано лекарственными средствами. В 27,5 и 17,5% случаев причиной развития мГЛН послужили аутоиммунное заболевание и сόлидные опухоли [10]. В другом исследовании среди 240 пациентов с мГЛН было выявлено наличие злокачественной опухоли во время нефробиопсии, у 24 развился онкологический процесс в течение года [11]. По данным И.А. Бобылевой и соавт., примерно в 1/4–1/3 случаев мГЛН развивается вторично на фоне других заболеваний в результате отложения в клубочках иммунных комплексов, содержащих экзогенные антигены и антитела к ним [12]. Важно отметить, что результаты разных почечных регистров могут в значительной степени различаться в зависимости от критериев диагноза и показаний к выполнению нефробиопсии. Е.С. Столяревич, Т.Р. Жилинская и В.В. Варясин провели ретроспективный анализ данных регистра 6387 нефробиопсий за 7 лет (с 2013 по 2020 г.) в МГНЦ на базе ГКБ № 52. Было установлено, что наиболее частым (32,5% случаев) показанием к нефробиопсии был именно нефротический синдром. В структуре клубочковой патологии первичные гломерулопатии выявлены у 51% пациентов, доля мГЛН составила 10,5% [3]. По другим данным, среди проанализированных результатов 1955 нефробиопсий частота первичных гломерулопатий составила 72,3%. Как отмечают исследователи, в структуре первичных гломерулопатий преобладали фокально-сегментарный гломерулосклероз и мГЛН [13]. T. Stehlé et al. опубликовали результаты многоцентрового исследования гломерулопатий, ассоциированных с саркоидозом. Так, среди 26 пациентов с саркоидозом и морфологически верифицированным гломерулярным повреждением наиболее часто регистрировалcя мГЛН, составив 42% случаев. В этом наблюдении [14] мГЛН характеризовался гранулярными субэпителиальными отложениями иммуноглобулинов и комплемента вдоль базальной мембраны при иммунофлуоресцентном исследовании (рис. 1). В препарате эпителиоидная и гигантоклеточная гранулема, примыкающая к неизмененным клубочкам. Иммунофлуоресцентный анализ выявил субэпителиальные гранулярные отложения иммуноглобулина G (IgG), по данным T. Stehlé et al. (2014).
 Примечательно, что в данном наблюдении ремиссия гломерулярного заболевания и саркоидоза после специфической терапии (стероидной и/или иммуносупрессивной) зарегистрирована практически у всех пациентов. Как указывают исследователи, гистопатологический спектр гломерулопатий, наблюдаемых при саркоидозе, разнообразен и лишь в 35% случаев оба заболевания развиваются одновременно [14]. В исследовании A.R. Berliner et al. отмечено, что частота поражения почек у пациентов с саркоидозом варьируется от 10 до 20% [15].
Примечательно, что в данном наблюдении ремиссия гломерулярного заболевания и саркоидоза после специфической терапии (стероидной и/или иммуносупрессивной) зарегистрирована практически у всех пациентов. Как указывают исследователи, гистопатологический спектр гломерулопатий, наблюдаемых при саркоидозе, разнообразен и лишь в 35% случаев оба заболевания развиваются одновременно [14]. В исследовании A.R. Berliner et al. отмечено, что частота поражения почек у пациентов с саркоидозом варьируется от 10 до 20% [15].
Рассматривая вопросы эпидемиологии вторичного мГЛН, следует отметить роль лекарственных препаратов. Наиболее частое развитие мГЛН ассоциируется с приемом солей золота, Д-пеницилламина [16]. Так, в одном из наблюдений 17,3% пациентов с ревматоидным артритом имели мГЛН, достоверно коррелировавший с приемом солей золота и пеницилламина [17]. В другом исследовании мГЛН обнаружен у 31% пациентов, большинство из которых получали лечение солями золота и Д-пеницилламином [18]. Кроме того, имеются свидетельства того факта, что мГЛН часто развивается у лиц, получавших бутиламин, Д-пеницилламин и соли золота [19].
Причины и механизмы развития мГЛН
По данным многочисленных исследований, мГЛН развивается в результате повреждения базальной мембраны клубочков и характеризуется субэпителиальным и интрамембранозным отложением иммунных комплексов, а также накоплением матриксного материала, продуцируемого пораженными подоцитами [20, 21]. Морфологическая картина мГЛН характеризуется отсутствием клеточной пролиферации, хотя в некоторых случаях отмечается пролиферация мезангиоцитов крайне слабой степени. Отсутствие воспалительной реакции на иммунные комплексы объясняется наследственным или приобретенным дефицитом Fc-рецепторов мезангиоцитов, выступающих в роли макрофагов [20, 21]. Здесь следует подчеркнуть, что в настоящее время различают три популяции мезангиоцитов (межсосудистые клетки): гладкомышечная, макрофагическая и транзиторная (моноциты из кровотока). Мезангиоциты макрофагического типа также несут на своей поверхности компоненты главного комплекса гистосовместимости 2-го типа, необходимые для фагоцитарной функции, плюс La-антиген. Этим объясняются процессы реализации в клубочках иммуновоспалительной реакции и появление протеинурии.
По данным различных авторов, мГЛН чаще заболевают лица мужского пола, причем заболевание у них протекает тяжелее [1, 9, 12]. Традиционно мГЛН подразделяется на первичные (идиопатические) и вторичные формы. Как правило, причиной развития вторичного мГЛН служат аутоиммунные заболевания, злокачественные новообразования [22], системная красная волчанка [23], ревматоидный артрит [24, 25], инфекционные заболевания, вызываемые вирусом гепатита В и С, вирус иммунодефицита человека (ВИЧ) [26], лекарственные препараты, тиреоидит, саркоидоз и др. (см. таблицу). В международных клинических рекомендациях подчеркнуто, что вторичный мГЛН служит результатом специфического поражения клубочков иммунными комплексами, в которые включены экзогенные антигены [6, 27].

При вторичных формах мГЛН устранение и/или лечение причины могут способствовать быстрой ремиссии болезни. В настоящее время мГЛН рассматривается как хроническое заболевание различной природы, для которого характерны спонтанные ремиссии (25%) и рецидивы (75%). В клинических рекомендациях развитие ремиссии может быть отсроченным на длительный период времени – до 18–24 месяцев [27]. Примерно 15–30% пациентов с мГЛН переживают один или более рецидивов. Вероятность наступления спонтанных ремиссий и прогрессирования мГЛН зависит от возраста, пола, степени протеинурии и функции почек в момент верификации диагноза [6, 27].
Подоциты и их роль в возникновении мГЛН
Подоциты – это высокоспециализированные клетки клубочков, участвующие в регуляции проницаемости гломерулярного фильтра и поддерживающие форму капилляров, препятствуя их расширению под действием гидравлического давления. Клубочек почки также является узкоспециализированной структурой, обеспечивающей селективную ультрафильтрацию плазмы таким образом, что необходимые белки сохраняются в крови [28]. Суммарная поверхность капилляров клубочков составляет 1,5 м2.
Как показывают исследования, подоциты (эпителиальные клетки, эпителий клубочков) состоят из трех частей: тело клетки, первичные, вторичные и третичные отростки (ножки), с помощью которых они прикрепляются к базальной мембране (рис. 2). В обзорном исследовании Е.Н. Шамитовой и В.О. Романова изложены биологические и патофизиологические аспекты подоцитарной дисфункции [29]. Подоциты (рис. 2, 3b) покрывают капилляры клубочков почек, в которых фильтруется первичная моча. Отфильтрованная моча проходит через проксимальный каналец (рис. 2В). В ранее опубликованной серии обзорных статей подробно изложены структурные и функциональные изменения подоцитов при мГЛН [30, 31]. Как уже упоминалось, подоциты поддерживают архитектонику клубочка, препятствуя прохождению белка в мочевое пространство, а также синтезируют компоненты базальной мембраны клубочков, особенно в постнатальном периоде. Кроме того, подоциты регулируют кровоток в капиллярах клубочков и ингибируют пролиферацию мезангиоцитов путем синтеза ангиотензина (АТ), гистамина, вазопрессина. Третичные отростки (ножки) подоцитов покрывают капилляры, оставляя фильтрационные щели шириной около 40 нм.
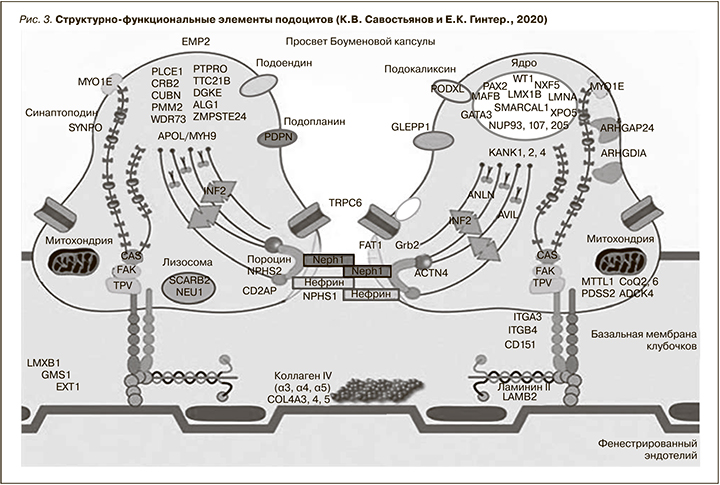
В них в виде мостика располагается барьер фильтрации тонкая мембрана–щелевая диафрагма [32]. Щелевая диафрагма – это сеточка переплетающихся тончайших нитей из белка нефрина (ширина ячеек – от 4 до 7 нм), представляющая собой барьер для большинства альбуминов и других крупномолекулярных веществ. Щелевая диафрагма содержит структурные белки, тесно связанные с актиновым цитоскелетом посредством внутриклеточно расположенных адаптеров CD2AP (CD2 Associated Protein), ZO-1 (zonula occludens-1), Nck (non-catalytic region of tyrosine kinase) и p130Cas (Crk-associated substrate) [32, 33]. Сигнальные пути от этих молекул щелевой диафрагмы через адаптеры регулируют структуру, механизмы выживания и процессы дифференцировки подоцитов, а также клеточную адгезию. Безусловно, при мГЛН поражение подоцитов сопровождается нарушением щелевой диафрагмы и проявляется слияниям и/или исчезновением малых ножек [34, 35]. Установлено, что CD2AP принимает участие в распознавании области контакта между Т-лимфоцитами и антигенами. В Т-лимфоцитах CD2AP стабилизирует взаимодействие с антигеном, находящимся в клетке, путем усиления кластеризации CD2 и формирования в области сайта взаимодействия цитоскелета, необходимого для поляризации Т-лимфоцитов [36]. Нужно сказать, что CD2AP регулирует цитоскелет подоцитов и стабилизирует фильтрационные щели. По имеющиеся сведениям, повреждение гена CD2AP переключает TGF-β (Transforming Growth Factor Beta) на патологический сигнальный путь, что приводит к активации проапоптозной р38 МАР-киназы (Mitogen Activated Protein kinase) и утрате подоцитов [37, 38]. Также МАР-киназы опосредованно влияют на реализацию программы апоптоза подоцитов, участвуя в регуляции продукции ряда провоспалительных цитокинов [39]. Вероятно, именно по этой причине при вторичном мГЛН развивается феномен подоцитопатии.
В последние годы в литературе обсуждается роль сфинголипидов при гломерулярных болезнях [40]. Как отмечают исследователи, сфинголипиды как компонент липидного слоя плазматической мембраны необходимы для полноценного функционирования подоцитов и являются ключевым элементом барьера клубочковой фильтрации [41]. В частности, накопление сфинголипидов наблюдается при гломерулярных заболеваниях негенетического происхождения. В подоцитах экспрессируется кислотоподобный сфингомиелин фосфодиэстеразы (SMPDL3b, Sphingomyelin phosphodiesterase acid-like 3b), где он модулирует активность кислой сфингомиелиназы и выступает в качестве главного модулятора сигнализирования опасности [41]. Снижение экспрессии SMPDL3b коррелирует с рецидивом протеинурии.
В рамках оптимизации молекулярной диагностики редких наследственных болезней (К.В. Савостьянов, Е.К. Гинтер, 2020) детально изучены молекулярно-генетические аспекты мутации белков щелевой диафрагмы [42]. Как показано на рис. 3, синаптоподин, подопланин, подоцин, подокаликсин и нефрин преимущественно локализуются на поверхности подоцитарных клеток [43].
Подоциты имеют на своей поверхности различные рецепторы к биологическим веществам, а мембрана состоит из толстого слоя отрицательно заряженного гликокаликса. Отрицательный заряд и гидрофильность базальной мембраны клубочков определяются наличием полианионов, таких как гепарансульфат, ламинин, хондроитинсульфат, нидоген и сиаловая кислота. Появление протеинурии связано с уменьшением содержания указанных полианионов. В последние годы появилось следующее сообщение: слияние цитоподий подоцитов с оголениной базальной мембраной клубочков не всегда коррелирует со степенью выраженности протеинурии [44, 45]. В.Г. Сиповский и соавт. изучили возможную взаимосвязь ультраструктурных изменений подоцитов и степени оголения базальной мембраны клубочков при непролиферативной гломерулопатии с клинико-лабораторными показателями состояния гломерулярного фильтра. Среди 37 участников исследования у 17 (45,9%) были выявлены признаки мГЛН. Количественный ультраструктурный стереологический анализ выполнен посредством оценки ширины цитоподий, а также степени оголения базальной мембраны клубочков. Установлено, что при мГЛН абсолютное значение ширины цитоподий было больше, чем при фокально-сегментарном гломерулосклерозе и болезни минимальных изменений [44]. Как уже сказано, ламинин, входящий в состав базальной мембраны клубочков, обеспечивает прикрепление к мембране ножек подоцитов и эндотелиоцитов капилляров. Кроме того, ламинин обеспечивает стабильность базальной мембраны клубочков, а также оказывает влияние на рост и дифференциацию клеток. При мГЛН выявлялось свечение в клубочковой мембране β1-цепи ламинина, которая в норме выявляется у человека только на стадии эмбрионального развития [46]. Авторы указывают, что это обстоятельство связано с экспрессией генов и определяет изменения свойств мембран при мГЛН. Связи и функциональные взаимодействия ламинина в структуре базальной мембраны клубочков были представлены в обзорном исследовании М.М. Батюшина и соавт. [47]. Есть сведения об аутоиммунном характере развития мГЛН. При этом гликопротеины подоцита или β2-ламинин базальной мембраны могут служить антигенами, на которые формируются аутоантитела [48]. Антигеном в этом случае служит поверхностный гликопротеин массой 330 кДa, который в высокой концентрации экспрессируется на эпителии проксимальных канальцев и в меньшей степени на подоцитах. Антитела проходят сквозь базальную мембрану клубочков и, связываясь с данным гликопротеином, образуют иммунные комплексы (субэпителиально) [49]. Следует отметить, что на поверхности подоцитов и их ножек имеется отрицательно заряженный слой гликокаликса, «усиливающий» отрицательный заряд базальной мембраны клубочков. Согласно литературным данным, известно более 30 белков, имеющих отношение к функционированию щелевой мембраны подоцитов [50]. В исследовании итальянских ученых детально изложены и обобщены этиопатогенетические механизмы вторичного мГЛН [51]. Так, поражение подоцитов также приводит к активации локальной ренин-ангиотензин-альдостероновой системы (РААС) и увеличивает выделение АТ-II, который возбуждает рецепторы к АТ-I и запускает сигнальные каскады, в конечном итоге ведущие к эпителиально-мезенхимальной трансдифференциации, апоптозу подоцитов и профибротическому перерождению мезангиальных клеток [52]. АТ-II изменяет сборку белка щелевой диафрагмы подоцитов, таким образом регулируя объем клубочковой фильтрации. В мезангиальных клетках клубочков АТ-II запускает сигнальные пути, вызывающие избыточную аккумуляцию мезангиального матрикса. Вместе с тем высокие концентрации АТ-II активирют сигнальные пути, ведущие к апоптозу и потере подоцитов в структуре гломерулярного фильтра [53]. Кроме того, подоциты экспрессируют минералокортикоидные рецепторы, необходимые для связи еще с одним компонентом РААС – альдостероном. АТ-II стимулирует синтез провоспалительных медиаторов, включая адгезивные молекулы и хемокины, которые могут модулировать некоторые ответы иммунных и воспалительных клеток, в частности хемотаксис, пролиферацию и дифференциацию моноцитов в макрофаги [54]. Отложения иммунных комплексов в клубочках запускают активацию системы комплемента и гиперпродукцию ряда белков базальной мембраны, включая коллаген IV типа и ламинин. В настоящее время нефротический синдром рассматривается как подоцитопатия, а снижение числа подоцитов приводит к патологии клубочков [55, 56]. Как уже упоминалось, при мГЛН отмечается снижение числа и сглаживание ножек подоцитов, последнее считается наиболее ранним признаком повреждения подоцитов. Потере подоцитов способствует также активация механизмов эпителиально-мезенхимальной трансдифференциации. Молекулярно-клеточные аспекты подоцитарного повреждение детально изложены в публикации И.Н. Бобковой и соавт. [30, 31].
Клинико-прогностическое значение PLA2R и THSD7A при мГЛН
Рассматривая проблему мГЛН, следует отметить роль PLA2R как трансмембранного гликопротеина, экспрессируемого на подоцитах. По современным данным, мГЛН протекает с образованием иммунных комплексов in situ, в состав которых входят главным образом антитела класса IgG4 к PLA2R [2, 57, 58]. Формирующиеся при этом иммунные комплексы откладываются под базальной мембраной субэпителиально и запускают активацию комплемента, а также гиперпродукцию некоторых белков базальной мембраны, включая коллаген IV типа и ламинин. Эти изменения приводят к перестройке базальной мембраны и нарушению ее функций [59], что сопровождается появлением протеинурии. Нужно отметить, что при первичном мГЛН часто обнаруживается антитела к PLA2R как в системном кровотоке, так и в составе иммунных комплексов у большинства взрослых пациентов [60]. Как отмечено в клинических рекомендациях, у 70–80% пациентов с мГЛН выявляются антитела к PLA2R, преимущественно иммуноглобулина класса G4 [6, 27]. Тогда как у 20–30% пациентов с первичным мГЛН внутренние антигены клубочков и аутоантитела к ним не идентифицированы. Наличие циркулирующих антител к PLA2R тесно связано с выраженностью клинических проявлений заболевания [59, 61]. При первичном мГЛН обнаружено снижение и/или исчезновение титра антител против PLA2R в сыворотке крови, а рецидив болезни ассоциируется с появлением/нарастанием уровня этих антител в системном кровотоке [1]. У пациентов с положительными антителами отслеживание уровня анти-PLA2R в динамике позволяет прогнозировать риск прогрессирования заболевания и вероятность ремиссии. Есть основания полагать, что у пациентов с мГЛН при наличии анти-PLA2R в крови может отмечаться резистентность к проводимой терапии [62]. Как упоминалось выше, циркулирующие в сыворотке крови анти-PLA2R-антитела часто выявляются у пациентов с первичным мГЛН [6, 27]. Ранее считалось, что у пациентов с вторичным мГЛН анти-PLA2R-антитела не обнаруживаются. Это позволило предложить использование определения этих антител в сыворотке для дифференциальной диагностики первичной и вторичной форм мГЛН. Однако имеются свидетельства о наличии анти-PLA2R-антител в крови при мГЛН у лиц с ВИЧ-инфекцией и вирусами гепатита В и С [63]. К тому же у пациентов с мГЛН, ассоциированной с инфекционными заболеваниями и наличием анти-PLA2R-антител, величина протеинурии и соотношение белок/креатинин в моче были достоверно выше [63]. Отдельно следует отметить результаты исследования W. Qin et al., где у 3 из 10 пациентов с мГЛН, связанного с сόлидной опухолью, выявлялось наличие анти-PLA2R1-антител [64].
Морфологические проявления, свойственные мГЛН, можно заметить с помощью электронной микроскопии, и касаются они субэпителиальных, субэндотелиальных и интрамембранозных отложений депозитов иммунных комплексов (рис. 4). В ранее опубликованном исследовании был описан случай саркоидоза и мГЛН, ассоциированного с наличием анти-PLA2R, в связи с чем было высказано предположение о возможности общего патофизиологического процесса при первичном и вторичном мГЛН [65]. Хотя циркулирующие иммунные комплексы и гипергаммаглобулинемия являются обычной находкой у пациентов с саркоидозом [66].

Недавнее когортное ретроспективное исследования показало, что PLA2R, домен тромбоспондина 1-го типа, содержащий 7А (THSD7A), экзостозин-1 и -2 (EXT 1/EXT 2) и протеинкиназный C-связывающий белок (NELL-1), были идентифицированы как потенциальные антигены подоцитов при мГЛН [67]. Как сообщают авторы, среди 177 лиц с мГЛН диагноз PLA2R-положительный (PLA2R+), THSD7A+ и отрицательный (PLA2R-/THSD7A-) случай заболевания был установлен у 117 (66,1%), 6 (3,4%) и 54 (30,5%) пациентов соответственно.
В указанных подгруппах темпы развития почечной недостаточности были одинаковыми. Заслуживает внимания тот факт, что лица с мГЛН и наличием THSD7A+ имели более высокую частоту наличия (50%) или повышенный риск развития онкологической патологии во время наблюдения (отношение рисков=5,0; 95% доверительный интервал – 1,4–17,9; р=0,01). В указанном исследовании большинство пациентов с мГЛН и имеющих экзостозин-1 и -2 были женского пола. Вместе с тем у них выявлялись отложения C1q в клубочках [67]. Рецепторы экзостозин-1 и -2, а также протеинкиназный C-связывающий белок при мГЛН встречаются не так часто. В ряде исследований подчеркнута роль антител против NELL-1 и EXT1/EXT2 при мГЛН [68]. Сведения о внутриклеточных механизмах с участием NELL-1, лежащих в основе структурной перестройки подоцитов, пока достаточно ограничены. Многими исследователями признается, что мГЛН как наиболее частое заболевание клубочков связано со злокачественными новообразованиями [69], особенно у лиц старших возрастных групп. Ранее сообщалось, что рецептор PLA2R является аутоантигеном, участвующим в развитии первичного мГЛН, тогда как THSD7A может иметь тесную связь с мГЛН, связанного со злокачественными ново-образованиями [69]. У лиц с вторичным мГЛН, ассоциированным со злокачественными новообразованиями, частота выявления антител к PLA2R достигает 30%. Злокачественные новообразования могут служить причиной развития мГЛН в 20% случаев у пациентов пожилого возраста, у людей молодого и среднего возраста – в 4%. К настоящему времени установлено, что старший возраст, гипертриглицеридемия и протеинурия служат независимым фактором ускорения тубулоинтерстициального фиброза при мГЛН [70].
Мета-анализ, выполненный S.J. Rao et al., был направлен на изучение взаимосвязи между анти-PLA2R и клиническими характеристиками, а также неблагоприятными исходами первичного мГЛН. Мета-анализ охватил 20 исследований с участием 2224 пациентов с первичным мГЛН. Установлено, что имеется тесная корреляция между уровнем сывороточного анти-PLA2R и возрастом, концентрацией общего холестерина и альбумина крови [71]. Очевидно, что повышенные уровни сывороточного анти-PLA2R при мГЛН свидетельствуют об активности патологического процесса в почках. В указанном мета-анализе также продемонстрирована обратная связь между содержанием анти-PLA2R в сыворотке крови и величиной расчетной скорости клубочковой фильтрации [71]. Следует отметить, что показатель анти-PLA2R исследуется не только в системном кровотоке, но и локально в ткани почек. Так, в одноцентровом исследовании были изучены отложения PLA2R и THSD7A в клубочках и их циркулирующие антитела при мГЛН [69]. В этом исследовании 12 пациентов с мГЛН и наличием злокачественных новообразований и 257 пациентов с идиопатическим мГЛН были без злокачественного новообразования. Оценка экспрессии PLA2R, THSD7A и IgG4 в клубочках анализировалась с помощью иммуногистохимического метода. Циркулирующие антитела против PLA2R и THSD7A исследовались с помощью иммуноферментного анализа и непрямого иммунофлуоресцентного тестирования соответственно. Важно отметить, что в этом исследовании лица с мГЛН и онкологическими заболеваниями были значительно старше, имели более высокий уровень креатинина в сыворотке крови и более низкую расчетную скорость клубочковой фильтрации, чем пациенты с идиопатическим мГЛН (р<0,05). Авторы установили, что отложения PLA2R и IgG4 в клубочках и уровень циркулирующих антител против PLA2R у лиц с злокачественными новообразованиями и мГЛН были значительно ниже, чем у пациентов с идиопатическим мГЛН (р<0,01) [69]. При изучении клинического и прогностического значения PLA2R и THSD7A у больных мГЛН обнаружено присутствие анти-THSD7A-антител, связанное с повышенным риском малигнизации [72, 73]. В недавно проведенном исследовании оценивалась экспрессия THSD7A у 101 пациента со злокачественными новообразованиями (колоректальный рак у 81 и у 20 – рак груди). Было показано, что положительные уровни экспрессии THSD7A в двух типах опухолевых тканей были очень высокими: 97,5% при колоректальном раке и 100% при раке груди. Стоит отметить, что в данном исследовании у 11 (10,9%) пациентов до операции была протеинурия, у троих больных исчезнувшая после оперативных вмешательств [74]. В обзорной статье С.А. Кузнецовой, А.В. Крылова и Е.П. Киселевой отмечено, что тромбоспондин-1 является гликопротеином, состоящим из множества структурных доменов, которые взаимодействуют с широким спектром рецепторов на поверхности клеток или другими лигандами, что в свою очередь определяет многофункциональность этой молекулы. В частности, тромбоспондин-1 участвует в регуляции адгезии, миграции, пролиферации и выживаемости различных типов клеток [75]. Многие клетки организма секретируют тромбоспондин-1, и его экспрессия значительно выражена в местах тканевого повреждения и восстановления (репарации). Не менее важно отметить, что секреция тромбоспондина-1 индуцируется провоспалительными цитокинами и опухолевыми антигенами. Кроме того, высокие уровни тромбоспондина-1 усиливают экспрессию VCAM-1 (Vascular cell adhesion molecule 1) и ICAM-1 (Intercellular Adhesion Molecule 1), что в свою очередь приводит к усилению адгезии моноцитов к эндотелиальным клеткам [76]. Оказывая влияние на подоциты, повышенные уровни тромбоспондина-1 стимулируют синтез АТ-II, тем самым поддерживают воспаление в клубочках. Двунаправленная связь между уровнем тромбоспондина-1 и продукцией АТ-II при мГЛН продолжает изучаться. В ряде случаев у пациентов с мГЛН обнаруживаются антиподоцитарные антитела типа C5b-9 (мембраноатакующего комплекса) и их субэпителиальная депозиция. При взаимодействии иммунных комплексов активируется ряд ферментативных систем подоцитов, что приводит к их повреждению. Этим объясняется участие подоцитов в развитии и прогрессировании иммуновоспалительных процессов. Медиаторы повреждения подоцитов при мГЛН существенно не отличаются от нефропатии другой этиологии. Так, повышенный синтез ангиопоэтинподобного белка-4 (ANGPTL4, angiopoietin-related protein 4) подоцитарными клетками сопровождается возникновением протеинурии в результате изменения ножек подоцитов [77]. В дальнейшем тяжесть подоцитарной дисфункции определяется степенью секреции трансформирующего фактора роста-β1, который стимулирует синтез подоцитами коллагена IV типа, способствуя утолщению базальной мембраны клубочков и развитию гломерулосклероза. Кроме того, трансформирующий фактор роста-β1 стимулирует экспрессию в подоцитах эндотелиального фактора роста сосудов [78]. В ранее проведенных исследованиях установлено, что эндотелиальный фактор роста сосудов подавляет образование нефрина в подоцитах, таким образом способствуя нарушению функции ножковых отростков [79]. Наоборот, снижение уровня эндотелиального фактора роста сосудов ослабляет выживаемость подоцитов, ускоряя развитие подоцитопении. Безусловно, что повышенный синтез эндотелиального фактора роста сосудов подоцитами сопровождается протеинурией, с одной стороны, и изменением архитектоники базальной мембраны клубочков, с другой.
Как указано в публикации В.А. Добронравова и соавт., основой формирования иммунных комплексов при мГЛН является образование антител класса IgG к внутренним антигенам клубочка [80]. Иммунные комплексы содержат фракции комплемента С3, С5, С6, С7, С8 и С9. Образовавшиеся антитела проникают через клубочковый барьер, связываются с антигеном – мембранным белком подоцитов мегалином [81, 82]. В результате образуются антитела к мегалину, связываются с ним, активируется система комплемента и формируются субэпителиальные иммунные комплексы in situ. Это приводит к иммунному повреждению подоцитов с расплавлением ножек подоцитов, разрушением щелевых диафрагм и протеинурии. При отложении у больных мГЛН IgG-1 и -2 заболевание ассоциируется со злокачественными новообразованиями. В таких случаях необходимо провести онкологический поиск, особенно у лиц, которые за последнее время похудели, при необъяснимой анемии или обнаружении крови в стуле, особенно у пациентов старшего возраста. Онкологический поиск бессимптомного рака преследует цели возрастного скрининга (колоноскопия для лиц старше 50 лет, маммография для женщин старше 40 лет, определение простатического специфического антигена для мужчин более 50 лет или более 40 лет, для представителей негроидной расы, рентгенологическое исследование и по возможности компьютерная томография грудной клетки для пациентов с факторами риска рака легких) [6, 27].
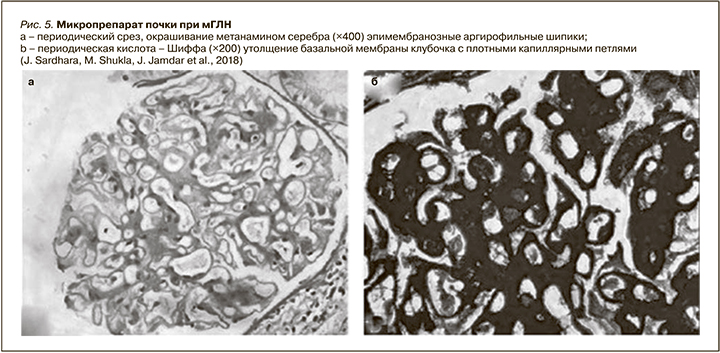
Как отмечено выше, при вторичных формах мГЛН лечение основной патологии может способствовать быстрой ремиссии болезни. Не так давно J. Sardhara et al. описали случай возникновения нефротического синдрома у 60-летней женщины, страдавшей менингиомой, когда после удаления опухоли была отмечена ремиссия нефротического синдрома, что подтверждает этиологическую роль опухоли [83]. В этом исследовании нефробиопсия продемонстрировала картину, характерную для мГЛН: утолщение базальной мембраны клубочков и эпимембранозные аргирофильные шипики (рис. 5). Некоторые гистологические характеристики, полученные с помощью иммунофлуоресценции и электронной микроскопии при мГЛН, могут помочь отдифференциировать первичные и вторичные формы заболевания. Суть иммунофлуоресцентного метода – это выявление антигенов за счет специфических антител, образующих с ними связи, имеющие флуоресцентные маркеры.
Присутствие подтипов IgG1 и G2 более выражено в почках пациентов с вторичным мГЛН, чем у пациентов с первичным мГЛН. При мГЛН, вызванном злокачественными новообразованиями, гиперпродукция провоспалительных цитокинов связана с опухолевыми антигенами. В международных рекомендациях [27] указывается, что обнаружение мезангиальных депозитов при электронной микроскопии, а также распространенных депозитов IgG1, G2, и/или G3 при иммунофлуоресценции свидетельствует о существовании вторичной формы мГЛН. При первичном контакте иммунокомпетентных клеток с вирусами, простейшими и другими возбудителями различных заболеваний, а также чужеродными антигенами происходит инициация синтеза специфических иммуноглобулинов класса М. Далее под влиянием Т-лимфоцитов и цитокинов В-лимфоциты переключаются на синтез иммуноглобулинов класса G, которые являются основным фактором гуморального звена иммунной защиты. Как указано в исследовании В.И. Офицерова, к наиболее важным эффекторным механизмам действия IgG относятся активация системы комплемента, а также связывание с нейтрофилами, макрофагами, мононуклеарными фагоцитами и другими специализированными клетками иммунной системы, осуществляющими после такого взаимодействия фагоцитоз чужеродных агентов или уничтожение зараженных клеток организма за счет зависимой от антител цитотоксичности [84]. В сыворотке крови человека относительная концентрация подклассов IgG снижается в следующем ряду: IgG1 (70%)>IgG2 (20%)>IgG3 (6%)>IgG4 (4%). Нужно подчеркнуть, что при первичной форме мГЛН среди иммунных депозитов доминируют субклассы IgG4 [85]. Антитела активируют комплемент по классическому пути, который начинается с взаимодействия первого компонента каскада реакций С1q с комплексом антиген–антитело, а конкретно – с СН2-доменом Fc-фрагмента молекулы IgG.
S. Baslo et al. описали случай ассоциации хронической воспалительной демиелинизирующей полирадикулоневропатии с мГЛН у 68-летнего мужчины, страдавшего артериальной гипертензией, гиперлипидемией и хронической обструктивной болезнью легких [86]. По поводу лечения неврологических расстройств (метилпреднизолон в виде пульс-терапии и таблетированные формы) у пациента развились протеинурия и отеки на конечностях. Антитела к PLA2R в сыворотке крови не были обнаружены. Нефробиопсия показала картину первой стадии мГЛН с отложениями IgG [86]. В другом исследовании у 73-летнего мужчины с тромбоцитопенией, гемолитической анемией, церебральными нарушениями и острым повреждением почек по результатам нефробиопсии подтвердился мГЛН [87]. Кроме того, обнаружено наличие антител против PLA2R. Лечение глюкокортикоидами и сеансами плазмафереза тромбоцитопенической пурпуры привело к ремиссии мГЛН. Нужно сказать, в этом наблюдении снижение активности мГЛН предшествовало исчезновению антител к PLA2R. Хотя связь хронической воспалительной демиелинизирующей полирадикулоневропатии и мГЛН впервые была описана A.S. Witte и J.F. Burke в 1987 г. [88].
Рассматривая роль лекарственных препаратов в развитии вторичного мГЛН, отметим случай его развития на фоне приема Д-пеницилламина 24-летней девушкой [89]. Анализ данных нефробиопсии показал изменение структуры базальной мембраны клубочков и наличие при иммунофлуоресцентном исследовании трех клубочков с IgG3+ и C3 c 2+ в стенках капилляров.
В данном наблюдении в сыворотке крови и при иммунофлуо-ресцентном исследовании анти-PLA2R не были обнаружены [89]. По литературным данным, вторичный мГЛН, вызванный Д-пеницилламином, возникает в любом возрасте и обычно развивается в течение 6–12 месяцев либо в 3–4 год от начала терапии [90].
Заключение
Таким образом, этиопатогенетические механизмы мГЛН до конца не изучены, низкая частота вторичного мГЛН обусловлена гиподиагностикой и недостаточным внедрением нефробиопсии. Наиболее изученными биомаркерами мГЛН являются анти-PLA2R и THSD7A. Вторичный мГЛН, возникающий у лиц старших возрастных групп, наиболее часто встречается в практической работе терапевта, однако сложная палитра этиологии этого заболевания требует полидисциплинарного подхода к предупреждению потери почечной функции в будущем.



