Введение
Концепция адекватности гемодиализа (ГД) подразумевает удаление уремических токсинов, излишней жидкости и поддержание удовлетворительного нутриционного статуса пациента [1]. Достижение адекватного ГД рядом пациентов позволяет достигать удовлетворительной их реабилитации и обеспечения должного качества жизни путем ликвидации основных симптомов болезни. Именно эти задачи напрямую решаются в зависимости от заданных параметров лечения, которые можно отслеживать и корректировать. При неадекватном диализе гораздо чаще происходит развитие уремических осложнений, таких как полиневропатия, неконтролируемая нефрогенная анемия, амилоидоз внутренних органов, синдром карпального канала, вторичный гиперпаратиреоз [2]. Развитие осложнений нередко бывает обусловлено затруднениями оценки адекватности дозы диализа традиционным методом, при котором часто возникают систематические ошибки. Помимо метода определения Kt/V по формуле Даугирдаса на основании проб крови до и после диализа существуют on-line-методы, основанные на ультрафиолетовой спектрофотометрии, которые позволяют измерять Kt/V в ходе каждой процедуры [3]. Этот способ измерения Kt/V имеет ряд принципиальных отличий от лабораторного метода. Одной из его важнейших черт является то, что процесс расчета индекса происходит на протяжении всей процедуры непрерывно. При этом методе блок Adimea имеет прямой контакт с пациентом, измеряя концентрацию мочевины в диализате, что делает его результаты наиболее достоверными при on-line-мониторировании дозы диализа. Также преимуществом метода является возможность точно отвечать на изменения в программе непосредственно во время процедуры ГД. Доказано, что измерения, основанные на поглощении ультрафиолетового излучения, могут использоваться для определения дозы диализа, т.к. существует достоверная линейная корреляция между величиной поглощенного света и концентрацией уровня мочевины крови [4]. К достоинствам системы также относятся простота и дешевизна ее применения: для измерения Kt/V во время диализа не нужны какие-либо расходные материалы и дополнительные анализы. Нет необходимости вручную определять объем распределения мочевины (расчет происходит автоматически с помощью интегрированного программного обеспечения). Все, что требуется, − это ввод параметра массы тела пациента перед процедурой ГД.
Другим важным критерием достижения адекватности сеанса диализа служит удаление избыточной жидкости в ходе процедуры или ультрафильтрация (УФ), что является одним из элементов концепции достижения «сухого веса» пациентами на ГД. В соответствии с этой концепцией пациент должен удовлетворительно переносить как междиализную прибавку жидкости, так и ее удаление в ходе процедуры [5]. Однако при значительной перегрузке жидкостью возникает необходимость в высоких объемах и скорости УФ, что нередко ведет к снижению артериального давления (АД), или к интрадиализной гипотензии (ИДГ), гипоксии и ухудшению перфузии жизненно важных органов. Повторные симптоматические эпизоды гипотензии приводят к ишемии и «станнингу» (оглушению) миокарда, локальным нарушениям сократимости левого желудочка. При развитии ИДГ нередко требуется снижение скорости кровотока, что в свою очередь влияет на обеспеченную дозу диализа. Таким образом, профилактика ИДГ служит актуальной клинической проблемой, требующей новых подходов к профилактике и коррекции. Одним из самых эффективных методов профилактики и коррекции ИДГ является снижение темпов УФ. Таким подходом является компьютерный алгоритм управления скоростью УФ или автоматическая система контроля АД (АСКД), разработанная в качестве опции к аппарату «искусственная почка» Диалог Эволюшн+ компании Б. Браун Авитум АГ. Данная система работает по принципу биологической обратной связи и дает возможность непрерывно корректировать скорость УФ на основе измерений АД в течение всей процедуры. Система предназначена для индивидуального профилирования скорости УФ, что позволяет снижать риск возникновения гипотензии. Этот метод использует систему «fuzzy logic» («нечеткой логики»), регулирующую УФ в соответствии с мгновенными изменениями АД с учетом ранее накопленных данных [6]. Данный подход основан на мониторинге АД пациента и коррекции темпов УФ в реальном времени. При таком подходе возможно применять индивидуальный подход к каждому пациенту.
В литературе имеются лишь единичные публикации по проблеме on-line-мониторинга диализной дозы и компьютерного алгоритма управления УФ у больных на ГД, при этом как комплексная проблема в рамках единого исследования указанные ее аспекты практически не изучены, что и предопределило необходимость проведения данного исследования.
Материал и методы
В первом исследовании, посвященном изучению эффективности методов оценки диализной дозы диализа, больные получали процедуры ГД на аппарате «искусственная почка» Б. Браун Диалог Эволюшн+ с встроенной функцией Adimea, позволяющей интрадиализно измерять индекс eKt/V в on-line-режиме. Каждому пациенту проводили по 3 сеанса ГД или ГДФ в неделю. У всех больных оценивали соответствие результатов измерения обеспеченной дозы диализа классическим биохимическим методом и on-line – ультрафиолетовой спектрофотометрии отработанного диализата с анализом совокупности факторов, способных влиять на точность метода. Также фиксировали АД до и после процедур ГД и как минимум – каждый час в ходе процедуры ГД. Анализировали показатели усредненного АД, скорости потока крови, массы тела после ГД. Уровень АД перед сеансом составлял: САД – 144,1±18,4 и ДАД – 85,2±12,8 мм рт.ст. Эффективное время лечения составило 254,2±19,6 минуты. Данные фиксировали за весь период наблюдения (на протяжении календарного года). Показатели клинической когорты больных первого исследования представлены в табл. 1.
Во второе клиническое исследование, посвященное изучению эффективности АСКД, были включены 35 больных (19 мужчин, 16 женщин). Проводилась оценка эффективности алгоритма контроля скорости УФ. Средний возраст больных составил 52,0±12,2 года. Обеспеченная доза диализа составила 1,89±0,3 (spKt/V), средняя скорость УФ − 8,03±3,6 мл/кг/ч. Уровень АД перед сеансом: САД – 124,6,6±27,7 и ДАД – 71,3±16,3 мм рт.ст. Эффективное диализное время составило 255,6±18,2 минуты, средний объем УФ − 2351,2±1125,6 мл, поток крови − 325,4±46 мл/мин. Средняя постдиализная масса тела составила 67,9±11,4 кг; сухой вес, по данным биоимпедансного анализа, − 67,4±11,2 кг. Средняя постдиализная масса тела превышала измеренный сухой вес на 0,52 кг, что соответствует общепринятым параметрам (сухой вес+0,5 кг=постдиализная масса тела). В качестве переменных использовались средние значения измерений за весь период наблюдений. В исследование были включены больные со склонностью к ИДГ, снижению САД на протяжении процедуры до 90 мм рт.ст. и ниже или снижению на 20 и более мм рт.ст. от нормальных значений в сочетании с появлением клинических симптомов гипотензии (головокружение, тошнота, рвота, потливость, мелькание «мушек» перед глазами, в тяжелых случаях – потеря сознания), преддиализным САД менее 100 мм рт.ст. В исследование не включали пациентов с тяжелой сопутствовавшей хронической сердечно-сосудистой, дыхательной патологиями, злокачественными новообразованиями любой локализации и стадии процесса, дезадаптивными поведенческими реакциями.
Использовали два различных подхода к профилактике и коррекции ИДГ. Стандартный подход предполагал в первые 4 сеанса ГД регистрацию преддиализного АД непосредственно перед подключением пациента к аппарату. В дальнейшем в ходе сеанса диализа АД измеряли у «стабильных» пациентов (уровень АД в целевом диапазоне значений) однократно в течение часа, у «нестабильных» пациентов (уровень АД вне целевого диапазона значений) − однократно в течение получаса или чаще с учетом клинической ситуации. Коррекция гипотензии производилась общепринятыми методами в зависимости от тяжести симптомов: временное отключение УФ, помещение больного в положение Тренделенбурга, в/в введение гиперосмолярных растворов глюкозы, в тяжелых случаях – струйное введение физиологического раствора.
Подход с применением АСКД предполагает анализ кривых АД с применением на последующих диализных процедурах системы интеллектуального подхода с автоматическим выбором предельных значений АД индивидуально к каждому конкретному больному, что позволяет составлять представление о колебаниях АД. При достижении нижней границы САД корректируется скорость УФ в большую или меньшую сторону. У каждого пациента возможно вручную определить нижний предел САД и максимальную скорость УФ до процедуры. Записи о динамике АД больного хранятся в электронной форме в личной карте пациента, что обеспечивается медицинской информационной системой «Nexadia».
При применении АСКД на протяжении 3 процедур гемодиализа уровень АД измеряли с интервалом 5 минут (данная опция обусловлена необходимостью сбора статистических данных для составления кривых АД и прогнозирования эпизодов ИДГ). Начиная с 4-й процедуры благодаря использованию алгоритма интервалы измерения АД увеличивались, но выставлялись автоматически. Последнее измерение проводили после отключения пациента от аппарата (постдиализное АД). Анализировали показатели среднего уровня АД в ходе процедур диализа за весь срок наблюдения. Продолжительность исследования составила 3 недели для каждого больного.
Статистический анализ был проведен с помощью программы Statistica 6.1. Использовали стандартные методы описательной и вариационной статистики: вычисление средних значений и стандартного отклонения при нормальном распределении величин или определение медианы. Для сравнения переменных с нормальным распределением использовали t-тест Стьюдента. При сравнении данных с распределением, отличным от нормального, использовали тесты Вилкоксона или Манна–Уитни. Значимость различий количественных параметров определяли с помощью t-критерия Краскела–Уоллиса. Различия считали значимыми при р<0,05. Корреляционно-регрессионный анализ проводили с определением коэффициента корреляции Пирсона. Связь между признаками считалась сильной при rs≥0,7, средней − при значениях rs=0,3–0,7 и слабой – при rs≤0,3.
 Результаты
Результаты
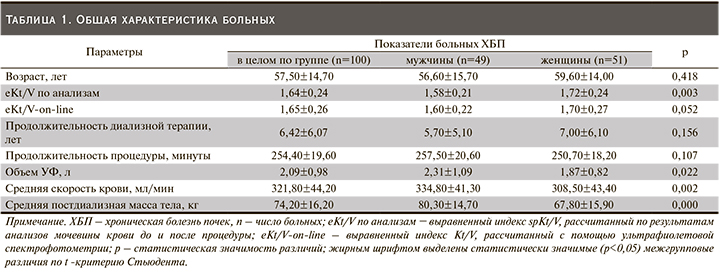
Итоги сравнительного анализа данных, полученных в пер-вом исследовании, представлены на рис. 1. Средние данные эффективности ГД, оцененные разными методами расчета и определения индекса eKt/V, не демонстрируют статистически значимых различий его величины по пробам крови (1,64±0,24) и с помощью метода спектрофотометрии (1,65±0,26; р=0,93).
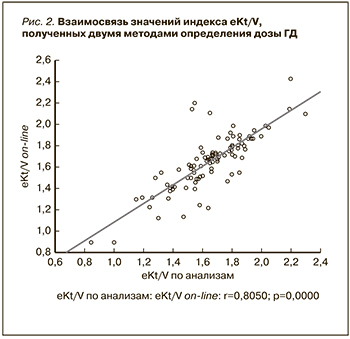
При построении диаграммы рассеяния данных eKt/V по анализам сыворотки крови и Adimea была установлена сильная положительная корреляция (r=0,8) между результатами, полученными двумя методами (рис. 2).
Не обнаружив значимых различий величин индекса eKt/V при измерении его разными способами, мы провели обследование больных с целью уточнения соответствия достигнутой дозы диализа принятым минимальным значениям. При стандартной программе ГД, которая подразумевает проведение процедур 3 раза в неделю, минимальный обеспеченный уровень eKt/V должен быть равен или выше 1,2. Анализу были также подвергнуты результаты достижения целевого уровня индекса eKt/V, определенного с помощью on-line-мониторирования дозы отработанного диализата. Среди больных, включенных в клиническую когорту первого исследования, у 4 (4,0%) отмечено недостижение целевого уровня индекса eKt/V (<1,2). У 96 (96,0%) больных эффективность ГД достигала целевых значений. При более детальном анализе было выявлено, что коэффициенты детерминации в определении индекса eKt/V в зависимости от длительности лечения, индекса массы тела, пред- и постдиализных значений АД, уровней гемоглобина, трансферрина, ферритина, альбумина, креатинина, массы тела до или после процедуры, объема и скорости УФ не достигли статистической значимости. При этом найдена сильная зависимость (р=0,0069) между значением индекса eKt/V и скоростью кровотока на процедуре ГД. Критерий Фишера в дисперсионном анализе регресса равен 16,6 (р<0,001), что свидетельствует о тенденции к достижению более высоких значений достигнутой дозы ГД при увеличении скорости кровотока.
 Сравнивая два метода измерения дозы диализа, мы получили меньшую вариабельность индекса eKt/V, измеренную методом on-line-мониторирования отработанного диализата, по сравнению с методом определения по пробам крови до и после ГД. Такая разница объясняется тем, что доза диализа по пробам крови, согласно рекомендациям, определяется и рассчитывается только 1 раз в месяц вследствие ее обременительности для медперсонала и дополнительной потери крови с точки зрения пациента, особенно если ее проводить на каждом диализе, что, несомненно, усугубит хроническую кровопотерю и ухудшит течение нефрогенной анемии. On-line-методы позволяют измерять индекс eKT/V на каждой процедуре без потери крови и дополнительных финансовых затрат. Это дает возможность своевременно оценивать недостаток диализной дозы при использовании системы Adimea (рис. 3).
Сравнивая два метода измерения дозы диализа, мы получили меньшую вариабельность индекса eKt/V, измеренную методом on-line-мониторирования отработанного диализата, по сравнению с методом определения по пробам крови до и после ГД. Такая разница объясняется тем, что доза диализа по пробам крови, согласно рекомендациям, определяется и рассчитывается только 1 раз в месяц вследствие ее обременительности для медперсонала и дополнительной потери крови с точки зрения пациента, особенно если ее проводить на каждом диализе, что, несомненно, усугубит хроническую кровопотерю и ухудшит течение нефрогенной анемии. On-line-методы позволяют измерять индекс eKT/V на каждой процедуре без потери крови и дополнительных финансовых затрат. Это дает возможность своевременно оценивать недостаток диализной дозы при использовании системы Adimea (рис. 3).
Во время данного исследования был проведен внутренний аудит на предмет поиска ошибок работы медицинского персонала. В ходе проведения аудита выявлено, что средний медицинский персонал при заборе крови для анализа диализной дозы допускал ошибки в среднем в трети случаев. В 17% случаев не уменьшалась скорость кровотока до 100 мл/мин, в 21% случаев после снижения скорости не выдерживался интервал в 15–30 секунд, в 12% случаев не устанавливалась минимальная скорость УФ. При этом за весь период наблюдения отмечено только 2 случая отказа системы on-line-мониторирования индекса eKT/V.

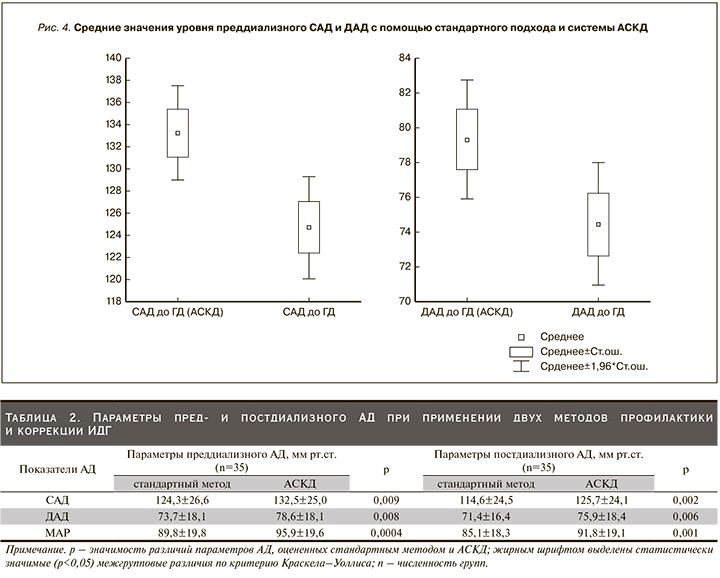
При оценке возможности коррекции ИДГ и профилактики ее эпизодов с помощью блока АСКД были проанализированы результаты исследования 35 больных, получавших процедуры ГД как с помощью стандартного подхода коррекции эпизодов гипотензии, так и при применении компьютерного алгоритма управления УФ. В результате сравнения средних значений уровней пред- и постдиализного САД и ДАД установлено, что при стандартном подходе уровни были значимо ниже, чем при применении АСКД. Рис. 4 демонстрирует средние значения преддиализного САД и ДАД у одних и тех же пациентов, получавших процедуры ГД с блоком АСКД и без него. Все распределения имели высокий уровень значимости (р<0,05).
Средние значения преддиализного САД и ДАД были выше при применении блока АСКД и составили 132,5±25 и 78,6±18,1 против 124,3±26,6 и 73,7±18,1 мм рт.ст. (p=0,009 и p=0,0008 соответственно). Это способствовало лучшей переносимости процедур ГД: уменьшилось число эпизодов гипотензии и жалоб, связанных с чрезмерной скоростью и слишком большим объемом УФ (судороги в мышцах, общая слабость, шум в ушах, пелена перед глазами, осиплость голоса). Различие преддиализных значений АД объясняется тем, что были рассчитаны средние данные всех четырех процедур, при этом преддиализное АД было стабилизировано начиная со второй-третьей процедур. Этот результат обеспечивался лучшим профилем УФ и достижением наиболее подходящего водного статуса пациента за счет минимизации ошибки при установке целевого объема УФ.
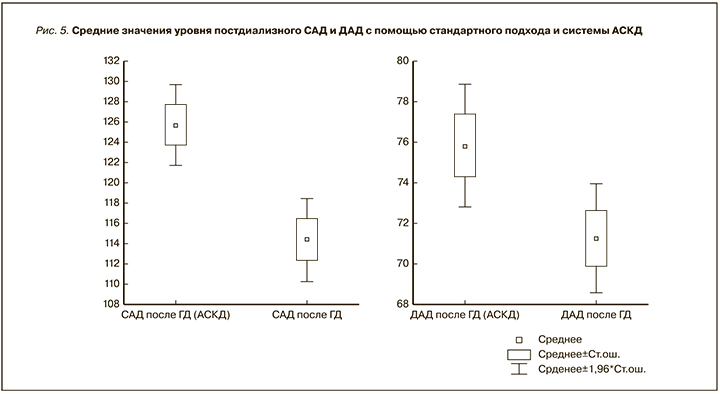
Данные об уровнях постдиализного АД различались: при применении АСКД средние значения АД были выше, чем при стандартном подходе (рис. 5). Уровень САД составил 125,7±24 и 114,3±24,4 мм рт.ст. соответственно (p=0,002). Повышение постдиализных значений САД позволяло больным достигать лучшего общего самочувствия после ГД и в междиализный промежуток. В частности, уменьшилось количество жалоб на слабость, был достигнут лучший контроль АД пациентов дома, что благоприятно влияло на качество жизни – у 23% из них уменьшилось количество жалоб на слабость, головокружение, еще у 29% имела место более редкая дестабилизация АД. Уровни постдиализного ДАД составили соответственно 75,9±18,3 и 71,2±16,3 мм рт.ст. (p=0,006).
В сравнительном аспекте рис. 6 демонстрирует результаты обоих подходов к оценке средних значений пред- и постдиализного САД и ДАД у пациентов с ХБП, получавших ГД. В данном случае при построении графика использовалась диаграмма размаха с расчетом медианы. Сравнение имело статистическую значимость р<0,05. На графике крайние значения АД, выбивающиеся за пределы общей выборки, обозначены как выбросы. Зафиксирован единичный выброс высокого преддиализного значения САД у пациента со злокачественной гипертензией (при этом у него же была склонность к ИДГ) при стандартном подходе.
Средние уровни САД, ДАД и МАР до и после проведения процедуры гемодиализа при их оценке стандартным методом и при применении АСКД представлены в табл. 2.
Значения преддиализного ДАД обнаруживали наибольшее число выбросов со стороны эпизодов как низкого, так и высокого АД. Исследование данных преддиализного ДАД при применении блока управления УФ показало полное отсутствие выбросов со стороны низкого АД и стабилизацию верхних границ уровней ДАД.
Показательно выглядят данные постдиализного ДАД при сравнении двух подходов: результаты применения АСКД оказались оптимальными с точки зрения профилактики постдиализной гипотензии. Так, медиана постдиализного ДАД при применении АСКД приближалась к 80 мм рт.ст. При этом отмечались единичные выбросы с повышением ДАД до 108, 110, 111 мм рт.ст., что было связано с гипергидратацией и недостижением сухого веса. При дальнейшем снижении сухого веса эпизоды повышения постдиализного ДАД регрессировали. Данные по МАР демонстрировали сходные результаты и отличались стабилизацией средних значений МАР на более высоком уровне при оценке как преддиализных, так и постдиализных показателей при применении блока АСКД, что обеспечивает оптимальное проведение ГД для пациента с ХБП. Также в большинстве случаев отмечалось уменьшение размаха колебаний значений, что свидетельствует о меньшем разбросе уровней АД и в перспективе дает лучшие результаты ГД.
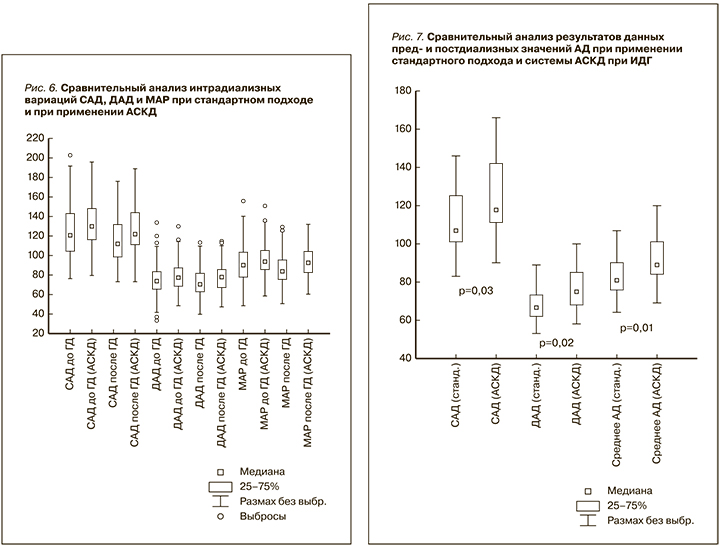
Проведен анализ интрадиализных вариаций АД − изменений САД и ДАД во время процедуры ГД (рис. 7). При их сравнении выявлено, что при применении АСКД значения АД были выше: САД − 124,0±20,5 против 110,2±17,3 (р=0,03) и ДАД − 75,9±14,2 против 68,3±17,9 мм рт.ст. (р=0,02). При изучении интрадиализных вариаций МАР обнаружена сходная тенденция: 82,5±13,9 и 91,5±15,6 мм рт.ст. (р=0,01). Таким образом, применение системы контроля УФ привело к увеличению интрадиализного САД на 11,1%, ДАД на 10%, а MAP на 9,83%.
Исследуя частоту возникновения эпизодов ИДГ во время проведения процедур, мы ориентировались как на сами эпизоды, так и на симптомы, связанные с проявлением гипотензии, требующие интервенций гипертонического раствора глюкозы. Введение 40%-ного раствора глюкозы выполнялось для восполнения сосудистого русла жидкостью из тканей организма, что приводило как к повышению АД, так и к регрессу симптомов. Число интервенций раствора глюкозы 40% (10,0) снизилось на 54,5% − c 86 до 27 (p=0,000). Частоту эпизодов гипотензии рассчитывали как отношение числа эпизодов гипотензии к общему числу измерений АД. Данные нашего исследования показали, что частота эпизодов гипотензии составила 26,2% (211 случаев на 1134 измерения АД) при применении консервативного подхода без дополнительных способов контроля скорости УФ. При применении блока АСКД частота гипотензии составила 8,3% (387 случаев на 4972 измерения АД). Процент снижения составил 20,33% (р=0,000), что позволяет говорить о компьютерном алгоритме контроля скорости УФ как об эффективном способе борьбы с ИДГ.
Обсуждение
Оценка каждого сеанса с помощью системы on-line-мониторирования дозы диализа помогает обеспечивать адекватность лечения, что уже было подтверждено в ранних работах [7]. Мы сравнили данные, рассчитанные при помощи блока Adimea, с результатами, полученными по пробам крови больных группы. В ходе сеансов ГД проводилось сравнение показателей. При проведении корреляционно-регрессионного анализа установили сильную положительную корреляцию между результатами индекса eKt/V, определенного по анализам крови и по блоку on-line-мониторирования дозы диализа, что совпадает с литературными данными [8]: в ходе одного из исследований кровь периодически забиралась для определения содержания мочевины и расчета spKt/V в течение 64 процедур ГД [9]. Одновременно spKt/V определялся и регистрировался системой Adimea. Анализ полученных данных подтвердил существование тесной корреляции (r=0,93) между двумя методами. Было уточнено соответствие достигнутой дозы диализа принятым минимальным значениям. При этом имела место высокая доля пациентов с достигнутым минимальным значением eKt/V – средние значения за 12 месяцев достигли целевых у 96 пациентов из 100, что соответствует рекомендациям Российского диализного общества. В них отмечено, что лучшей характеристикой работы отделения, осуществляющего ГД, является не средняя доза диализа, а доля пациентов, достигающих минимально приемлемой дозы, причем в программах оценки качества помощи такой долей называют 85% [10]. Мы установили, что параметром, значимо влияющим на эффективность процедур, служила скорость УФ.
Этот факт и ранее подтверждался в исследовании H.F. Williams et al. [11]. Авторы снижали кровоток на четверть каждую третью процедуру ГД и получали уменьшение средних значений индекса eKt/V на 18% при классическом методе определения эффективности по пробам крови и на 17% от исходного уровня − при применении on-line-метода – спектроскопии. Исследования V. Wizemann (2001) выявили, что при увеличении скорости потока крови с 300 до 500 мл/мин клиренс по мочевине увеличивается на 40% [12]. Имеются данные о влиянии объема УФ на обеспеченную дозу диализа, что идет вразрез с полученными нами результатами [13].
Данный факт может объясняться тем, что в нашем исследовании больные не имели крайне высоких значений объема УФ и в процентном соотношении скорость УФ не превышала 5% от массы тела. Однако при применении блока ультрафиолетовой спектрофотометрии также возможны ошибки, связанные с неверной интерпретацией результатов при нелинейной форме кривой. Причиной ошибок при использовании данного метода может служить следующее: при снижении эффективной дозы ГД по причине временного снижения кровотока или образования тромбов в диализаторе снижается уровень мочевины в диализате и увеличивается наклон кривой. Блок Adimea интерпретирует данный факт как увеличение клиренса, и график снижения уровня растворенных веществ в отработанном диализате принимает ломаный вид. При таком нелинейном графике нельзя опираться на полученный результат диализной дозы. В будущем ожидается оптимизация алгоритма с целью ликвидации подобных ошибок. В нашем исследовании доля подобных искажений достигла 0,3% от всех случаев измерения и значимо не повлияла на общий результат сравнения данных eKt/V, полученных фотометрическим и биохимическим методами. Следует учесть, что доля ошибок при on-line-мониторировании ничтожно мала по сравнению с таковыми персонала и лабораторной погрешности при классическом определении дозы ГД.
Применение такой опции, как компьютерный алгоритм управления УФ, установленной в аппарат «искусственная почка Б. Браун Диалог Эволюшн+» в ходе процедуры ГД, позволяет осуществлять мониторинг АД в динамике и профилировании скорости УФ. Нами было установлено значимое увеличение усредненных значений АД у больных со склонностью к ИДГ, что совпало с другими данными. В нашем исследовании мы наблюдали снижение распространенности ИДГ с 26,2% (211 случаев на 1134 измерения АД) до 8,3% (387 случаев на 4972 измерения АД) при применении АСКД, что говорит об улучшении клинического результата.
Наши данные близки к результатам исследования, включившего 15 диализных центров в Италии, продемонстрировавшего снижение распространенности ИДГ на 25% [14]. Кроме того, наши данные совпали с результатами работы J.R. Pirkle et al. (2017), проводивших исследование 123 пациентов [15].
В исследовании E.S. Mancini (2007), проведенном в 15 итальянских диализных центрах с участием 55 пациентов, где каждому пациенту было проведено 30 сеансов ГД с функцией АСКД и 30 сеансов со стандартным подходом, отмечено снижение частоты эпизодов ИДГ на 39% и умеренной гипотензии на 12% (р=0,01), что также коррелирует с нашими результатами [16]. Нам удалось продемонстрировать не только преимущество АСКД в профилактике ИДГ, непосредственно регулирующего скорость УФ. В частности, одним из дополнительных эффектов снижения распространенности ИДГ стало снижение числа потребности в интервенциях гиперосмолярного раствора глюкозы для коррекции эпизода ИДГ, что улучшает переносимость процедуры больными и снижает нагрузку на медицинский персонал.
Заключение
Метод ультрафиолетовой on-line-спектрофотометрии продемонстрировал эффективность, простоту и надежность его применения в реальной клинической практике без дополнительных затрат по сравнению с лабораторными методами. Кроме того, снизилась нагрузка на медперсонал, а вероятность ошибок при расчете eKT/V свелась к минимуму. Применение компьютерного алгоритма контроля скорости УФ у диализных больных показало увеличение усредненных значений АД и снижение распространенности эпизодов ИДГ. Таким образом, результаты работы позволяют рекомендовать применение изученных новых аппаратных решений в широкой клинической практике для пациентов на программном ГД.



