Артериальная гипертензия (АГ) занимает ведущее место среди факторов риска формирования и прогрессирования ишемической болезни сердца (ИБС) и хронической болезни почек (ХБП). АГ у больных ХБП является независимым фактором очень высокого сердечно-сосудистого риска по причине как высокой распространенности, так и вследствие сочетания с ИБС и прогрессирующим снижением скорости клубочковой фильтрации (СКФ). Примечательно, что пациенты, находящиеся на диализе, имеют 10–20-кратное увеличение риска развития ИБС по сравнению с общей популяцией. Трансплантация почки в отсутствие противопоказаний является наиболее успешной жизнесохраняющей и экономически выгодной, в особенности по истечении первого года после операции, составляющей интегративного плана ведения и лечения больных терминальной ХБП [1, 2]. В 2022 г. в мире было проведено 50 346 трансплантаций почки (13,47 на 1 млн населения), что покрыло только около 10% потребности [3]. Успешная трансплантация почки существенно улучшает качество жизни и снижает кардиоваскулярный риск до 1,45–5,00-кратного превышения по сравнению с сопоставимой по возрасту и полу общей популяцией. Но при этом продолжают сохраняться действовавшие до трансплантации факторы сердечно-сосудистого риска, такие как АГ, избыточная масса тела/ожирение и сахарный диабет (СД), которые еще больше усугубляются проводимой иммуносупрессивной терапией у реципиентов почечного трансплантата (РПТ) [4, 5]. Ежегодный риск фатальных и нефатальных сердечно-сосудистых событий у этих больных составляет 3–5%, в т.ч. в первые 10 лет пострансплантационного периода [6, 7].
Под посттрансплантационной АГ понимается персистирующее повышение артериального давления (АД) или нормотензивное состояние на фоне антигипертензивной терапии после успешной трансплантации почки [8]. В зависимости от наличия или отсутствия АГ до и после трансплантации выделяется 4 фенотипа РПТ: с персистирующей АГ (40%), с излеченной АГ (28%), с посттрансплантационной (de novo) АГ (19%) и с персистирующей нормотензией (13%) [9]. К посттрансплантационной АГ относятся персистирующая АГ, наблюдавшаяся до и после трансплантации, а также посттрансплантационная (de novo) АГ, возникшая после трансплантации у исходно нормотензивного больного. Чаще всего АГ у РПТ носит систоло-диастолический, реже изолированный систолический или диастолический, характер [8].
Трансплантация почки, по данным Swiss Transplant Cohort Study, проводимая с 2008 г., сопровождается самой высокой частотой АГ уже в течение первого года после пересадки по сравнению с трансплантацией других сóлидных органов (сердца, печени и легких) [10, 11]. При этом частота АГ в посттрансплантационном периоде возросла с 40% c момента включения ингибиторов кальциневрина (ИКН) в протокол лечения до 50–89,5%, достигнув 82% на первом и 81% на пятом году после трансплантации почки [12]. Ее проведение достоверно увеличивало частоту АГ у больных по сравнению с дотрансплантационным периодом, при этом АГ в первый год после операции положительно коррелировала с мужским полом, возрастом и исходным уровнем сывороточного креатинина. Несмотря на распространенную точку зрения, что АД легче контролировать у РПТ, особенно в случае сохраненной СКФ, уровень достижения целевого АД в данной группе больных остается ниже 5,0–45,5% [12]. Резистентная АГ наблюдается в 17,5– 23,5% случаев [12, 13]. Неконтролируемая АГ способствует прогрессированию гипертрофии левого желудочка к пятому году посттрансплантационного периода и развитию хронической сердечной недостаточности (СН) у РПТ, что сопровождается увеличением случаев госпитализации (по поводу СН в течение первого года и застойной СН, ИБС, инсульта – во второй год) и сердечно-сосудистой cмертности [5, 6, 15]. Посттрансплантационная АГ, являясь ведущим фактором риска ИБС, инсульта и застойной СН у РПТ [5], сопровождается снижением выживаемости, обусловленным главным образом присоединением ИБС [6]. Трансплантация почки и АГ, по данным анализа национальной базы данных во Франции (17 526 РПТ), увеличивают риск развития инфаркта миокарда, главным образом без подъема сегмента ST на ЭКГ, в течение первых 5 лет в 1,45 раза (95% ДИ: 1,35–1,55) [15]. Повышение систолического АД на каждые 20 мм рт.ст. свыше 140 мм рт.ст. ассоциировано с ростом частоты больших кардиоваскулярных событий на 32% [16].
Ассоциация АГ и дисфункции почечного трансплантата носит взаимоотягощающий характер, поскольку присутствие АГ, сопровождающейся нарушением суточного профиля АД, ускоряет повреждение трансплантата, а снижение функции аллографта поддерживает и усиливает выраженность АГ. Несколько обсервационных исследований показали, что в течение первого года после трансплантации почки неконтролируемое повышение систолического и диастолического АД (САД и ДАД соответственно) сопровождалось нарастанием уровня протеинурии и креатининемии, повышением риска потери аллографта [5, 17, 18]. G. Opelz и соавт. (1998) в ретроспективном исследовании Сollaborative Transplant Study (29 751 РПТ, с глубиной наблюдения около 7 лет), подсчитали риск потери последнего на каждые 10 мм повышения ДАД≥90 мм рт.ст. [17]. Те же авторы в 2005 г. показали, проанализировав базу данных 24 404 РПТ, что повышение САД свыше 140 мм рт.ст. также ассоциировано с риском потери аллографта на первом и третьем годах после трансплантации [18]. До сих пор недостаточно данных о влиянии изолированной диастолической АГ у РПТ на сердечно-сосудистую заболеваемость и смертность [8]. Резюмируя, можно подчеркнуть, что АГ является значимым неиммунным фактором риска потери почечного аллотрансплантата.
Целевой уровень АД
Несмотря на массу клинических рекомендаций по диагностике и лечению АГ, за последние 10 лет целевой уровень АД у РПТ четко не определен, поскольку отсутствуют рандомизированные клинические исследования, которые показали бы оптимальные таргетные значения АД для этой категории взрослых пациентов. До настоящего времени действуют рекомендации KDIGO (Kidney Disease: Improving Global Outcomes) (2009), осветившие вопросы диагностики и лечения АГ у РПТ и определившие целевое значение АД до 130/80 мм рт.ст. включительно, с невысоким уровнем рекомендаций 2С [19]. Целевые значения офисного АД ниже 130/80 мм рт.ст. для РПТ продолжают сохраняться в последних рекомендациях KDIGO (2021) по ведению больных ХБП [20] и были включены в недавно опубликованные Европейские рекомендации ESH по ведению АГ (2023) [22]. Американские рекомендации 2017 г. также очерчивают целевое значение АД у пациентов этой группы ниже 130/80 мм рт.ст. (уровень рекомендаций IIaB для САД и IIaC для ДАД) [23]. В национальных клинических рекомендациях по диагностике и лечению АГ многих стран, включая РФ, не содержится информации о целевом уровне АД и особенностях ведения данной патологии у РПТ [24, 25] (табл. 1). Основной целью терапии посттрансплантационной АГ является профилактика сердечно-сосудистых осложнений и гипертензивного повреждения почечного аллографта. Еще в European transplant registry (2005) было показано, что снижение исходно повышенного АД сопровождается поэтапным улучшением выживаемости трансплантата и его реципиента без J-образной зависимости [18]. Однако в post-hoc-анализе исследования FAVORIT (Folic Acid for Vascular Outcome Reduction in Transplantation, 3474 РПТ), опубликованного M.A. Carpenter и соавт. в 2014 г., отмечено, что снижение ДАД на каждые 10 мм рт.ст. ниже 70 мм рт.ст. ассоциировано с увеличением сердечно-сосудистого риска на 31% в отсутствие подобной зависимости для ДАД 70 мм рт.ст. и выше [16]. Анализ результатов этого исследования, опубликованный в 2019 г., выявил при этом отсутствие ухудшения функционирования аллотрансплантата при САД ниже 120 мм рт.ст. [26]. В 10-летнем ретроспективном анализе, проведенном N. Pagonas и соавт. (2019) на примере 815 РПТ, была показана лучшая выживаемость пациентов и почечного аллографта при значениях офисного САД ниже 130 мм рт.ст. по сравнению с лицами, САД которых превышало 140 мм рт.ст. и более [27]. В то же время снижение офисного САД ниже 120 мм рт.ст. у РПТ потенциально может сопровождаться нарастанием риска снижения СКФ и развитием острого почечного повреждения, хотя это требует подтверждения результатами рандомизированных клинических исследований.

Лечение АГ и профилактика осложнений АГ у РПТ
Профилактика осложнений обеспечивается достижением оптимальных доз иммуносупрессивной терапии, достаточных для предупреждения развития реакции «трансплантат против хозяина», с одной стороны, и не вызывающих осложнений, с другой. Доза глюкокортикостероидов должна быть уменьшена до минимально эффективной поддерживающей при регулярном мониторировании содержания ИКН в крови для его сохранения в рамках требуемого «терапевтического окна».
Лечение АГ у РПТ характеризуется сочетанием немедикаментозной и медикаментозной терапии, при этом последняя занимает ведущее место. Мероприятия по модификации образа жизни (двигательный режим, диета, уменьшение стресса) не отличаются от таковых у пациентов с АГ и ХБП в целом [8, 20, 28]. Касаясь антигипертензивной терапии, нужно подчеркнуть, что к настоящему времени нет рандомизированных клинических исследований ее оптимального режима у РПТ, не доказано преимущество того или иного препарата у данной группы больных, а выбор препарата определяется коморбидным статусом пациента. Следовательно, достижение контроля посттрансплантационной АГ является основой терапии данной патологии вне зависимости от класса антигипертензивных препаратов. По данным исследования антигипертензивной терапии 16 157 РПТ наиболее часто назначаемыми классами препаратов с 2005 по 2010 г. были β-адреноблокаторы и слегка уступающие им блокаторы медленных кальциевых каналов (БМКК) [29]. Позднее проведенный анализ антигипертензивной терапии, назначенной 147 304 РПТ в США с 2007 по 2015 г., показал выход на первое место блокаторов кальциевых каналов: дигидропиридиновые БМКК – 55,6%, β-адреноблокаторы – 52,8%, диуретики – 30,0%, ИАПФ/ БРА – 21,1%, недигидропиридиновые БМКК – 3,0%, другие препараты – 20,1%. Было зарегистрировано снижение частоты приема ИАПФ/БРА и β-адреноблокаторов (48 и 18% соответственно) в связи с пониманием pro и contra их назначения у РПТ [30]. Среднее число антигипертензивных препаратов составило 2,24±1,03 [31]. Терапия АГ с использованием 3 и более препаратов, включивших β-адреноблокатор или низкие дозы петлевых диуретиков, через 1 год после трансплантации (46,1%) обладает наибольшим риском потери трансплантата. При этом число антигипертензивных препаратов через 1 год является независимым фактором риска данного осложнения (ОР=1,585, 95%ДИ: 1,061–2,367; p=0,025) [32].
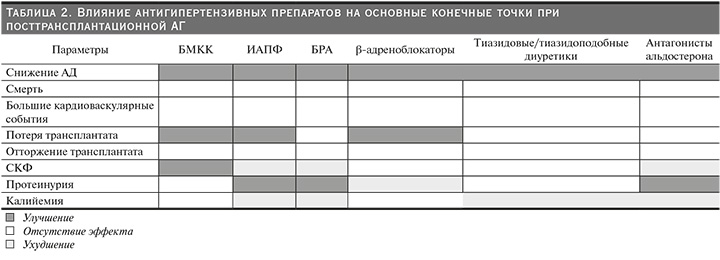
БМКК в настоящее время рассматриваются в качестве препаратов первой линии (уровень доказательности – 1С [20]), поскольку наряду с гипотензивным действием они ослабляют циклоспорин-зависимую вазоконстрикцию приносящей артериолы нефрона [33, 34]. В ряде исследований показана трансплантат-протективная роль препаратов данного класса у РПТ, снижающих частоту посттрансплантационного острого повреждения канальцев и замедленной начальной функции аллотрансплантата [33]. Мета-анализ 29 исследований с участием 2262 больных, сравнивавший БМКК с плацебо/ отсутствием терапии, показал, что данный класс препаратов является эффективным по своему нефропротективному действию (снижение риска потери трансплантата на 25% (95%ДИ: 0,57–0,99) и профилактике снижения СКФ: +4,45 мл/мин (95%ДИ: 2,22–6,68) [33]. В то же время оценка риска потери аллографта базировалась на анализе 17 исследований (1255 участников), в 11 из которых применялись недигидропиридиновые БМКК, при этом глубина наблюдения более 1 года имела место лишь у 26% (321 человек) [34]. Полученные выше данные были подтверждены результатами мета-анализа 71 клинического исследования (26 из них касались БМКК), выполненного А. Pisano и соавт. (2020): снижение риска потери трансплантата (ОР=0,58, 95%ДИ: 0,38–0,89), увеличение СКФ: +3,08 мл/мин (95%ДИ: 0,38–5,78) по сравнению с плацебо/отсутствием терапии [35]. Отсутствовали различия влияния между БМКК и ИАПФ на частоту случаев потери трансплантата при больших значениях СКФ на фоне приема БМКК [33]. Следует подчеркнуть, что дегидропиридиновые БМКК достоверно снижают риск потери трансплантата по сравнению с плацебо в течение 25 месяцев в отличие от недигидропиридиновых представителей препаратов данного класса (ОР=0,62, 95% ДИ: 0,43–0,90 vs ОР=0,91, 95% ДИ: 0,61–1,34 соответственно) [31]. В то же время БМКК в комбинации с глюкокортикостероидами могут усиливать выраженность периферических отеков и мышечной слабости, а в случае сочетания с циклоспорином А существует риск развития гиперплазии десен [8]. Следует помнить, что недигидропиридиновые блокаторы кальциевых каналов (верапамил и дилтиазем), являясь ингибиторами цитохрома CYP3A4, повышают концентрацию ИКН (циклоспорина А и такролимуса) и ингибитора mTOR, что требует более частого мониторирования последних и снижения дозы вышеуказанных антигипертензивных препаратов [36].
Протективная роль блокаторов ренин-ангиотензиновой системы (РАС) остается в зоне пристального внимания у РПТ вследствие сохраняющейся противоречивости. С одной стороны, установлена их антигипертензивная и антипротеинурическая эффективность, но с другой – остается не вполне ясным их влияние на выживаемость почечного трансплантата и РПТ [5]. Масштабное исследование SECRET (Study on Evaluation of Candesartan cilexetil after REnal Transplantation), в котором участвовали 502 РПТ (10% больных СД), показало, что, несмотря на достоверное снижение протеинурии в группе кандесартана к 23-му месяцу терапии, отсутствовали различия в частоте общей и сердечно-сосудистой смертности, длительности выживания аллографта по сравнению с плацебо [37]. Четырехлетнее применение рамиприла у 213 РПТ с протеинурией (>0,2 г/24 час) не выявило достоверных различий с группой плацебо по частоте развития удвоения уровня сывороточного креатинина и смерти [38]. Сходное отсутствие различий по частоте смерти между группами лозартана и плацебо наблюдалось в 5-летнем исследовании Н.N. Ibrahim и соавт. (2013), в котором принимали участие 154 РПТ (37% больных СД) [39]. Мета-анализ 8 рандомизированных исследований (1502 пациента), проведенный S. Hiremath и соавт. (2017), показал, что по сравнению с плацебо блокада РАС вне зависимости от класса медикаментозного препарата (ИАПФ или БРА) сопровождается недостоверным снижением общей смертности (ОР=0,96, 95% ДИ: 0,62–1,51), риска отторжения трансплантата (ОР=0,76, 95% ДИ: 0,49–1,18) или удвоения уровня креатинина сыворотки крови (ОР=0,84, 95% ДИ: 0,51–1,39) [40]. Это совпало с данными мета-анализа W. Cheungpasitporn (2016) 3 рандомизированных клинических и 2 когортных исследований [41]. Напротив, в мета-анализе A. Pisano и соавт. (2020) установлено, что при снижении риска потери трансплантата на фоне приема ИАПФ (13 исследований, ОР=0,62, 95% ДИ: 0,40–0,96) или отсутствии таковой на фоне БРА (10 исследований) выявлено ухудшение функции почечного аллографта и увеличение риска гиперкалиемии на фоне блокаторов РАС [35]. Не показано достоверного улучшения выживаемости РПТ на фоне приема ИАПФ или БРА ни в одном из 9 проанализированных рандомизированных клинических исследований [42]. Описанное выше исследование с приемом лозартана (100 мг/сут. с 3-го месяца после трансплантации в течение 5 лет) не показало уменьшения ренин-ангиотензинальдостерон-индуцированного интерстициального фиброза и канальцевой атрофии по сравнению с группой плацебо [39]. Возможно, протективное влияние блокаторов РАС на выживаемость аллографта и смертность наблюдается только в случае протеинурии больше 1 г/24 час, экстраполируя с популяцией пациентов с ХБП [43]. Следует подчеркнуть, что использование ИАПФ или БРА в лечении АГ в раннем посттрансплантационном периоде сопровождается дополнительными потенциальными рисками обратимого повышения уровня креатинина, мягкого снижения СКФ, увеличения частоты гиперкалиемии и анемии. Риск гиперкалиемии был в 3 раза выше на фоне приема ИАПФ или БРА [35]. Все это является основанием задержки инициального назначения препаратов данных классов на 3–6-м месяцах после трансплантации почки с целью избежать побочных эффектов и исключить их влияние на повышение уровня креатинина сыворотки крови в случае диагностики острой реакции отторжения трансплантата [36]. Также описано развитие ангионевротического отека в случае комбинации ИАПФ и ингибитора mTOR, а также развитие эналаприл-ассоциированной анемии у РПТ [34]. В целом, несмотря на отсутствие достоверных данных на улучшение выживаемости, ИАПФ и БРА могут использоваться с 3–6-месячной отсрочкой у РПТ с АГ и гипертрофией левого желудочка, хронической СН и протеинурией [8].
Β-адреноблокаторы эффективны при посттрансплантационной АГ, уменьшая гиперсимпатикотонию, увеличивая выживаемость в течение 10-летнего наблюдения за 321 РПТ, однако нет рандомизированных клинических исследований, подтвердивших последнее [35]. При этом они обладают аддитивным положительным влиянием на выживаемость больных и почечного трансплантата в условиях комбинации с ИАПФ или БРА. В то же время следует помнить, что у РПТ препараты этого класса могут провоцировать неблагоприятные метаболические эффекты, протеинурию, гиперкалиемию и маскировать симптомы гипогликемии, что нужно учитывать при их назначении [8]. Использование β-адреноблокаторов может быть предпочтительным у РПТ в случае ИБС, аритмии и хронической СН [34].
Говоря о тиазидовых и тиазидоподобных диуретиках, нужно отметить их эффективность в коррекции посттрансплантационной сольчувствительной АГ, индуцированной ИКН [12], несмотря на неблагоприятные метаболические эффекты (гипергликемия, дислипидемия, гиперурикемия, гипокалиемия, гиперкальциемия, гипонатриемия) [44]. В сравнительном исследовании А.D. Moes и соавт. (2017) была показана сходная эффективность хлорталидона и амлодипина у РПТ, получавших такролимус [44]. Таким образом, тиазидовые диуретики могут быть альтернативой БМКК в случае непереносимости последних или при наличии периферических отеков у РПТ, а также при гипомагниемии в случае параллельного применения ИКН [8]. Антагонисты минералокортикоидных рецепторов (спиронолактон [45], эплеренон [46]) могут использоваться при резистентной АГ, в т.ч. при сохранении протеинурии на фоне ИАПФ или БРА, у больных этой группы. Было показано, что эти препараты эффективно снижают протеинурию, при параллельном легком снижении СКФ [45, 46], хотя при этом число включенных в исследования пациентов было невелико. Лимитирующим фактором для их назначения является гиперкалиемия, особенно в случае параллельного приема ИКН [8]. Фактором риска развития гиперкалиемии свыше 5 ммоль/л на фоне приема эплеренона 25 мг/сут. был исходный уровень калия в крови>4,35 ммоль/л [46]. Антагонисты минералокортикоидных рецепторов могут обладать потенциальным ренопротективным действием в условиях параллельного приема ИКН, поскольку последние, активируя минералокортикоидные рецепторы гладкомышечных клеток, вызывают вазоконстрикцию и в конечном итоге индуцируют снижение функции почечного аллотрансплантата. Данный класс препаратов может использоваться в терапии посттрансплантационной АГ у пациентов с сохраняющейся протеинурией при параллельном приеме ИКН [8].
α1-блокаторы и α2-агонисты центрального действия (клонидин), уменьшающие почечное сосудистое сопротивление, используются только в качестве дополнительной терапии резистентной посттрансплантационной АГ [8].
Суммарно влияние антигипертензивных препаратов на основные конечные точки при посттрансплантационной АГ представлено в табл. 2 (по A.Pisano и соавт. (2020) [35], в модификации).
При посттрансплантационной АГ чаще всего используется комбинированная терапия, преимущественно в виде сочетания дигидропиридинового БМКК и β-адреноблокатора, а при стабилизации функции почечного аллотрансплантата при необходимости вводятся ИАПФ или БРА, в особенности при наличии коморбидной патологии, протеинурии или развитии посттрансплантационного эритроцитоза. В случае резистентной АГ [47], истинная частота которой остается неизвестной у РПТ, после исключения вторичных причин (реноваскулярная АГ) и усугубляющих факторов могут быть использованы антигипертензивные препараты других классов (диуретики, α1-блокаторы, α2-агонисты центрального действия – клонидин). Но при этом лечащий врач должен учитывать сопутствующую патологию, фармакокинетику, межлекарственное взаимодействие, переносимость; адаптировать дозы медикаментов в случае развития дисфункции почечного аллотрансплантата с целью минимизации побочных эффектов [8, 48], а также принимать во внимание потенциальную некомплаентность молодых РПТ [49].
Полная денервация в виде лапароскопической двусторонней нефрэктомии собственных почек, способствующая уменьшению ангиотензин II-опосредованных эффектов [50] и симпатическая денервация собственных почек путем катетерной аблации [51] у РПТ рассматриваются в качестве крайней меры в терапии истинно резистентной посттрасплантационной АГ, угрожающей развитием осложнений [8]. Претрансплантационная двусторонняя нефрэктомия собственных почек у 32 РПТ сопровождалась снижением САД, индекса массы миокарда левого желудочка, уменьшением числа принимаемых антигипертензивных препаратов по сравнению с сопоставимой контрольной группой [50]. Данный вид хирургического вмешательства обременен риском осложнений, которые могут способствовать нарушению функционирования почечного аллотрансплантата [8]. Катетерная аблация почечных артерий собственных почек 18 РПТ с резистентной посттрансплантационной АГ показала достоверное снижение САД, восстановление нарушенного суточного профиля АД при сходной частоте осложнений по сравнению с пациентами контрольной группы, находившихся на медикаментозной терапии [51].
Особенностями терапии АГ в периоперационном периоде является применение петлевых диуретиков с целью контроля гиперволемии, с сохранением при этом «сухого веса» больного чуть выше его исходно установленного значения с целью профилактики интраи послеоперационной артериальной гипотензии [52]. Теоретически петлевые диуретики могут уменьшать ишемическое почечное повреждение и риск замедленной начальной функции почечного аллотрансплантата, хотя последнее не получило своего подтверждения у РПТ в условиях реальной клинической практики, что, возможно, связано со снижением почечного кровотока [52]. В настоящее время фуросемид используется для определения повышенного риска замедленной начальной функции трансплантата, проявляющегося неадекватным ответом на внутривенное введение данного препарата в дозе 1,5 мг/кг через 3 часа после наложения анастомоза аллографта (диурез <350 мл за 4Тчаса) [53]. Препараты этой группы увеличивают риск инфекции мочевыводящих путей в течение первых 5 лет после трансплантации почки вследствие истощения медуллярного градиента хлорида натрия, снижающего равновесие М1/М2 медуллярных мононуклеарных фагоцитирующих клеток, что приводит к нарушению динамической антибактеральной защиты РПТ, что наряду с электролитными нарушениями закономерно ограничивает возможность применения петлевых диуретиков в плановой антигипертензивной терапии [54]. Также показано продолжение использования ранее начатых β-адреноблокаторов или клонидина с целью профилактики «рикошетной» АГ, назначение при необходимости дигидропиридиновых БМКК, тиазидовых/тиазидоподобных диуретиков с последующим подключением ИАПФ или БРА при улучшении почечной функции трансплантата и отсутствии гиперкалиемии [5, 8].
Заключение
Резюмируя, можно сказать, что АГ является наиболее частым фактором сердечно-сосудистого риска у РПТ. Трудность терапии посттрансплантационной АГ сопряжена с ассоциированной множественной коморбидностью, вынужденной полипрагмазией, определенной патогенетической стадийностью, что требует осуществления полидисциплинарного подхода и «бесшовного» ведения пациента. Вопросы целевого уровня АД, оптимизация тактики антигипертензивной терапии и ее влияние на конечные кардиоваскулярные и трансплантат-зависимые точки являются предметом дальнейших исследований у данной группы больных.



