Введение
Перитонеальный диализ (ПД) следует предлагать каждому пациенту с почечной недостаточностью, подходящему и рассматривающему возможность поддерживающего лечения диализом. Многие предпочитают ПД, поскольку его можно организовывать в домашних условиях, и он обеспечивает большую независимость, чем лечение гемодиализом (ГД) в стационаре. ПД является приоритетным во многих регионах, поскольку он обеспечивает схожие результаты лечения и часто дешевле, чем ГД в стационаре [1–3]. Значительное число пациентов с почечной недостаточностью – пожилые или немощные лица, имеют множественные физические или когнитивные нарушения, что может ограничивать их способность самостоятельно выполнять процедуру ПД. У пациентов также может отсутствовать поддержка семьи при обеспечении организации ПД. Оказание помощи может преодолеть эти барьеры, позволяя большему числу людей использовать ПД, в связи с чем ассистируемый ПД (асПД) является ключевым методом, который расширяет выбор для пациентов и обеспечивает более равноправный доступ к терапии диализом в домашних условиях. Цели данного обзора – определить возможности использования асПД с нашей точки зрения, описать основные аспекты асПД и предоставить рекомендации по расширению его доступности на международном уровне.
Точка зрения, содержание понятия ассистируемого ПД
Неспособность самостоятельно выполнять процесс ПД и отсутствие поддержки со стороны семьи, партнера или супруга являются распространенными препятствиями к методу ПД. Для таких пациентов организация помощи ПД в условиях дома может преодолеть эти препятствия и позволить им получать ПД по месту жительства. Помощь с выполнением ПД оказывали члены семьи, друзья, домашние помощники, сотрудники службы частного найма, медицинские приспособления, практикующие медсестры (медсестра, которая оказывает базовый уход) пациентам, или дипломированные медсестры (медсестра, которая получила специализированное образование в области сестринского дела) [4–6]. Хотя рабочая группа признает ценность всех форм помощи, данная точка зрения с изложением позиции будет сосредоточена на асПД, финансируемом системой здравоохранения, включая государство, медицинское страхование, благотворительные организации и другие организации. В эту сферу действия входит помощь, оказываемая медицинскими работниками, обученными неспециалистами и оплачиваемыми членами семьи. Данная позиция не распространяется на поддержку, оказываемую неоплачиваемыми членами семьи, друзьями, частными сиделками или домашними работниками, оплачиваемыми семьями. Также не рассматривается ПД, предоставляемый сотрудниками учреждениями длительного ухода или другими учреждениями интернатного типа. Если внешние помощники, финансируемые государством или ОМС, посещают эти учреждения, то это входит в сферу действия настоящей точки зрения.
Обоснование ассистируемого ПД
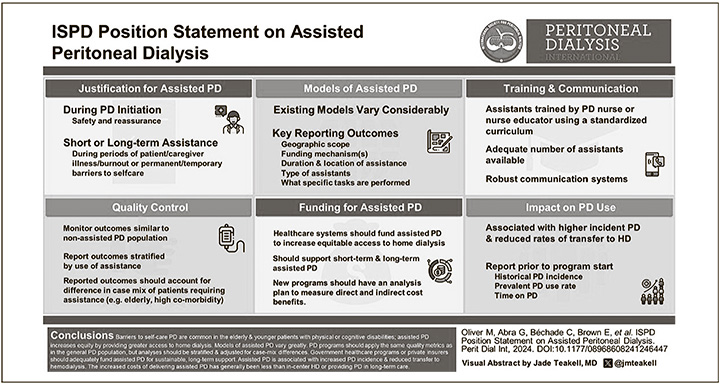
Существует множество потенциальных препятствий для самостоятельного лечения ПД (табл. 1). Эти препятствия часто встречаются у пожилых и часто у немощных лиц с почечной недостаточностью. В предыдущем исследовании Оливера и соавт. медсестры отделения ПД регистрировали препятствия к методу ПД во время обучения по мере возникновения и обнаружили, что 63% пациентов без противопоказаний к ПД имели физические или когнитивные препятствия к самостоятельному выполнению ПД [7]. В другом исследовании, проведенном той же исследовательской группой, комплексная гериатрическая оценка, проведенная у лиц в возрасте 50 лет и старше во время обучения ПД, показала, что немощность, функциональная зависимость и нарушения когнитивных функций были очень распространены, что приводило к частой потребности в посторонней помощи в первые шесть месяцев ПД [8]. Эксперты рекомендуют проводить рутинный скрининг на предмет старческой дряхлости у пожилых пациентов, рассматривающих ПД как метод лечения. Этот скрининг можно проводить с использованием таких инструментов, как Клиническая шкала старческой дряхлости [9, 10]. При наличии старческой дряхлости можно провести комплексную гериатрическую оценку.
Особое значение имеет проблема снижения когнитивных функций. Снижение когнитивных функций представляет собой серьезную проблему для пожилых людей и их семей. Имеются данные о более высокой распространенности снижения когнитивных функций среди пациентов, получающих лечение гемодиализом, по сравнению с общей популяцией, причем потенциально быстрое снижение связано с падением мозгового кровотока и признаками острого повреждения головного мозга во время процедур гемодиализа [11–14]. Лица с когнитивными нарушениями могут лучше переносить диализ в привычной домашней обстановке, чем в шумном и оживленном центре гемодиализа, но им потребуется помощь.
Пациенты, инициирующие самостоятельно лечение ПД, со временем могут испытывать снижение физических или когнитивных функций [9, 15]. У других пациентов может развиться новое заболевание, которое временно ограничит их способность самостоятельно продолжать оказывать помощь себе. Изменения в состоянии здоровья лица, осуществляющего уход (семья, друзья), также могут снизить поддержку в оказании лечения ПД в условиях дома. АсПД может обеспечить нуждающимся своевременную кратковременную помощь в лечении и позволить пациентам оставаться на домашнем диализе, что снижает риск перевода на гемодиализ. Если пациенты выздоравливают, они часто могут вернуться к самостоятельному лечению ПД.
Возраст – не единственный фактор, обуславливающий необходимость в помощи. Дети и молодые люди с ограниченными возможностями, которые полагаются на помощь для лечения ПД на дому, предоставляемую семьей, могут получить услугу ассистируемого ПД, чтобы снизить нагрузку на лиц, осуществляющих уход. Многие из этих пациентов предпочитают получать диализ в привычной домашней обстановке, плохо переносят лечение гемодиализом в центре, транспортировка туда требует сложных транспортных мероприятий и договоренностей. Действительно, было показано, что удовлетворенность диализом выше у пациентов на перитонеальном диализе, выполняемом с чьей-либо помощью, по сравнению с пациентами, получавшими лечение гемодиализом в стационаре, требующем транспортировки [16]. Ценность терапии на дому была особенно заметна во время пандемии COVID-19, когда уровень инфицирования у ПД пациентов был ниже, а вспышки происходили в местах скопления людей [17]. ПД был связан с более низким риском заражения SARS-CoV-2 и связанной с этим госпитализацией, поэтому ПД, выполняемый с чьей-либо помощью, может предотвратить инфицирование у уязвимых пациентов [17–19]. Преимущества домашнего диализа с использованием перитонеального диализа по сравнению с гемодиализом в стационаре для пожилых пациентов представлены в таблице 2.

Нагрузка на лиц, осуществляющих уход, распространена при лечении ПД. Исследования, согласно данным, полученным с помощью инструмента опроса Zarit Burden Interview, показывают, что 60% лиц, осуществляющих уход за ПД пациентами, испытывают легкое или умеренное выгорание, в то время как 13% испытывают умеренное или тяжелое выгорание [20, 21]. Грива и соавт. сравнили бремя ухода членов семьи, обычно супругов или взрослых детей, помогающих выполнять процедуры ПД пациентам, с членами семьи, где пациент самостоятельно выполняет ПД, также используя инструмент опроса Zarit Burden Interview [22]. Члены семьи, оказывающие содействие в ПД пациентам, сообщили, что они выполняли больше задач, но бремя ухода было одинаковым, как у пациентов, которым оказывалась помощь, так и у тех, кто выполнял самостоятельно.
Распространенными показаниями для оказания помощи являются:
1) во время начала ПД для обеспечения безопасности и обретенная уверенность пациентов и лиц, осуществляющих уход;
2) долгосрочная помощь пациентам, имеющим постоянные препятствия к самостоятельному лечению без посторонней помощи;
3) краткосрочная помощь пациентам с временными препятствиями к самостоятельному лечению без посторонней помощи;
4) краткосрочная помощь пациентам, получающим поддержку со стороны лица, осуществляющего уход, в периоды болезни или выгорания;
5) краткосрочная помощь пациентам во время острых заболеваний (например, перитонита).
Рекомендации
1. Лица, рассматривающие или выбирающие ПД, должны пройти междисциплинарную оценку для выявления физических, когнитивных, эмоциональных и социальных барьеров на пути к ПД, которые можно преодолеть с помощью асПД.
2. Лица, осуществляющие уход за лицами, рассматривающими или выбирающими ПД, должны проходить оценку на предмет бремени ухода.
3. Пациенты, получающие лечение ПД самостоятельно или с помощью семьи, должны регулярно проходить обследование на предмет возникновения новых барьеров, чтобы можно было своевременно начать асПД.
4. Лица, осуществляющие уход за ПД пациентами, должны регулярно контролироваться на предмет нагрузки по уходу, чтобы асПД мог быть внедрен по мере необходимости.
5. АсПД может быть использован как план мероприятий по снижению трансмиссивных инфекций, позволяя большему количеству пациентов получать лечение в домашних условиях, а не в местах массового пребывания.
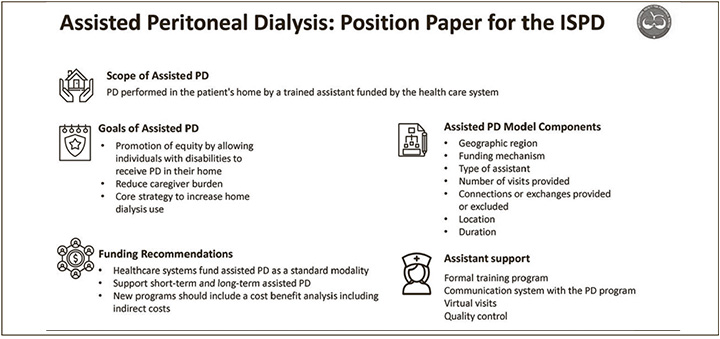
Модели ассистированного перитонеального диализа
Модели ассистированного ПД, применяемые в разных регионах мира, существенно различаются в зависимости от местной культуры, политики здравоохранения, систем возмещения расходов и распространения каждого метода диализа [23–25]. Модели ухода, опубликованные в литературе, различаются по географическому охвату, механизмам финансирования, типу помощников, выполняют ли помощники подключение к циклеру или ручные обмены, месту оказания помощи и ее продолжительности (табл. 3).
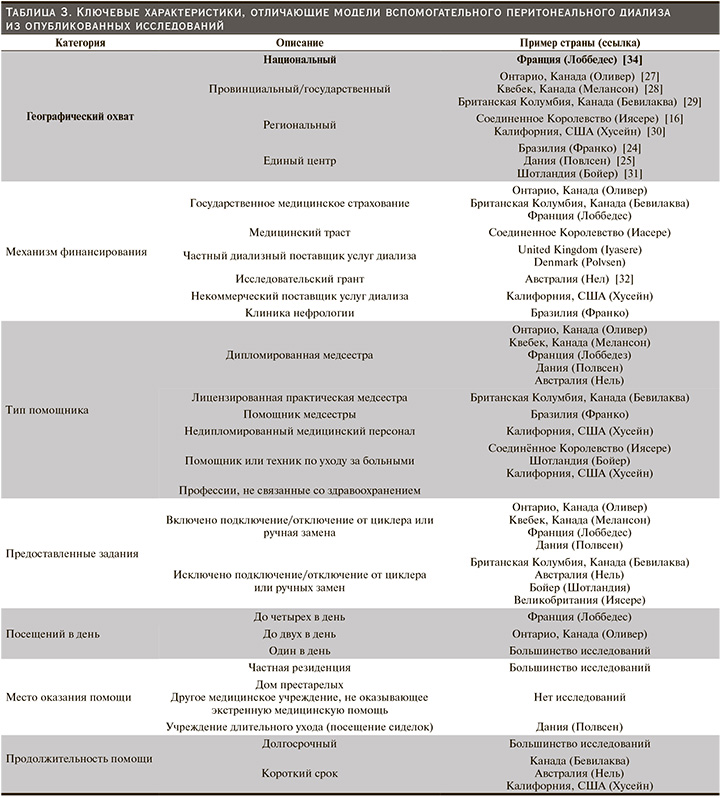
Наибольший географический охват программ помощи, описанных в литературе, приходится на Францию, где действует общенациональная программа, а также на провинции Британская Колумбия и Онтарио (Канада). Государственное медицинское страхование финансирует эти программы, обеспечивая их устойчивость. Краткосрочный или временный уход предоставляется наряду с долгосрочной поддержкой при хронических заболеваниях. Другие программы помощи часто имеют меньший масштаб, представляют собой отдельные центры, финансируемые исследовательскими фондами, частными поставщиками услуг диализа или местными поставщиками услуг диализа, и могут быть менее устойчивыми, чем программы, финансируемые государством.
В программах во Франции и Онтарио помощниками являются дипломированные медсестры, в то время как в модели Британской Колумбии использовались лицензированные практикующие медсестры, предоставляемые частной компанией. В других моделях с ассистированием, описанных в литературе, профессиональный состав включает дипломированных медсестер, лицензированных практикующих медсестер, помощников медсестер, помощников по уходу и лиц, оказывающих персональную поддержку. Члены семьи, получающие оплату, также могут оказывать помощь за счет государственного финансирования в Калифорнии (США), но на сегодняшний день исследований, посвященных этой модели, не опубликовано.
Другим фактором, который отличает модели ассистируемого перитонеального диализа, является то, обеспечивают ли ассистенты подключение или отключение от циклеров перитонеального диализа или выполняют ручные обмены ПД. Модели, которые предоставляют эту услугу, существуют во Франции, Дании и Онтарио (Канада), а также были предоставлены в пилотном исследовании в Квебеке (Канада). Большинство других программ ограничивают помощь, которая может разрешать настройку циклера ПД, но не подключение или ручные обмены. Эта ограниченная форма помощи может быть полезна пациентам и их семьям, но не оказывает непосредственной помощи в лечении ПД. Модели, в которых работают дипломированные или практикующие медсестры, также могут проводить оценку состояния пациента (вес, артериальное давление, степень гидратации), обеспечивать уход за катетером для перитонеального диализа и вводить лекарства, включая антибиотики интраперитонеально, если это необходимо. Сводка задач, связанных с ПД, которые могут потребовать помощи, представлена в таблице 4.

Количество визитов зависит от того, выполняют ли ассистенты подключение или ручные обмены, а также от возможностей пациента или его семьи оказать поддержку. Во Франции для полной поддержки непрерывного амбулаторного перитонеального диализа (ПАПД) предоставляется до четырех визитов в день [34]. В Онтарио (Канада) для настройки, подключения и отключения аппарата для АПД предоставляется до двух посещений в день. В некоторых случаях пациенты или члены их семей могут по-прежнему выполнять отключение, поэтому первый визит предназначен для настройки аппарата и может быть предоставлен в течение дня, а второй визит приурочен к вечернему подключению. Другие программы предусматривают ежедневные посещения для настройки оборудования, но не для подключения, отключения или ручных обменов. Количество посещений также может ограничиваться стоимостью. Некоторые механизмы финансирования могут возмещать расходы за каждый визит, в то время как другие, например, в Онтарио (Канада) предоставляют пакетную оплату с большей гибкостью.
Продолжительность обслуживания также варьируется. Существующие государственные программы предоставляют долгосрочную помощь, но часто предусматривают отдельное финансирование краткосрочного или временного ухода. Программы поддержки, финансируемые в рамках исследовательских или пилотных программ, могут не предусматривать долгосрочную помощь.
Наконец, модели различаются в зависимости от места предоставления услуг. Большинство лиц, оказывающих помощь, посещают частные дома, но также могут посещать дома престарелых, дома сестринского ухода и другие учреждения, кроме больниц интенсивной терапии, чтобы облегчить процесс оказания услуг первичной медико-санитарной помощи, избегая необходимости обучения персонала в этих учреждениях. Поддержание необходимого уровня квалификации персонала в учреждениях может быть сложной задачей, если численность персонала в учреждениях первичной медико-санитарной помощи не является постоянной или наблюдается высокая текучесть кадров.
Рекомендации
Модели асПД значительно различаются, поэтому их основные характеристики должны быть подробно рассмотрены до внедрения и описаны при сообщении о результатах, включая их географический охват, механизмы финансирования, тип лиц, оказывающих помощь, выполняют ли они подключение к циклеру или выполняют ручные обмены, а также продолжительность и место оказания помощи.
Обучение и доверительное общение с лицами, оказывающими помощь в процедуре ПД
Необходимо обучить лиц, оказывающих помощь, процедурам ПД, соответствующим их навыкам. В большинстве случаев обучение будет включать большинство задач, выполняемых самостоятельно пациентами во время процедуры. Обучение может проводить преподаватель медсестер или опытная медсестра, владеющая всеми методами перитонеального диализа, но также возможно сотрудничество с частными корпорациями или поставщиками услуг диализа. Обучение обычно проводится в центре перитонеального диализа, но также может проводиться в агентствах по уходу на дому или других учебных заведениях.
Необходимо подготовить достаточное количество лиц, оказывающих помощь, чтобы обеспечить необходимые визиты без спешки. Количество будет зависеть от количества визитов, необходимых для одного пациента, характера выполняемой задачи, количества обслуживаемых пациентов и времени (расстояния) для перемещения между пациентами. При отсутствии персонала должны включаться дублирующие схемы. Пропущенные визиты могут иметь клинические последствия и вызывать стресс у пациентов и их семей, так как они зависят от помощи при лечении перитонеальным диализом.
Программы ПД, выполняемые с чьей-либо помощью, должны иметь надежную систему коммуникации с лицом, оказывающим помощь. Она может включать регулярные телефонные звонки, электронные письма или визиты для оценки состояния пациентов, получающих помощь. Виртуальные телефонные или видеозвонки из дома в присутствии ассистента могут снизить потребность в посещении клиники ослабленными пожилыми пациентами. Дистанционный мониторинг в общей популяции ПД пациентов ассоциируется с уменьшением перевода на гемодиализ, госпитализаций, повышением приверженности и снижением выгорания пациентов и лиц, осуществляющих уход, однако его конкретная роль для асПД не определена.
Рекомендации
1. Лица, которые оказывают помощь, должны быть обучены преподавателями сестринского дела или опытными медсестрами, прошедшие обучение по стандартизированной учебной программе ПД.
2. Лица, которые оказывают помощь, должны быть обучены выполнению задач во время процедуры ПД, соответствующих им навыкам.
3. Необходимо предусмотреть достаточное количество лиц, оказывающих помощь, для ожидаемого количества пациентов, с учетом географического района, а также предусмотреть дублирующие схемы при отсутствии персонала.
4. Должна быть надежная система коммуникации с лицом, оказывающим помощь, и пациентом, не способным самостоятельно проводить ПД.
Контроль качества
Непрерывное улучшение качества (CQI), определяемое как структурированный организационный процесс вовлечения людей в планирование и выполнение непрерывного потока улучшений для предоставления качественной медицинской помощи, которая соответствует ожиданиям, должно быть внедрено в программы ПД [36, 37]. Руководящие принципы Международного общества перитонеального диализа (ISPD) рекомендуют, чтобы программа ПД контролировала частоту перитонита, осложнения, связанные с ПД катетером, и частоту перевода на гемодиализ у всех ПД пациентов, включая тех, кто находится на лечении асПД. В рамках инициативы «Стандартизированные результаты в нефрологии» (SONG) был разработан основной набор результатов для ПД, основанный на общих приоритетах пациентов, лиц, осуществляющих уход, врачей, исследователей, политиков и соответствующих заинтересованных сторон, включая инфекции, связанные с ПД, сердечно-сосудистые заболевания, смертность, продолжительность ПД и участие в жизни [38]. Показатели результатов, сообщаемые пациентами (PROMs), могут быть особенно актуальны для пациентов, получающих асПД. PROMS можно определить, как меру того, как лицо, получающее лечение ПД, воспринимает жизнь и свое благополучие. Следует учитывать симптомы пациента и влияние режима диализа на его жизнь, психическое здоровье и социальные обстоятельства [39]. Примерами PROM являются инструмент оценки качества жизни при заболеваниях почек, iPOS-Renal, система оценки предпочтений PROMIS и опросник участия в жизни SONG [38, 40, 41]. Однако пожилые немощные лица с когнитивными нарушениями часто не склонны участвовать в официальных PROMS. Руководства ISPD в настоящее время не рекомендуют измерять PROMS в повседневной практике [39].
Программы непрерывного повышения качества лечения (CQI) оказались особенно эффективными в снижении частоты перитонитов [42–44]. Фанг и др. сообщили об улучшении показателей перевода на ГД и выживаемости с течением времени [45]. Рабочая группа не нашла опубликованных проектов по улучшению качества, специально предназначенных для асПД. Оливер и соавт. обнаружили, что пациенты, получающие асПД, имеют схожие показатели госпитализации с пациентами, получающими гемодиализ в стационаре [27]. Пациенты, использующие асПД, имеют более низкие показатели перевода на гемодиализ и схожие показатели перитонита [26, 46]. Пациенты, принимающие участие в асПД, значительно старше, чем пациенты, выполняющие процедуры ПД самостоятельно, поэтому у них ниже частота трансплантации и более высокие показатели смертности [26].
Переход от асПД к самостоятельному лечению или неоплачиваемой помощи семьи, который можно назвать завершением программы ПД, выполняемый с чьей-либо помощью, может быть еще одним важным показателем. В Онтарио (Канада) 48 (38%) из 203 пациентов, которым оказывалось содействие при процедуре ПД, перешли от помощи медсестры к самостоятельному лечению или к помощи семьи [27]. Показатели завершения программы, вероятно, различаются в зависимости от того, как программы отбирают пациентов для получения помощи. Например, некоторые программы могут предоставлять асПД практически всем пациентам, начинающим ПД, для обеспечения безопасности, предоставляя дополнительную поддержку, а затем прекращая ее. Другие программы могут использовать более ограничительный подход, снижая темп завершения программы.
Члены рабочей группы пришли к общему мнению о том, что для достижения устойчивого контроля качества необходимо использовать стандартные определения, методы сбора данных, анализа и отчетности, чему может способствовать центральная организация. Программы асПД могут разрабатывать процессы и показатели результатов для оценки критериев отбора пациентов, обучения персонала и лиц, оказывающих помощь, а также мониторинга ключевых показателей эффективности, но они должны быть официально оценены и валидированы до их широкого применения. К конкретным областям, представляющим интерес для асПД, относятся пропущенные визиты, ненадлежащее выполнение лечения (отклонение от практики), предикторы перехода к самостоятельному лечению и удовлетворенность пациента/семьи.
Рекомендации
1. Программы ПД должны контролировать результаты лечения пациентов, получающих помощь, на предмет их схожести с результатами лечения пациентов, не получающих помощь во время процедуры. Эти результаты должны учитывать местные требования и соответствовать рекомендациям Международного общества перитонеального диализа.
2. Отчетность о результатах должна быть стратифицирована по использованию помощи.
3. При составлении отчетов о результатах следует учитывать различия в структуре случаев пациентов, получающих помощь (например, пожилой возраст, более выраженную сопутствующую патологию).
Финансирование
Доступность и источники финансирования асПД значительно различаются. Существующие программы получают устойчивое финансирование от правительства для поддержки как краткосрочной, так и долгосрочной помощи. Программы ПД, выполненные с чьей-либо помощью, часто на пилотной или ограниченной основе, получали финансирование из исследовательских грантов, от поставщиков услуг диализа или местных клиник. Исследования, основанные как на реальных, так и на смоделированных данных, продемонстрировали экономию средств, связанную с асПД [6, 47]. Например, в Британской Колумбии (Канада) для асПД к стоимости процедур ПД добавлял 15 000 канадских долларов в год, что было дешевле, чем предоставление ПД в учреждении длительного ухода или предоставление гемодиализа в центре. В асПД участвовала лицензированная практикующая медсестра вместо дипломированных, которая не обеспечивала подключения к АПД или ручные обмены и предусматривала только один визит в день. В Онтарио (Канада) нефрологическая сеть получает средства от Министерства здравоохранения провинции, которые направляются агентствам по уходу на дому или программам по лечению заболеваний почек для финансирования асПД. Финансирование предоставляется в виде краткосрочного или долгосрочного пакета на пациента (табл. 5). Годовой объем финансирования составляет 20 566 канадских долларов для поддержки медсестер, обеспечивающих подключение к АПД или ручные обмены, до двух визитов в день. Если программы диализа получают средства, они могут заключить контракт с поставщиком услуг по уходу на дому или предоставлять помощь, используя свой персонал. Последняя модель используется в Оттаве (Канада) с целью удержания на ПД пациентов и перехода к самостоятельности (т.е. к самообслуживанию или поддержке семьи). При этом только 10% пациентов получают долгосрочную поддержку. Координатор медицинских услуг назначается для каждого пациента, а виртуальная сестринская поддержка и оценка врачей также используются для повышения экономической эффективности программ.
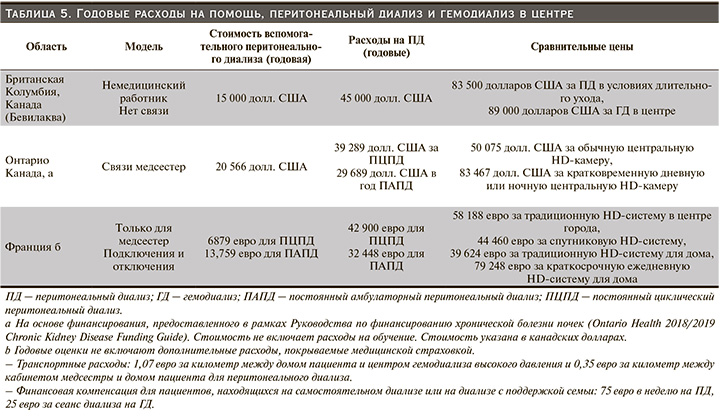
Во Франции среднегодовые расходы на одного пациента, связанные с оказанием помощи пациентам, получавшим лечение ПД, включая зарплату медсестры, транспорт и обучение, составили около 23 400 евро для ПАПД и 18 200 евро для АПД. Медсестрам платят максимум за четыре визита в день при ассистированном ПАПД и два визита в день при АПД. Кроме того, медсестрам платят за оказание помощи, не связанной напрямую с ПД, и за наблюдение за пациентом.
Во Франции и Дании эксплуатационные расходы на ассистированном ПД были равны или ниже, чем расходы на гемодиализ в стационаре [23]. Другое неопубликованное исследование из Франции показало, что помощь медсестры обходилась системе здравоохранения дешевле, чем предоставление гемодиализа в стационаре [48].
В Швеции, несмотря на государственное финансирование здравоохранения, условия ассистированного ПД различаются в разных регионах. ПД с поддержкой персонала предоставляется либо бригадами первичной медико-санитарной помощи, либо бригадами специализированной помощи на дому. Примерно 25% лиц, получающих лечение поддерживающим диализом, используют ПД, из них 8% получают поддержку семьи, а 8% получают асПД на дому или в домах престарелых. Предоставляется как краткосрочная, так и долгосрочная помощь [6].
Многие из этих моделей не учитывали экономию средств, достигаемую за счет сокращения транспортных расходов до отделения диализа и обратно, а также потенциального снижения продолжительности или сокращения количества госпитализаций и посещений отделений неотложной помощи [32]. Косвенное влияние помощи медсестер на социальные расходы, например влияние визитов медсестер на пожилых пациентов, получающих лечение диализом, в дома престарелых, не оценивалось.
Эти примеры иллюстрируют способы, посредством которых государственное финансирование эффективно поддерживает асПД. Однако во многих юрисдикциях государственной поддержки или финансирования асПД нет [49]. Это оставляет только такие варианты, как частное страхование (с переменным покрытием) или частное страхование, оплачиваемое пациентами или их семьями. Оба эти варианта, вероятно, усугубляют неравенство, ограничивая помощь в области ПД пациентам с более высоким социально-экономическим статусом.
Рекомендации
1. Системы здравоохранения должны финансировать методы асПД, чтобы все пациенты, желающие получать ПД, но нуждающиеся в посторонней помощи, могли иметь равный доступ к ПД.
2. Финансирование должно поддерживать краткосрочную и долгосрочную помощь при ПД.
3. Новые программы должны иметь план априорного анализа для оценки экономической эффективности асПД, включая косвенную экономию за счет сокращения расходов на транспортировку, госпитализаций, пребывания в домах престарелых и предотвращения осложнений. При расчете затрат следует учитывать начальные затраты, в зависимости от типа квалификации нанятого помощника, количество посещений и продолжительность поддержки.
4. Стоимость и доступность помощников могут быть ограничены в регионах путем ограничения количества посещений или ограничения количества пациентов в программе ассистируемого ПД.
Влияние на использование ПД
Нет убедительных исследований, подтверждающих, что асПД увеличивает распространенность ПД, отчасти потому, что программы ПД обычно предлагают помощь без контрольной группы или рандомизации, поэтому влияние на распространенность ПД неизвестно. Тем не менее имеются подтверждающие данные, что ассистированный ПД связан с более частым использованием перитонеального диализа и снижением перевода на гемодиализ.
Не рандомизированное, но контролируемое исследование, проведенное в Канаде, показало, что наличие помощи было связано с более высокой вероятностью того, что пациенты будут признаны подходящими для ПД многопрофильной командой [50]. 47% пациентов начали ПД, когда была доступна помощь, что было на 10% выше в контрольной группе без помощи. Недавнее исследование, проведенное в Великобритании, показало, что внедрение программы асПД было достоверно связано с более высокой частотой начала ПД (ОР: 1,78; 95% ДИ: 1,21–2,61) [31].
Во Франции Бойер и соавт. обнаружили, что количество случаев оказания помощи при перитонеальном диализе увеличилось с 2006 по 2015 г. и способствовало поддержанию числа обращений за помощью при снижении помощи со стороны семьи за тот же период [31]. Лоббедес и соавт. из Франции продемонстрировали, что асПД был связан с более низким риском перевода на гемодиализ [26]. Исследования по частоте перитонита, который является основной причиной перевода на гемодиализ, показывают различные результаты. Верже и соавт. обнаружили, что у пациентов, получавших лечение асПД, частота перитонита была выше по сравнению с ПД пациентами с поддержкой семьи, но эта разница была нивелирована регулярными визитами на дом [46]. В Квебеке (Канада), где недавно был внедрен асПД, частота перитонита была схожей между асПД и самостоятельным лечением ПД [28]. В двух исследованиях из Франции ассистируемый медсестрой ПД оказывал защитный эффект от перитонита у пациентов с диабетом и пожилых пациентов [51, 52]. Наконец, хотя использование асПД варьируется от 8% (Швеция) до 45% (Франция) от общего числа пациентов, получающих лечение ПД, можно ожидать, хотя это пока не доказано, что многие из пациентов, получающих лечение асПД, не останутся на этом методе лечения, если дополнительная помощь не будет доступна.
Следует отметить, что пациенты с асПД, как правило, старше пациентов, получающих лечение самостоятельно, поэтому ожидается, что их продолжительность лечения ПД будет меньше, что снизит влияние на распространенность ПД. В Италии, когда асПД был внедрен в 2014 г., значительного увеличения ПД не наблюдалось. Следует также признать, что асПД – это лишь одно из многих вмешательств, которые можно использовать для увеличения использования ПД, и другие системные факторы могут влиять на распределение методов диализа, которое, может быть, не преодолено с помощью асПД.
Рекомендации
1. АсПД может быть популярен, поскольку он связан с более высоким уровнем использования перитонеального диализа и снижением показателей перевода на гемодиализ.
2. Перед внедрением программы асПД в регионе необходимо предоставить данные об истории использования ПД, продолжительности его использования и распространенности. По возможности следует выделить контрольную группу, не имеющую доступа к асПД, для оценки его влияния на распространение ПД в целом.
Будущие исследования
Многочисленные исследования наблюдений описывают осуществимость, модели лечения и результаты, связанные с асПД, однако асПД представляет собой обширную область для дальнейшего изучения. Рабочая группа рекомендует следующие направления для будущих исследований:
1. Разработка стандартизированных методов оценки состояния пациентов и лиц, осуществляющих уход за больными на ПД.
2. Сравнение низкоквалифицированных и высококвалифицированных моделей ПД.
3. Описание моделей платной помощи семьям, включая результаты для пациентов и расходы.
4. Оценка влияния удаленного мониторинга на модели оказания помощи при ПД.
5. Разработка и проверка показателей качества для асПД, включая надежность визитов ассистента, ошибки лечения и частоту нежелательных явлений.
6. Оценка возможности измерения PROMS у пациентов, получающих помощь на перитонеальном диализе.
7. Сравнение PROMS между асПД и альтернативными вариантами лечения, включая гемодиализ в стационаре и консервативное лечение.
8. Измерение показателей и предикторов перехода от лечения с помощь кого-либо к самостоятельному уходу или лечению с поддержкой семьи.
9. Определение влияния ассистированного ПД на использование ПД.
10. Определение экономической эффективности программ асПД.
11. Исследования, оценивающие влияние асПД на выгорание лиц, осуществляющих уход.
12. Изучение того, меняется ли со временем влияние асПД на такие результаты, как частота случаев использования ПД, перевод на гемодиализ и распространенность использования ПД.
Краткое содержание
Финансируемый государством асПД является хорошо зарекомендовавшим себя методом домашнего диализа во многих регионах мира. Препятствия к самостоятельному лечению на перитонеальном диализе распространены среди пожилого населения и молодых пациентов с физическими или когнитивными нарушениями, поэтому асПД повышает равенство, предоставляя более широкий доступ к домашнему диализу. Методики асПД значительно различаются, и эти ключевые характеристики определяют, кто может получить помощь, связанные с ними результаты и стоимость. Программы ПД должны использовать те же показатели качества помощи, что и для общей популяции ПД, но анализ должен быть стратифицирован и скорректирован с учетом различий в структуре случаев между пациентами, самостоятельно проводящими ПД, и пациентами, получающими асПД. Государственные программы здравоохранения или частные страховые компании должны адекватно финансировать асПД для обеспечения устойчивой долгосрочной поддержки. АсПД связан с ростом перитонеального диализа и снижением числа переводов на гемодиализ. Увеличение затрат на асПД, как правило, меньше, чем на стационарный перитонеальный диализ или предоставление перитонеального диализата в рамках длительного ухода. На рисунке 1 обобщены основные положения настоящего мнения.
Методы работы рабочей группы и вклад авторов
Руководство ISPD связалось с TL и MJO с просьбой выступить в качестве сопредседателей при подготовке заявления о позиции ISPD по ассистируемому ПД. Сопредседатели составили список экспертов по ПД для присоединения к рабочей группе. Сопредседатели выбрали членов, которые должны представить международную точку зрения стран как с низким, так и с высоким уровнем дохода с учетом вклада руководства ISPD. Рабочая группа встретилась в январе 2023 г., чтобы определить ключевые разделы для заявления о позиции. Были сформированы меньшие рабочие группы для каждого раздела, включая область применения заявления о позиции (MJO и TL); обоснование (CB и EAB); финансирование (UHL, JG и PS); модели помощи; обучение и коммуникация с ассистентами (ASE, JG, EAB, NF и TK); контроль качества (CB, DWJ и PL) и влияние на использование ПД (VJ, GA и AMG). Каждая группа написала краткое изложение с основными ссылками и предоставила рекомендации, основанные на своем экспертном мнении. Разделы были составлены и отредактированы сопредседателями (MJO и TL).
Рабочая группа не проводила формальный обзор литературы.
Доступны дополнительные отличные отзывы о вспомогательном перитонеальном диализе.
Подтверждение
Никто.
Информированное согласие на публикацию
Да.
Декларация о конфликте интересов
MJO является владельцем систем DMAR; гонорары: Baxter Healthcare; медицинский контракт, работал в качестве медицинского руководителя в Ontario Renal Network, Ontario Health. GA получал консультационные гонорары от Baxter Healthcare. EAB получал гонорары за выступления и консультации от Baxter Healthcare, Fresenius Medical Care, Vifor, AWAK и liberDi; DWJ получал консультационные гонорары, исследовательские гранты, гонорары за выступления и спонсорскую поддержку поездок от Baxter Healthcare и Fresenius Medical Care, консультационные гонорары от Astra Zeneca, Bayer и AWAK, гонорары за выступления от ONO и Boehringer Ingelheim & Lilly и спонсорскую поддержку поездок от Ono и Amgen. В настоящее время он является получателем исследовательского гранта Австралийского национального совета по здравоохранению и медицинским исследованиям. AMG получал гонорары за выступления и консультации от Baxter Healthcare. VJ получал гранты на финансирование консультационных услуг и гонорары от Bayer, AstraZeneca, Boehringer Ingelheim, NephroPlus, Biocryst, Vera, Visterra, Otsuka, Chinook и Zydus Cadilla; TK получал консультационные гонорары от VISTERRA, ELEDON, Otsuka OLE и Otsuka VISIONARY в качестве исследователей в стране и в настоящее время является получателем премий Национального исследовательского совета Таиланда и Королевского колледжа врачей Таиланда, а также получал гонорары за выступления от Astra Zeneca и Baxter Healthcare. PL получал гонорары за выступления от AstraZeneca, Baxter Healthcare и Fibrogen; UHL получал предложения о выступлениях и консультировании от Baxter Healthcare и Fresnenius Medical Care. TL получал гонорары за выступления от Astellas и Baxter.
Финансирование
Автор(ы) не получали финансовой поддержки за исследование, авторство и/или публикацию данной статьи.



