В последние годы предметом детального изучения в нефрологии становятся структура и функции подоцитов, их роль в прогрессировании хронического гломерулонефрита (ХГН) [1]. Типичным изменением подоцита под действием гемодинамического и ряда других повреждающих факторов является сглаживание ножек подоцитов, сопровождающееся распластыванием цитоплазмы вдоль гломерулярной базальной мембраны (ГБМ), отрывом отдельных структурных белков подоцитов, апикальным перемещением щелевой диафрагмы, клинически проявляющееся развитием протеинурии (ПУ) [2]. При более длительном и/или сильном воздействии на подоцит наблюдается его отслоение от ГБМ и экскреция в мочевое пространство (подоцитурия) с образованием грубых дефектов фильтрационного барьера, что рассматривают как морфологическую основу нефротического синдрома (НС) [3]. В последнее время помимо широко известных подоцитарных белков (нефрина, подоцина, α-актинина и др.) важное значение в поддержании структуры ножек подоцитов в физиологических условиях и во время стресса/повреждения придают системе протеинов, названных молекулярными шаперонами, в частности одному из семейства белков теплового шока (БТШ) – БТШ-27, поддерживающему целостность актинового цитоскелета подоцитов [1]. Синтез БТШ в ответ на различные повреждающие факторы, в т. ч. воспалительные, представляется внутриклеточным защитным механизмом. Повышение экспрессии БТШ внутри клетки обеспечивает стабилизацию и восстановление поврежденных белковых молекул, поддерживает оптимальный баланс между их синтезом и деградацией, что способствует повышению резистентности клеток к стрессу.
Взаимосвязь подоцитарного повреждения с синтезом БТШ изучается в настоящее время, главным образом в эксперименте [4]; клинические работы такого направления при протеинурических формах поражения почек отсутствуют.
Цель исследования: оценить выраженность подоцитарного повреждения у больных с различными вариантами ХГН по уровню подоцитурии (ПодУ), экскреции с мочой провоспалительного цитокина интерлейкина 6 (ИЛ-6) и фактора защиты БТШ-27, определить значение этих показателей как критериев активности заболевания.
Материал и методы
Обследованы 73 больных различными формами ХГН: 35 (48 %) женщин и 38 (52 %) мужчин в возрасте от 18 до 74 лет (средний возраст – 41,6 [27;55] года). Контрольную группу составили 8 здоровых лиц, сопоставимых по полу и возрасту с обследованными пациентами. Морфологически диагноз был подтвержден у 48 больных: у 14 выявлен мезангиопролиферативный ГН (МПГН), у 5 – мезангиокапиллярный ГН (МКГН), у 10 – мембранозная нефропатия (МН), у 5 – минимальные изменения (МИ), у 5 – фокальный сегментарный гломерулосклероз (ФСГС), у 9 – нефросклероз.
Результаты исследования молекулярных медиаторов сравнивали в трех группах больных, различающихся по степени активности ХГН и почечной недостаточности (ПН).
Первую группу составили 20 пациентов с неактивным течением заболевания: 15 – с латентным ХГН, 5 – с полной ремиссией ХГН после успешной иммуносупрессивной терапии. У больных этой группы выявлено ПУ около 1 г/сут (0,76 [0,27; 1,1] г/сут), у 10 из них – изолированная, а у остальных – в сочетании с умеренной эритроцитурией. Функция почек у 13 больных была сохранна, у 7 отмечались признаки хронической почечной недостаточности (ХПН) – стойкое снижение скорости клубочковой фильтрации (СКФ) (62 [55;71] мл/мин) и повышение креатинина сыворотки крови (1,4 [1,3; 1,89] мг/дл).
Артериальная гипертензия (АГ) (от 150 и 100 до 220 и 120 мм рт. ст.) наблюдалась у 6 пациентов.
Во II группу включены 23 пациента с выраженным мочевым синдромом (МС): 18 больных, у которых ХГН изначально протекал с МС и персистировал в течение 2 [1; 7] месяцев, а также 5 больных, у которых МС был результатом неполной ремиссии НС. Клинически II группа больных ХГН характеризовалась ПУ 1–3 г/сут (2,0 [1,74;3,0] г/сут); у 11 больных выявлена изолированная ПУ субнефротического уровня, у 12 – ПУ сочеталась с умеренной эритроцитурией. Функция почек 13 больных была в пределах нормы, у 10 больных отмечено стойкое нарушение функции почек (СКФ – 44,5 [36; 76] мл/мин, креатинин – 1,72 [1,34; 2,13] мг/дл); АГ (от 150/90 до 180/100 мм рт. ст.) выявлена у 10 больных.
В III группу вошли 30 больных с НС, включая 16 пациентов с умеренным НС (ПУ – 7,51 [4,8; 9,16] г/сут) и 7 – с тяжелым НС (анасарка, гипоальбуминемия менее 20 г/л, ПУ – 11,6 [8,35; 18,6] г/сут), у 7 пациентов НС сочетался с остронефритическим синдромом (ОНС) (АГ, эритроцитурия, преходящая ПН- креатинин от 1,27 до 3,22 мг/дл (1,71 [1,35; 1,99] мг/дл). У 8 больных III группы наряду с сохраняющейся активностью ХГН ( ПУ – 7,52 [4; 12,0] г/сут) отмечено уже стойкое нарушение функции почек (СКФ – 43 [35; 67] мл/мин, креатинин – 1,8 [1,41; 2,44] мг/дл), высокая АГ (максимально до 220 и 100 мм рт. ст.)
Подоцитурия изучена методом цитофлоуметрии с помощью антител, меченных подокаликсином. Расчет осуществлялся по количеству окрашенных подокаликсином частиц (целые клетки и их обломки) в мкл осадка мочи. Уровень ИЛ-6 и БТШ-27 в моче исследовали методом непрямого иммуноферментного анализа (ELISA), исследуемые показатели экскреции были стандартизоваными по величине креатинина в утренней порции мочи. Статистический анализ данных проведен с применением стандартных статистических методик с помощью программы STATISTICA 6,0. Для сравнения двух групп использован непараметрический критерий Манна–Уитни. Корреляционный анализ проведен методом ранговой корреляции Спирмена.
Результаты
Уровни экскреции с мочой подоцитов, БТШ-26 и ИЛ-6 в группах больных активным ХГН были достоверно выше, чем у здоровых и пациентов с латентным течением заболевания (табл. 1). Все изученные мочевые показатели больных ХГН с НС (III гр.) превышали таковые пациентов с МС (II гр.).
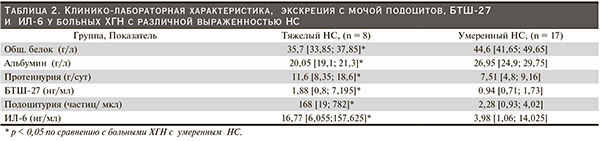
При детальном анализе показателей больных ХГН с НС было установлено, что при тяжелом НС, проявляющемся анасаркой, массивной ПУ до 18 г/сут, гипоальбуминемией ≤ 20г/л, уровни ПодУ, мочевой экскреции БТШ-27 и ИЛ-6 были достоверно выше, чем среди пациентов с умеренным НС (табл. 2).
При этом установлена прямая достоверная корреляция между уровнем БТШ-27 в моче и величиной суточной ПУ (Rs = 0,27, p < 0,05) и обратная – между мочевым показателем БТШ- 27 и альбумином сыворотки крови (Rs = -0,22, p < 0,05).
При сочетании НС с ОНС, т. е. при наиболее высокой клинической активности ХГН, экскреция с мочой ИЛ-6 достоверно превышала этот показатель пациентов с НС без ОНС (22 [10,2; 92,5] и 8,27 [1,48;16,35] нг/мл соответственно, p < 0,05). Уровень ИЛ-6 в моче больных ХГН с НС коррелировал прямо с величиной креатинина сыворотки крови (Rs = 0,53, p < 0,01) и обратно – с СКФ (Rs = -0,43, p < 0,05).
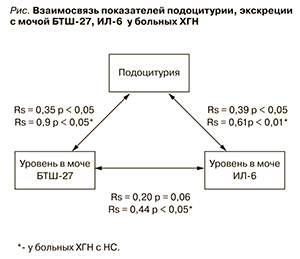 У больных активным ХГН выявлена взаимосвязь выраженности ПодУ с величиной экскреции с мочой ИЛ-6; наиболее сильной она была у пациентов III группы (см. рисунок), что указывает на развитие подоцитарного повреждения в ходе иммунного воспаления в клубочках и подчеркивает роль этих процессов в формировании НС. Нами также установлены прямые достоверные корреляции между выраженностью ПодУ и уровнем в моче БТШ-27, между мочевыми показателями БТШ-27 и ИЛ-6, особенно тесные в группе больных ХГН с НС (см. рисунок). Полученные нами данные могут отражать установленную в эксперименте реципроктную активацию защитных механизмов, направленных на ограничение структурных повреждений подоцитов и уменьшение проницаемости гломерулярного фильтра, у больных ХГН в ответ на действие воспалительных цитокинов.
У больных активным ХГН выявлена взаимосвязь выраженности ПодУ с величиной экскреции с мочой ИЛ-6; наиболее сильной она была у пациентов III группы (см. рисунок), что указывает на развитие подоцитарного повреждения в ходе иммунного воспаления в клубочках и подчеркивает роль этих процессов в формировании НС. Нами также установлены прямые достоверные корреляции между выраженностью ПодУ и уровнем в моче БТШ-27, между мочевыми показателями БТШ-27 и ИЛ-6, особенно тесные в группе больных ХГН с НС (см. рисунок). Полученные нами данные могут отражать установленную в эксперименте реципроктную активацию защитных механизмов, направленных на ограничение структурных повреждений подоцитов и уменьшение проницаемости гломерулярного фильтра, у больных ХГН в ответ на действие воспалительных цитокинов.
У пациентов с еще сохраняющимся НС и уже формирующейся ХПН отмечено достоверное снижение уровня БТШ-27 в моче по сравнению с больными ХГН с НС и сохранной функцией почек (0,75 [0,66; 1,32] и 1,1 [0,73;1,82] соответсвенно, p < 0,05), что свидетельствует об ослаблении механизмов самозащиты подоцитов от прогрессирующих структурных нарушений у данной категории больных.
Мы не выявили зависимости уровня экскреции исследуемых медиаторов с мочой от конкретных морфологических форм ХГН, а также в группах больных с непролиферативными и пролиферативными формами ХГН. Однако максимальные индивидуальные показатели подоцитурии в нашем исследовании зафиксированы в отношении больных с МИ (1200 частиц в мкл) и ФСГС (296,7 частицы в мкл), а уровни БТШ-27 и ИЛ-6 в моче были наиболее высокими при ФСГС (22,4 и 331 нг/мл соответственно) и МН (15,37 и 257 нг/мл соответственно), т. е. при «первичных подоцитопатиях», которые клинически проявлялись тяжелым НС.
Обсуждение
Благодаря экспериментальным исследованиям последних лет было показано, что повреждение подоцитов различными факторами, в т. ч. воспалительными при ХГН (воздействие антител, иммунных комплексов, мембранно-атакующего комплекса, провоспалительных цитокинов и др.), тесно связано с изменением цитоскелета (F-актина) и структурных белков подоцитов, что приводит к их отщеплению от ГБМ и развитию подоцитурии. Структура ножек подоцитов – неотъемлемой части фильтрационного барьера почки – напрямую зависит от состояния актиновых микрофиламентов и процессов их полимеризации/деполимеризации, в регуляции которых участвует БТШ-27 [4]. В подоцитах БТШ-27 находится в виде больших и малых олигомеров. Большие олигомеры выполняют функцию шаперонов, в компетенции которых находятся временное связывание и облегчение скручивания незрелых пептидов в процессе трансляции, облегчение транспорта белков вдоль мембран органелл, контроль биологической активности регуляторных белков (включая транскрипционные факторы), предотвращение агрегации частично денатурированных белков вследствие межмолекулярных взаимодействий, облегчение деградации токсических метаболитов белков путем транспорта денатурированных белков к протеосомам и лизосомам. Меньшие олигомеры БТШ-27 объединяются в подоцитах с актиновыми микрофиламентами и способствуют стабилизации актиновых волокон в условиях стресса (особенно под влиянием реактивных радикалов кислорода и провоспалительных цитокинов) [5, 6]. При этом наивысшей защитной активностью обладают нефосфорилированные олигомеры БТШ-27. Фосфорилирование БТШ-27 с помощью р38-МАР-киназы влечет потерю связи с актиновыми микрофиламентами, ремоделирование актиновой сети, агрегацию и перераспределение микроволокон в клетке и разрушение цитоскелета. Так, в эксперименте при PAN-нефрозе (модели нефрита с минимальными изменениями и ФСГС) показано, что сглаживание ножек подоцитов и развитие НС тесно связаны с повышенной экспрессией именно фосфорилированных изоформ БТШ-27, с утратой защитных свойств этого протеина [6].
Изучая структуру и функцию БТШ в культуре клеток и в эксперименте на животных, W.E. Smoyer и P. Mundel предположили два варианта развития патофизиологических реакций в процессе повреждения подоцитов [1].
Во-первых, повреждающий фактор может вмешиваться в регуляцию фосфорилирования БТШ-27 в клетке, что приводит к нарушению полимеризации актина, и следовательно, к распластыванию отростков подоцитов и развитию протеинурии. Существует и другая точка зрения, согласно которой любой патофизиологический стимул (токсический, иммунологический и др.) может непосредственно воздействовать на структурные белки ножек подоцита с нарушением их функции, вторично приводя к повышению экспрессии в подоцитах БТШ-27, его перемещению из тела клетки в богатые актиновыми филаментами отростки, активации процессов его фосфорилирования, что можно расценивать как неспецифический ответ подоцита на воздействие любого стрессорного фактора. При этом авторы более вероятным считают второй механизм.
В проведенном нами исследовании экскреция подоцитов с мочой больных активным ХГН была достоверно выше, чем при латентном течении заболевания. Показатели подоцитурии были наиболее высокими среди больных с НС, отражая выраженность нарушений фильтрационного барьера. Уровень защитного БТШ-27 в моче, так же как и подоцитурия, был выше у пациентов с НС, особенно при его тяжелом течении с выраженной ПУ и гипоальбуминемией. Мы установили прямые корреляции этого показателя с выраженностью подоцитурии и ПУ, что, с одной стороны, указывает на локально-почечное (при подоцитарном повреждении) происхождение БТШ-27, выявленного в моче больных ХГН, с другой стороны, с учетом функции этого белка в клетке подтверждает установленный в эксперименте факт активации механизмов самозащиты подоцитов в процессе их повреждения.
У больных активным ХГН мы выявили взаимосвязь выраженности подоцитурии с величиной экскреции с мочой ИЛ-6: наиболее сильной она была у пациентов с НС и сочетанием НС и ОНС. Наши данные согласуются с результатами проведенных ранее экспериментальных работ, продемонстрировавших роль провоспалительных медиаторов, продуцируемых клетками клубочка, в т. ч. ИЛ-6 и ФНО-α, в развитии подоцитарного повреждения при протеинурических формах ХГН [7]. Повышение ИЛ-6 в моче обнаружено и другими исследователями у пациентов с различными морфологическими формами ХГН: МПГН, ФСГС, волчаночном нефрите, васкулите и др. [ 8]. При этом уровень ИЛ-6 в моче прямо не коррелировал с уровнем ИЛ-6 в сыворотке крови, свидетельствуя о локально-почечном происхождении данного цитокина. В работе Horii и соавт. было показано, что постоянно высокий ИЛ-6 в моче выявлялся у больных с морфологическими признаками прогрессирования ГН [9].
Основной источник ИЛ-6 в почке в настоящее время остается предметом изучения. Показана секреция ИЛ-6 мезангиоцитами в ответ на воздействие факторов воспаления, что в свою очередь может стимулировать дальнейшую пролиферацию мезангиальных клеток. ИЛ-6 может также синтезироваться макрофагами, лимфоцитами и эндотелиальными клетками [8]. Однако часто в биоптатах почек пациентов с выраженной экскрецией ИЛ-6 в моче не находят мононуклеарных и лимфоцитарных инфильтратов, что предполагает наличие и другого источника этого интерлейкина [10]. Полагают, что таким источником ИЛ-6 могут быть подоциты. Так, в работе Lai и соавт. на культуре клеток in vitro было показано, что подоциты имеют рецепторы к основным провоспалительным цитокинам и при активации сами могут продуцировать ИЛ-6 и ФНО-α, которые воздействуют на гломерулярные и тубулярные структуры почки, способствуют развитию в них воспалительных и фиброзных изменений [7].
В нашем исследовании установлены прямые достоверные корреляции между уровнем в моче ИЛ-6, подоцитурией и показателем мочевой экскреции БТШ-27, особенно тесные в группе больных ХГН с НС. Полученные нами данные могут отражать установленную в эксперименте реципроктную активацию защитных механизмов, направленных на ограничение структурных повреждений подоцитов и уменьшение проницаемости гломерулярного фильтра у больных ХГН в ответ на действие воспалительных цитокинов.
Эффективность работы системы защитных белков зависит от силы и длительности действия повреждающего фактора, скоординированности сресс-реализующих и стресс-лимитирующих клеточных реакций, совершенства механизмов рецепции и путей внутриклеточной передачи информации, а также адекватности энергетических ресурсов клетки [11].
К сожалению, способности БТШ защищать клетки, в частности подоциты, от стресса/повреждения не безграничны. При исчерпании резервных возможностей этой системы и ее дисрегуляции продолжающееся воздействие патологических (а в ряде случаев и физиологических) стимулов вызывает серьезные структурные нарушениям подоцитов, интенсивную подоцитурию и развитие подоцитопении. Поскольку подоциты являются высокодифференцированными клетками с ограниченным пролиферативным потенциалом, уменьшение числа подоцитов в клубочке приводит к необратимому дефекту гломерулярного фильтра, способствует формированию синехий между капиллярными петлями и Боуменовой капсулой, является пусковым механизмом для развития гломерулосклероза [12, 13]. В нашем исследовании при прогрессирующем течении заболевания (у пациентов с еще сохраняющимся НС и уже формирующейся ХПН) уровень БТШ-27 в моче снижался по сравнению с больными с НС и сохранной функцией почек. По нашему мнению, полученные данные отражают дезадаптивные изменениях в почках данного контингента больных с ослаблением механизмов, противостоящих повреждению и ограничивающих структурные нарушения подоцитов.
Таким образом, у пациентов с активным ХГН выявляется высокая подоцитурия, коррелирующая с уровнем ПУ, тяжестью НС и величиной экскреции с мочой ИЛ-6, что отражает выраженность функционального дефекта гломерулярного барьера, подчеркивает роль иммунного воспаления и связанного с ним подоцитарного повреждения в формировании НС при ХГН. Увеличение экскреции БТШ-27 с мочой больных ХГН является механизмом самозащиты почек, направленным на ограничение структурных и функциональных нарушений подоцитов, предупреждающих рост ПУ. Прогностически неблагоприятными признаками, указывающими на нарушение механизмов клеточной адаптации к повреждению и риск развития гломерулосклерза, являются интенсивная подоцитурия и снижение исходно высокого показателя экскреции с мочой защитного БТШ-27. Неинвазивное мониторирование подоцитарного повреждения с помощью мочевых тестов важно с клинических позиций для определения активности болезни, оценки прогноза ХГН и выбора тактики лечения.