Введение
Среди механизмов, определяющих течение и исход заболеваний почек, в настоящее время наиболее изучены повреждающие звенья патогенеза. Однако в экспериментальных работах было показано, что течение патологического процесса в почке независимо от его этиологии определяется балансом локально воздействующих повреждающих факторов и противостоящих им механизмов самозащиты, среди которых особое место занимают белки теплового шока (БТШ) [1–3].
Благодаря достижениям современной молекулярной биологии и инновационным клеточным технологиям установлены фундаментальные защитные функции БТШ, которые заключаются в поддержании нормальной структуры белков в клетке [4].
Роль БТШ в механизмах, ограничивающих повреждение почечной ткани, а также иммунорегуляторная функция этих белков при хроническом гломерулонефрите (ХГН) изучены недостаточно. Данное направление исследований представлено главным образом экспериментальными и единичными клиническими работами по оценке экспрессии отдельных БТШ в различных структурах почки [5–7].
Вместе с тем изучение БТШ, способных модулировать процессы повреждения, приобретает особый интерес для понимания основных закономерностей прогрессирования ХГН и представляется перспективным для разработки новых методов торможения нефросклероза.
В связи с этим целью нашего исследования было оценить состояние системы «самозащиты» почки у больных ХГН по уровню в моче, крови и экспрессии в почке основных защитных БТШ, уточнить значение изменений этих факторов в оценке активности и прогноза ХГН.
Материал и методы
Обследованы 75 больных активными формами ХГН: 31 женщина и 44 мужчины в возрасте от 16 до 67 лет (в среднем 35,5 [27; 51] года), наблюдавшихся в клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева УКБ № 3 ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» с 2011 по 2013 г.
В I группу были включены 34 пациента с выраженным мочевым синдромом (МС), в т.ч. 23 больных, у которых ХГН изначально протекал с МС и персистировал в течение 7 [2; 12] месяцев, и 11 пациентов, у которых МС был результатом неполной ремиссии нефротического синдрома (НС). Клинически эта группа характеризовалась протеинурией от 1,0 до 3,5 г/сут (2,4 [1,24; 3,5] г/сут); у 13 больных выявлена изолированная протеинурия субнефротического уровня, у 17 – протеинурия сочеталась с умеренной, а у 4 – с выраженной эритроцитурией (более 50 в поле зрения).
У 7 больных I группы наряду с протеинурией выявлено преходящее нарушение функции почек (креатинин – от 1,26 до 2,97 мг/дл, в среднем 1,35 [1,27; 1,71] мг/дл, скорость клубочковой фильтрации – 53,5 [49; 67]) как проявление высокой активности нефрита. У 3 пациентов, несмотря на прием антигипертензивных препаратов, выявлена умеренная (АД 160–170/100 мм рт. ст.), у 2 – высокая артериальная гипертензия (АД до 190/120 мм рт. ст.). Длительность нефрита в этой группе составила в среднем 45 [9,5; 96] месяцев.
Во II группу вошел 41 больной ХГН с НС. По степени тяжести НС были выделены: подгруппа IIА – 31 пациент с умеренным НС (протеинурия 6,4 [4,8; 10] г/сут, альбумин сыворотки 27,7 [24,8; 30] г/л, общий белок сыворотки 46,6 [43,2; 49,7]); подгруппа IIБ – 10 больных с выраженным НС (анасарка, протеинурия 11,32 [7,52; 18] г/сут, гипоальбуминемия менее 20 г/л, в среднем – 19 [17,7; 19,9] г/л, общий белок сыворотки 34,45 [33,6–38,7] г/л).

У 15 больных II группы НС сочетался с гематурией (от 10–15 до сплошь в поле зрения). Артериальная гипертензия отмечена у 9 пациентов: у 6 – умеренная (АД 160–170/100 мм рт. ст.), у 3 – высокая (АД до 180/110 мм рт. ст.).
У 14 больных II группы наряду с НС выявлено преходящее нарушение функции почек (креатинин 1,55 [1,39; 1,99] мг/дл, скорость клубочковой фильтрации – 53 [42; 71]) как проявление высокой активности нефрита, у 6 из них также отмечена выраженная гематурия и артериальная гипертензия, которые расценивались в рамках остронефритического синдрома. Длительность нефрита во II группе составила в среднем 11,5 [4; 42,5] месяцев, длительность НС к моменту обследования – 4,0 [2; 7] месяца.
В отношении 72 больных диагноз ХГН был подтвержден морфологически: у 29 выявлен мезангиопролиферативный нефрит, у 13 – мезангиокапиллярный нефрит, у 13 – мембранозный нефрит (МН), у 7 – фокально-сегментарный гломерулосклероз (ФСГС), у 4 – болезнь минимальных изменений (БМИ), у 6 – нефросклероз в исходе ХГН.
Группы сравнения были представлены 10 пациентами с неактивным ХГН (протеинурия менее 0,5 г/сут – в среднем 0,23 [0,18; 0,3] г/сут, у двух больных микрогематурия до 15–20 в поле зрения, артериальная гипертензия отсутствовала или была умеренной, поддавалась коррекции антигипертензивными препаратами); а также 10 здоровыми лицами, сопоставимыми по полу и возрасту.
Наряду с общеклиническим обследованием нами были изучены:
В моче (методом ЕLISA):
- уровни БТШ-27 и -70 – защитных белков-шаперонов клеточного происхождения;
- уровень провоспалительного интерлейкина-6 (ИЛ-6);
- уровень противовоспалительного ИЛ-10.
В сыворотке крови (методом ЕLISA):
- уровень антител (АТ) к БТШ-70 как отражение внеклеточных эффектов БТШ (показатель иммунорегуляторной функции этих белков).
В ткани почки (иммуногистохимическим пероксидазным методом):
- экспрессия БТШ-70 в различных структурах;
- экспрессия FoxP3 – фактора транскрипции регуляторных Т-лимфоцитов (CD4+CD25+), секретирующих противовоспалительный ИЛ-10.
Результаты иммуногистохимического исследования изучаемых медиаторов оценивали полуколичественным методом: (–) экспрессия отсутствует; (+) очаги слабой экспрессии; (++) множественные очаги умеренной экспрессии; (+++) множественные очаги выраженной экспрессии.
C помощью морфометрического подсчета FoxP3-положительных ядер было оценено число противовоспалительных клеток в ткани почки.
Для иммуногистохимического исследования использовали материал парафиновых срезов биопсий почек 39 больных ХГН (пациенты отобраны на основании наличия достаточного количества материала в парафиновых блоках).
Статистический анализ данных проводили с применением стандартных статистических методик с помощью программы STATISTICA 6,0. Для сравнения двух групп использовали непараметрический критерий Манна–Уитни. Корреляционный анализ проведен методом ранговой корреляции Спирмена. Достоверность различий частот в двух группах оценена по χ2 с поправкой Йетса. Для оценки прогностического значения показателей применен метод Каплан–Майер, достоверность различий определена по лог-ранговому критерию.
Результаты
У больных ХГН нами выявлены изменения экскреции с мочой БТШ-27 и -70, характер которых зависел от клинических особенностей заболевания (см. таблицу). Так, у пациентов с МС (I гр.) эти показатели имели тенденцию к увеличению по сравнению с контрольными группами. Наиболее высокие индивидуальные значения были у трех больных с яркими признаками активности ХГН – протеинурией субнефротического уровня, выраженной эритроцитурией и преходящим нарушением функции почек.
 У пациентов с НС (II гр.) увеличение уровней БТШ-27 и -70 в моче было статистически значимым по сравнению со здоровыми лицами, больными неактивным ХГН, и пациентами с МС. При выраженном НС (IIБ гр.) уровни БТШ-27 и -70 в моче были достоверно выше, чем при умеренном НС (IIА гр.).
У пациентов с НС (II гр.) увеличение уровней БТШ-27 и -70 в моче было статистически значимым по сравнению со здоровыми лицами, больными неактивным ХГН, и пациентами с МС. При выраженном НС (IIБ гр.) уровни БТШ-27 и -70 в моче были достоверно выше, чем при умеренном НС (IIА гр.).
У больных ХГН с НС показатели экскреции БТШ-27 и -70 прямо коррелировали с величиной суточной протеинурии (Rs=0,40 p<0,05 и Rs=0,34 p<0,05 соответственно) и обратно с уровнем альбумина сыворотки крови (Rs=-0,36; p<0,05 и Rs=-0,31; p<0,05 соответственно).
Мы не выявили зависимости уровня мочевой экскреции исследуемых БТШ от морфологических типов ХГН, а также различий по данным показателям в группах больных непролиферативными и пролиферативными формами ХГН. Максимальные индивидуальные уровни БТШ-27 в моче отмечались при ФСГС и МН (22,4 и 15,37 нг/мл соответственно), а БТШ-70 – при БМИ (0,699 нг/мл), ФСГС (1,628 нг/мл) и МН (2,588 нг/мл). Именно у этих больных клиническая картина ХГН характеризовалась выраженным НС, у части пациентов – в сочетании с преходящим нарушением функции почек.
Для подтверждения локально-почечного происхождения БТШ, экскретируемых с мочой, мы исследовали экспрессию БТШ-70 в ткани почки больных ХГН. У всех больных активным ХГН с выявленной мочевой экскрецией БТШ-70 этот белок был обнаружен и в ткани почки. Он выявлен в клубочках (главным образом в подоцитах, в меньшей степени – в париетальных клетках капсулы Шумлянского–Боумена), а также в тубулоинтерстиции (в эпителиальных клетках канальцев, строме, клетках лимфогистиоцитарного инфильтрата, миофибробластах).
При всех активных протеинурических формах ХГН независимо от его морфологического варианта преобладала тубулоинтерстициальная локализация БТШ-70. Умеренная (++) и выраженная (+++) экспрессии БТШ-70 в тубулоинтерстиции отмечены у 80% больных НС и лишь у 30% пациентов с МС. В клубочках почек обследованных ХГН с МС и НС выявлена преимущественно слабая (+) (у 85 и 70%) и умеренная (++) (у 15 и 25%) экспрессии БТШ-70. Интенсивность тубулоинтерстициальной экспрессии БТШ-70 прямо коррелировала с показателем его мочевой экскреции (Rs=0,731; p<0,01), отражая индукцию синтеза БТШ в этих структурах почки в процессе повреждения.
У пациентов с НС наиболее выраженная окраска БТШ-70 выявлена в эпителиальных клетках канальцев и прямо коррелировала со степенью протеинурии (Rs=0,362; p<0,05), что, как мы полагаем, может отражать индукцию синтеза БТШ в канальцах в ответ на повреждение не только иммунными факторами, но и компонентами протеинурии.
Для оценки внеклеточных иммунорегуляторных эффектов БТШ-70 мы изучили уровень циркулирующих АТ к БТШ-70 в сыворотке крови и оценили баланс ИЛ-6 и ИЛ-10 в моче.
Сывороточный уровень АТ к БТШ-70 у больных активным ХГН (как с МС, так и с НС) был значимо выше, чем у пациентов с латентным течением заболевания (рис. 1). В то же время в общей группе пациентов с НС величина данного показателя была несколько ниже, чем при МС, и обратно коррелировала с уровнем протеинурии (Rs=-0,439; p<0,05). Более сильная связь отмечена в группе больных выраженным НС (Rs= -0,974; p<0,05).
При высокоактивном течении заболевания, клинически характеризующимся сочетанием тяжелого НС с преходящим нарушением функции почек, снижение уровня АТ к БТШ-70 было более выраженным, чем при умеренном НС с сохранной функцией почек (20,3 [15,3; 24,3] × 106 нг/мл и 25,6 [18,7; 31,9] × 106 нг/мл соответственно; p<0,05).
Нами установлено, что при нарастании активности ХГН от МС к НС и по мере усугубления степени выраженности НС наблюдается увеличение в моче уровня провоспалительного ИЛ-6 и снижение содержания противовоспалительного ИЛ-10 (рис. 2).
Величина экскреции ИЛ-6 прямо коррелировала с выраженностью протеинурии (Rs=0,378; p=0,01), уровнем креатинина сыворотки крови (для больных с НС Rs=0,53; p<0,01) и длительностью сохраняющейся активности ХГН (Rs=0,344; p<0,01).
По нашему мнению, такой дисбаланс ИЛ-6/ИЛ-10 и снижение уровня АТ к БТШ подчеркивают значение нарушений иммунорегуляторных эффектов БТШ и недостаточности противовоспалительной защиты почки в целом при высокоактивных формах нефрита.
На это указывают и результаты проведенного нами морфометрического исследования. Мы оценили в инфильтратах количество регуляторных Т-лимфоцитов (FoxP3+), секретирующих ИЛ-10. У больных ХГН с НС по сравнению с пациентами с МС отмечено достоверное снижение в ткани почек числа FoxP3+-клеток (2 [0,44; 4] и 8,5 [3; 16] в поле зрения соответственно; р<0,05), и именно в этой группе пациентов мы выявили резкое снижение уровней ИЛ-10 в моче и АТ к БТШ-70 в сыворотке крови (рис. 1, 2).
Полагая, что неэффективная регуляция хронического иммунного воспаления у больных ХГН, в т.ч. с участием БТШ, может способствовать персистированию и дальнейшей хронизации болезни, и, напротив, при состоятельности этой системы можно прогнозировать более благоприятное течение нефрита, мы проанализировали характер течения заболевания и ответ на иммуносупрессивную терапию 37 больных активным ХГН в зависимости от исходной величины АТ к БТШ-70.
Достижение ремиссии ХГН в течение ближайших месяцев иммуносупрессивной терапии наблюдалось у больных с высоким (выше 21 пг/мл) исходным уровнем антител к БТШ-70 в сыворотке крови. Так, у 13 из 16 (80%) пациентов с высоким уровнем антител ответ на лечение был получен в течение 12 месяцев, у 8 (50%) – в течение ближайших 5 месяцев. Напротив, у 12 из 21 (57%) пациентов с титрами антител ниже 21 пг/мл НС персистировал, несмотря на проведенное более года лечение, рекомендованное для данных форм заболевания.
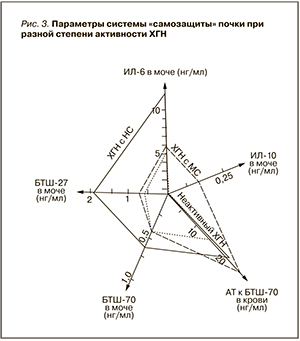
Комплексный анализ изменений изученных нами мочевых и сывороточных тестов на разных этапах течения ХГН показал, что по мере нарастания активности формируется дисбаланс повреждающих и защитных факторов с преобладанием воспалительных реакций (рис. 3).
Об активности воспалительной реакции в ткани почки и выраженности клеточного повреждения у больных ХГН свидетельствует снижение уровня АТ к БТШ-70 в сыворотке крови и ИЛ-10 в моче при повышении экскреции БТШ-27, -70 и ИЛ-6 с мочой. Прогрессирующий характер этих нарушений служит неблагоприятным прогностическим признаком, указывающим на риск хронизации болезни и худшего ответа на лечение.
Обсуждение
В настоящее время фундаментальными исследованиями подтверждена важная роль БТШ в восстановлении клеток, поврежденных под действием медиаторов воспаления, оксидативного стресса, различных токсинов, неблагоприятных факторов внешней среды и др. [4]. Эти защитные свойства БТШ связаны с их универсальными клеточными функциями: как белки-шапероны они участвуют в образовании вторичной и третичной структуры протеинов, репарации поврежденных и элиминации денатурированных белков [4, 8, 9].
 Среди белков теплового шока при ХГН особый интерес представляют БТШ-27, регулирующий структуру и функцию актин-содержащих клеток почки (подоцитов и тубулярных клеток), а также БТШ-70, который, как полагают, помимо внутриклеточной защиты участвует в регуляции иммунного воспалительного ответа [ 3].
Среди белков теплового шока при ХГН особый интерес представляют БТШ-27, регулирующий структуру и функцию актин-содержащих клеток почки (подоцитов и тубулярных клеток), а также БТШ-70, который, как полагают, помимо внутриклеточной защиты участвует в регуляции иммунного воспалительного ответа [ 3].
По нашим данным, экскреция БТШ-27 и -70 с мочой увеличивалась по мере нарастания активности ХГН, достигая наиболее высоких значений у больных НС, особенно при его тяжелом течении. Установлены прямые корреляции мочевых показателей БТШ-27 и -70 с клинической активностью нефрита, в первую очередь с выраженностью протеинурии и почечной дисфункции, что отражает активацию механизмов внутриклеточной защиты в ответ на действие повреждающих факторов. В связи с этим повышенный уровень БТШ в моче можно рассматривать не только как показатель индукции синтеза этих защитных белков в различных клетках ткани почки, но и как косвенный маркер клеточного повреждения.
Наиболее тесная связь с тяжестью НС была отмечена для БТШ-27, что находит объяснение в свете современных представлений об участии этого белка в поддержании цитоскелета подоцитов, в частности в регулировании формы его ножек – ключевого звена развития нефротической протеинурии. Установлено, что защитными свойствами обладают нефосфорилированные олигомеры БТШ-27. В процессе клеточного повреждения происходит их фосфорилирование с помощью р38 МАР-киназы, что влечет за собой потерю связи БТШ-27 с актиновыми микрофиламентами и ремоделирование актиновой сети в клетке [10, 11]. В результате этих процессов наблюдается слияние ножек подоцитов с развитием протеинурии, поврежденные подоциты слущиваются в мочевое пространство (подоцитурия), а БТШ начинают интенсивно выделяться из поврежденных клеток в мочу [12, 13]. Важную роль БТШ-27 играют в поддержании цитоскелета и других актин-содержащих клеток почек – канальцевых эпителиоцитов. Ослабление защитных свойств БТШ-27 в поврежденных эпителиальных клетках приводит к нарушению их каркаса, полярности, межклеточных контактов и связи с тубулярной базальной мембраной с последующим слущиванием эпителиоцитов в просвет канальца и формированием в местах оголения мембраны очагов тубулоинтерстициального фиброза.
В семейство БТШ-70 входят конституциональный белок БТШ-73 кДа и индуцибельный белок БТШ-72 кДА. В эксперименте установлено, что БТШ-73 в норме экспрессируется преимущественно клетками дистальных канальцев, в меньшей степени – проксимальных, а БТШ-72 – вдоль кортикопапиллярных областей [5]. При патологических состояниях экспрессия БТШ-73 и -72 локализуется преимущественно в области повреждающего воздействия. Так, при экспериментальном PAN-нефрозе внутриклеточная экспрессия БТШ-73 обнаруживалась в подоцитах, являющихся мишенью повреждений при данной форме нефрита, а также в тубулярных клетках, отражая их защитную реакцию на токсическое действие нефротической протеинурии [5]. При экспериментальном остром повреждении почек ишемической и токсической природы усиленная экспрессия БТШ-73 и -72 выявлена в проксимальных тубулярных клетках [14–16]. T. Mueller и соавт. изучили экскрецию БТШ-72 с мочой больных после пересадки почки. Резкое повышение экскреции БТШ-72 отмечено в первые часы после операции, что отражает процесс нарушения целостности тубулярного эпителия и может указывать на степень почечного повреждения [17].
В настоящее время имеются лишь единичные работы, посвященные изучению экспрессии БТШ-70 в ткани почки больных различными формами ХГН. Выявлена депозиция БТШ-70 в подоцитах, тубулярных клетках дистальных канальцев и собирательных трубочек, в очагах интерстициальной инфильтрации [7, 18].
В нашем исследовании экспрессия БТШ-70 обнаружена у всех больных ХГН с выявленной мочевой экскрецией этого белка. В целом изменения тканевых и мочевых показателей БТШ-70 у больных ХГН были однотипны: отмечена интенсивная экспрессия этого фактора в почке и усиленная его экскреция с мочой при активных формах ХГН, главным образом при НС. Полученные нами данные подтверждают локально-почечное происхождение БТШ-70, выявляемого в моче, и указывают на возможность использования мочевых показателей БТШ для оценки механизмов защиты в почке и выраженности повреждения.
Экспрессия БТШ-70 выявлена нами у больных ХГН в разных структурах ткани почки, но преимущественно в тубулоинтерстиции, что согласуется с результатами исследований других авторов. Интенсивность тубулоинтерстициальной экспрессии БТШ-70 коррелировала с уровнем экскреции БТШ-70 с мочой. Наиболее выраженная окраска на БТШ-70 у больных НС выявлена в эпителиальных клетках канальцев, прямо коррелируя с выраженностью протеинурии. В свете современных представлений о механизмах нефротоксичности протеинурии это можно расценивать как защитную реакцию тубулярных клеток в ответ на повреждение не только иммунными факторами, но и компонентами протеинурии.
За последние годы помимо внутриклеточной защитной функции БТШ-70 в литературе обсуждается их особая протективная роль, которая заключается в контроле хронического иммунного воспаления [19, 20]. Полагают, что внеклеточные эпитопы БТШ, экспрессируемые в очаге воспаления, распознаются Т-лимфоцитами с формированием регуляторных клонов реактивных Т-клеток CD4+CD25+ (FoxP3+), которые обеспечивают противовоспалительный эффект за счет как прямой элиминации цитотоксических Т-клеток, так и гуморального звена – секреции противовоспалительных цитокинов, в первую очередь ИЛ-10 [ 21]. Есть основания полагать, что неэффективная иммунорегуляция противовоспалительного ответа с участием БТШ-70 может способствовать хронизации воспаления. Так, L. Marzec и соавт. показали, что снижение степени экспрессии БТШ-72 на поверхности моноцитов периферической крови пациентов с рядом хронических заболеваний почек, а также больных терминальной почечной недостаточностью сочетается с развитием системного воспаления [22].
Мы оценили взаимосвязь уровня защитных БТШ в моче с показателями мочевой экскреции противовоспалительного цитокина ИЛ-10 и провоспалительного ИЛ-6. По мере нарастания активности нефрита и развития его прогрессирующих форм мы наблюдали увеличение экскреции с мочой БТШ-27 и -70, коррелирующее с уровнем ИЛ-6 в моче как показатель активности иммунного воспаления в почке, в то время как уровень ИЛ-10, наоборот, прогрессивно снижался до следовых показателей. Полученные нами данные свидетельствуют о развитии у больных с выраженным иммунным воспалением в почке дисбаланса повреждающих и защитных механизмов с ослаблением противовоспалительного компонента.
Для оценки иммунорегуляторной функции БТШ мы также изучили содержание в сыворотке крови циркулирующих АТ к БТШ-70. Их уровень у больных активным ХГН (как с МЧ, так и с НС) был значимо выше, чем у пациентов с латентным течением заболевания. Вместе с тем при высокоактивном течении ХГН, характеризующемся сочетанием тяжелого НС с преходящим нарушением функции почек, мы выявили достоверное снижение уровня АТ к БТШ-70 в сыворотке.
Патогенетическое значение и прогностическая роль АТ к БТШ-70 при иммунной патологии изучены пока еще недостаточно. Имеется ряд исследований, демонстрирующих увеличение титра АТ к БТШ, в т.ч. к БТШ-70, при актиновых микрофиламентах и аутоиммунных заболеваниях (системной красной волчанке, ревматоидном артрите, васкулитах, дерматомиозите и др.) [23]. Н.А. Мухин и соавт. показали увеличение уровня АТ к БТШ-70 в сыворотке крови больных ХГН и амилоидозом с НС [24].
В нескольких исследованиях подтверждено значение уровня АТ к БТШ-70 в сыворотке крови как предикторов неблагоприятного прогноза для больных сердечно-сосудистыми заболеваниями и атеросклерозом. Так X. Zhanq и соавт. показали, что высокое содержание БТШ-70 в сыворотке крови в сочетании с низким титром АТ к БТШ-70 ассоциировано с высоким риском прогрессирования атеросклероза и сердечно-сосудистых осложнений в популяции [25]. По данным E. Dulin и соавт., снижение уровня циркулирующих АТ к БТШ имеет неблагоприятное прогностическое значение при ишемической болезни сердца [26].
В нашем исследовании снижение уровня АТ к БТШ-70 в сыворотке крови пациентов с тяжелым течением ХГН коррелировало с уменьшением количества Т-регуляторных FoxP3+-клеток в ткани почки и низким уровнем ИЛ-10 в моче. В этом случае заболевание характеризовалось торпидным течением, несмотря на длительное лечение различными иммуносупрессивными препаратами. Снижение уровня АТ к БТШ-70 у этой группы пациентов может косвенно отражать недостаточность иммунорегуляторных эффектов БТШ-70 со снижением количества БТШ-специфичных Т-регуляторных клеток и общей противовоспалительной активности.
Комплексный анализ изменений всех изученных мочевых и сывороточных тестов на разных этапах течения ХГН показал, что при нарастании активности заболевания (прежде всего увеличении протеинурии) в ответ на активацию факторов повреждения (увеличение уровня в моче воспалительного ИЛ-6) наблюдаются адаптивные изменения в системе самозащиты почки – усиленная экскреция с мочой БТШ- 27 и -70, рост уровня в моче противовоспалительного ИЛ-10, а в сыворотке крови – АТ к БТШ-70 (как отражение активации внутри- и внеклеточных защитных эффектов БТШ). При прогрессирующем течении ХГН (развитии НС, усугублении степени его тяжести, особенно в сочетании с нарушением функции почек) баланс повреждающих и защитных механизмов нарушается: при продолжающемся росте уровня ИЛ-6 в моче и увеличении экскреции с мочой БТШ-27 и -70 наблюдается резкое снижение уровня ИЛ-10 в моче (вплоть до неопределяемых значений) и уменьшение количества АТ к БТШ-70 в сыворотке крови, что отражает ослабление иммунорегуляторных и противовоспалительных эффектов БТШ. Такой спектр биомаркеров указывает на риск дальнейшего прогрессирования воспалительных изменений в почке и худшего ответа на лечение.
Заключение
Таким образом, в результате проведенного исследования подтверждена возможность оценки механизмов «самозащиты» почки с помощью изучения одного из ее звеньев – белков теплового шока. Тесные корреляции изученных мочевых и сывороточных показателей БТШ с клиническими и морфологическими признаками активности ХГН позволяют использовать эти биомаркеры для мониторирования процессов повреждения в почке и прогнозировать течение ХГН, что важно для определения тактики лечения больных на каждом этапе течения заболевания.



