Поражение сердечно-сосудистой системы при хронической болезни почек (ХБП) представляет собой серьезную медико-социальную проблему, поскольку многие больные уже в трудоспособном возрасте становятся инвалидами или погибают от сердечно-сосудистых заболеваний (ССЗ) и их осложнений уже на додиализной стадии ХБП. К настоящему времени накоплены данные о том, что помимо установленных традиционных (пол, возраст, артериальная гипертензия, избыточная масса тела, дислипидемия, курение и т.п.) и т.н. почечных факторов риска (снижение функции почек, нарушения фосфорно-кальциевого обмена, анемия) в развитие ССЗ определенный вклад вносят генетические факторы. В связи с этим наибольшее внимание исследователей привлекают гены, кодирующие компоненты ренин-ангиотензин-альдостероновой системы (РААС), патологическая активация которой в ответ на самые различные стимулы запускает процессы, приводящие к возникновению эндотелиальной дисфункции, нарушению системной и внутрипочечной гемодинамики, ремоделированию сердца и сосудов, а в конечном счете – к развитию нефросклероза и ССЗ. В свою очередь обусловленная активацией РААС дисфункция эндотелия сопровождается снижением продукции оксида азота – мощного вазодилататора, который наряду с регулированием тонуса сосудов обладает антитромботическим действием, снижает проницаемость эндотелия, подавляет пролиферацию и миграцию гладкомышечных клеток сосудов. Таким образом, тесное взаимодействие этих гормональных систем играет важную роль в формировании кардиоренальных взаимоотношений и процессах ремоделирования сердца и почек, что позволяет рассматривать гены, кодирующие их компоненты, в качестве генов-кандидатов.
Из генов – кандидатов РААС наиболее изучен ген ангиотензинпревращающего фермента (ген АСЕ). Обнаружено, что генотип DD полиморфного маркера I/D гена АСЕ, ассоциированный с более высокой концентрацией АПФ в крови [1] и большей активностью АПФ в миокарде [2], является потенциальным фактором риска развития ССЗ, в частности артериальной гипертензии (АГ), инфаркта миокарда [3, 4].
В ряде работ продемонстрирована ассоциация аллеля С полиморфного маркера С(-344)Т гена синтетазы альдостерона (ген CYP11B2) с повышенным уровнем альдостерона плазмы и с АГ [5, 6]. Кроме того, имеются сообщения о связи данного полиморфного маркера с увеличением размера левого желудочка и нарушением его диастолической функции [7].
Активно изучаются полиморфные маркеры гена эндотелиальной синтетазы оксида азота (ген NOS3). Обнаружение ассоциации полиморфного маркера 4a/4b гена NOS3 с содержанием нитратов и нитритов в плазме крови [8] позволяет говорить о генетическом контроле уровня оксида азота, а значит, и о возможной ассоциации с заболеваниями, сопровождающимися поражением эндотелия, развитием АГ и ремоделированием миокарда и стенок сосудов. В пользу этого свидетельствует ассоциация аллеля 4a гена NOS3 с более высоким риском поражения коронарных артерий у курящих [9], а также с возникновением инфаркта миокарда как у курящих, так и у некурящих больных [10].
Тем не менее имеются лишь единичные работы, посвященные изучению генетических основ ремоделирования миокарда при ХБП, в частности при хроническом гломерулонефрите (ХГН). В связи с этим целью нашей работы явилось исследование ассоциации полиморфных маркеров генов РААС и гена NOS3 с эхокардиографическими признаками поражения миокарда ЛЖ у больных ХГН.
Материал и методы
Ретроспективное исследование включило 80 больных ХГН (38 мужчин и 42 женщины), наблюдавшихся в клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева Университетской клинической больницы № 3 ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России. Длительность ХГН на момент проведения ЭХО-КГ составила 8,1 [1,8;15,3] года. ХГН латентного типа был диагностирован у 41,3 % больных, гематурического типа – у 10 %, нефротического типа – у 22,5 %, гипертонического типа – у 3,7 %; 22,5 % больных был поставлен диагноз ХГН смешанного типа. Для 54 пациентов диагноз был подтвержден морфологически: мезангиопролиферативный гломерулонефрит выявлен у 23 больных, мезангиокапиллярный – у 9, мембранозный – у 5, минимальные изменения – у 3, фокально-сегментарный гломерулосклероз – у 6, фибропластический гломерулонефрит – у 4 и нефросклероз – у 4 больных.
Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле MDRD: СКФ = 186 х (Кр сыворотки, мг/дл)-1,154 х (возраст, г)-0,203, у женщин полученную величину умножали на 0,747.
Артериальная гипертензия (АД систолическое ≥ 140 и/или АД диастолическое ≥ 90 мм рт. ст. и/или постоянный прием антигипертензивных препаратов) на момент выполнения ЭХО-КГ имела место у 66 больных из 80. Среди них у 57 пациентов АД находилось в пределах от 140/90 до 160/110 мм рт. ст., а у 9 превышало 160/110 мм рт. ст. Длительность АГ составила 3,5 [1,3;9,9] года. Антигипертензивная терапия проводилась у 65 больных, из них 42 получали ингибиторы АПФ и/или блокаторы рецепторов ангиотензина II в виде монотерапии или в сочетании с препаратами других групп (бета-адреноблокаторы, блокаторы кальциевых каналов, диуретики).
Иммуносупрессивная терапия (ИСТ) проводилась 42 больным с активными формами нефрита: большинство пациентов получали стандартную ИСТ, которая включала прием преднизолона (ПЗ): внутрь для 10 в виде монотерапии, для 10 в сочетании с пероральным приемом циклофосфана (ЦФА), для 20 в сочетании с «пульс»-терапией ПЗ и ЦФА; 2 больным с резистентным НС назначался циклоспорин А.

В изучаемой группе 22 пациента курили (из них 5 прекратили курить как минимум за несколько месяцев до исследования), 29 больных имели избыточную массу тела (ИМТ > 25 кг/м2). Отягощенный по ССЗ семейный анамнез (2 и более родственников первой степени родства страдали АГ, перенесли инфаркт миокарда или острое нарушение мозгового кровообращения) имели 43 пациента, 18 не представили данных.
Эхокардиографию с допплерографией выполняли по стандартной методике: определяли размеры всех камер сердца, конечный диастолический размер (КДР), толщину межжелудочковой перегородки (ТМЖП), толщину задней стенки левого желудочка (ТЗСЛЖ), рассчитывали интегралы скорости раннего (Е) и позднего (А) наполнения ЛЖ, а также отношение Е/А.
Массу миокарда левого желудочка (ММЛЖ) рассчитывали по формуле: ММЛЖ = 0,8*(1,04*[(КДР+ТМЖП+ТЗСЛЖ)3-КДР3])+0,6, г [11].
Индекс массы миокарда левого желудочка (ИММЛЖ) определяли по формуле: ИММЛЖ = ММЛЖ/площадь поверхности тела, в г/м2.
Признаками ремоделирования миокарда считали:
- Гипертрофию левого желудочка (ГЛЖ), которую диагностировали при увеличении ИММЛЖ > 125 г/м2 у мужчин и > 110 г/м2 у женщин, и/или
- Нарушение функции диастолического расслабления миокарда (при Е/А ≤ 1).
Идентификацию аллелей полиморфных маркеров I/D гена АСЕ, С(-344)Т гена CYP11B2 и 4a/4b гена NOS3 проводили методом полимеразной цепной реакции с последующим расщеплением ДНК рестриктазами и электрофоретическим разделением фрагментов ДНК в 2 %-ном агарозном геле.
При статистической обработке данных достоверность различий частот встречаемости аллелей и генотипов полиморфных маркеров исследуемых генов в группах определяли с помощью критерия Фишера. Для протяженных переменных рассчитывали среднее значение и стандартное отклонение (mean ± SD) или медиану, 25-й и 75-й квартили – Me [25 %; 75 %] в зависимости от соответствия данных нормальному распределению. Достоверность различий оценивали с помощью U-теста Манна–Уитни. Для проверки статистической значимости различий частотных показателей использовали критерий χ2 по Пирсону. Достоверными считались различия при р < 0,05; р < 0,1 рассматривали как тенденцию к различию.
Результаты
В нашем исследовании частота ГЛЖ составила 21,7 %. Нарушение функции диастолического расслабления миокарда диагностировано у 21 из 80 (26,3 %) пациентов. Таким образом, признаки ремоделирования сердца обнаружены примерно у четверти больных.
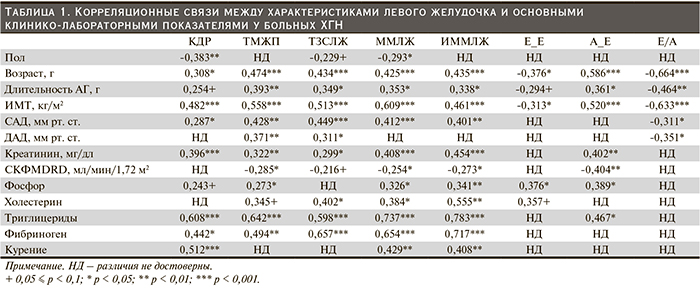
Корреляции основных показателей структурно-функционального состояния миокарда с клинико-лабораторными данными больных ХГН представлены в табл. 1. По группе в целом для ремоделирования сердца оказались значимыми практически все традиционные факторы риска. Принципиальное значение имели возраст, ИМТ, уровень АД, курение, нарушение липидного обмена, гиперфибриногенемия. Обнаружены корреляции и с т.н. почечными факторами риска: СКФ, уровнем фосфора в крови.
Генотипы исследуемых полиморфных маркеров генов распределялись следующим образом: частота генотипа II полиморфного маркера I/Dгена АСЕ составила 23,7 %, генотипа ID – 48,8 %, генотипа DD – 27,5 %. Генотип ТТ полиморфного маркера С(-344)Т гена CYP11B2 выявлен у 27,5 % больных, генотип СТ – у 53,8 % и генотип СС – у 18,8 %. Генотип 4b/4b полиморфного маркера 4a/4b гена NOS3 идентифицирован в 65,4 % случаев, генотип 4a/4b – в 30,8 % и генотип 4а/4а – в 3,8 % случаев.
Дальнейший анализ проводился в группах, выделенных в соответствии с генотипами полиморфных маркеров исследуемых генов: для гена АСЕ в группах DD и I (объединявшей больных с генотипами II и ID); для гена CYP11B2 в группах СС и Т (включавшей больных с генотипами СТ и ТТ); для гена NOS3 в группах 4b/4b и 4а (в которую объединили гомозигот 4а/4а с гетерозиготами 4a/4b).
Полиморфный маркер I/D гена АСЕ
У носителей аллеля I частота ГЛЖ оказалась выше по сравнению с гомозиготами DD, однако различия не достигали статистически значимого уровня (р = 0,157). Остальные характеристики состояния миокарда были сопоставимыми (табл. 2).
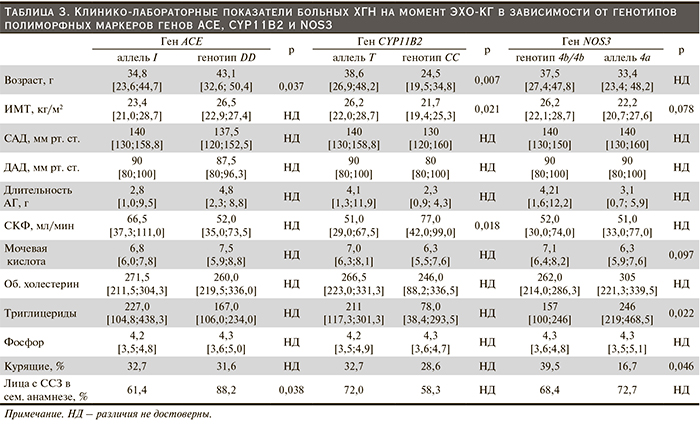
При анализе клинико-лабораторных показателей обнаружено, что больные с генотипом DD были старше по сравнению с носителями аллеля I и чаще имели отягощенный по ССЗ семейный анамнез (табл. 3). Группы не различались по ИМТ, уровню АД, выраженности обменных нарушений, числу курильщиков, проценту больных, принимавших ингибиторы АПФ/БРА. Однако, несмотря на отсутствие достоверных различий в величине СКФ между группами, среди носителей генотипа DD преобладали лица с выраженным нарушением функции почек, соответствующим ХБП 3–5-го ст., по сравнению с носителями аллеля I (77,3 % vs. 52,6 % соответственно, р = 0,039).
Таким образом, наши результаты не подтвердили связи между носительством генотипа DD и ремоделированием сердца, даже несмотря на то что более старший возраст, отягощенная наследственность и наличие ХБП, выявленные у больных в этой группе, сами по себя служат факторами риска ремоделирования миокарда.
Полиморфный маркер С(-344)Т гена CYP11B2
Обнаружена ассоциация полиморфного маркера гена синтетазы альдостерона с эхокардиографическими показателями у больных ХГН. Оказалось, что у носителей аллеля Т по сравнению с гомозиготами СС выше величина интеграла скорости позднего наполнения ЛЖ и ниже значение Е/А, что свидетельствует о нарушении функции диастолического расслабления миокарда (табл. 2). Кроме того, у них наблюдалась тенденция к увеличению КДР ЛЖ. В то же время частота диастолической дисфункции и ГЛЖ были сопоставимыми в обеих группах.
Было показано, что носители аллеля Т по сравнению с гомозиготами СС были старше, имели более высокий ИМТ и низкую СКФ. Остальные клинико-лабораторные показатели достоверно не различались (табл. 3).
Полиморфный маркер 4a/4b гена NOS3
Обнаружена тенденция к большей частоте нарушения функции диастолического расслабления миокарда у пациентов, гомозиготных по аллелю 4b. Другие показатели, характеризующие структуру и функцию ЛЖ, были сопоставимыми в обеих группах (табл. 2).
Выявлена ассоциация данного полиморфного маркера с ИМТ, уровнями мочевой кислоты и триглицеридов на момент выполнения ЭХО-КГ. По сравнению с носителями аллеля 4а среди гомозигот 4b/4b преобладали курящие и лица с ИМТ, превышающим 25 кг/м2 (60,8 % vs. 32 % соответственно, р = 0,017).
Анализ частоты ремоделирования сердца в зависимости от возраста
По группе в целом ГЛЖ и нарушение диастолической функции чаще наблюдались у больных старше 45 лет и составили 42,9 и 47,8 % по сравнению с 10,3 и 17,5 % у лиц более молодого возраста соответственно, р < 0,01.
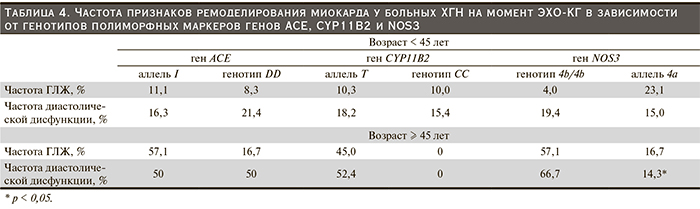
У больных моложе 45 лет ассоциации полиморфных маркеров исследуемых генов с характеристиками миокарда не выявлено, тогда как в старшей возрастной группе признаки ремоделирования встречались чаще, причем у носителей, более благоприятных с точки зрения развития осложнений аллелей (аллеля Т гена CYP11B2) и генотипа 4b/4b гена NOS3 (табл. 4).
Обсуждение
Внедрение методов молекулярной диагностики в клиническую практику открыло новые перспективы в изучении генетических детерминант возникновения и прогрессирования ряда широко распространенных многофакторных заболеваний, что в свою очередь заложило основы для индивидуализированного подхода к их диагностике, лечению и профилактике. Принимая во внимание ведущую роль РААС (в первую очередь ангиотензина II и альдостерона) в развитии гипертрофии и фиброза миокарда, подтвержденную результатами многочисленных исследований [12], были идентифицированы гены-кандидаты, продукты которых вовлечены в процессы ремоделирования сердца и сосудов.
К настоящему времени опубликована масса работ, в т.ч. результатов мета-анализа, подтверждающих наличие ассоциации полиморфного маркера I/D гена АСЕ с признаками ремоделирования миокарда в разных исследованных группах. Так, по данным мета-анализа результатов 38 исследований, включивших спортсменов, здоровых добровольцев, лиц из контрольных групп и т.п. (критериями исключения были гипертрофическая кардиомиопатия, стеноз аортального клапана, инфаркт миокарда, реноваскулярные заболевания, нарушение функции почек, а также терапия ингибиторами АФП), генотип DD был ассоциирован с более высокими значениями массы миокарда ЛЖ, тогда как связь с ГЛЖ отсутствовала [13]. В другом мета-анализе, включившем 52 исследования с участием 3663 больных и 8953 человек, составивших контрольную группу [14], риск развития ГЛЖ у носителей генотипа DD был повышен в 1,59 раза по сравнению с гомозиготами II (95 % доверительный интервал [95 % ДИ]: 1,31–1,92; р < 0,0005). При анализе в подгруппах, выделенных по этническому признаку, среди гомозигот DD риск ГЛЖ возрастал до 90 % у лиц азиатского происхождения vs 33 % у европеоидов.
Обнаружена ассоциация между носительством аллеля D полиморфного маркера I/D гена АСЕ и частотой развития ГЛЖ у пациентов, получающих заместительную почечную терапию (ЗПТ). В работе B. Bzoma и соавт. [15] у больных, находящихся на лечении ГД, носительство генотипа DD гена АСЕ и генотипа СС гена AT2R1 было ассоциировано с большей частотой развития АГ и ГЛЖ, но не влияло на краткосрочный прогноз и смертность. В исследовании R. Fedor и соавт. [16], включившем реципиентов почечного трансплантата, у носителей аллеля D ГЛЖ наблюдалась чаще и была более выраженной по сравнению с гомозиготами II.
В нашей работе эхокардиографические показатели в группах больных, выделенных в зависимости от генотипов полиморфного маркера гена АСЕ, достоверно не различались, т.е. ассоциация полиморфного маркера I/D гена АСЕ с ГЛЖ и диастолической дисфункцией отсутствовала, несмотря на более старший возраст носителей генотипа DD, преобладание среди них лиц с нарушенной функцией почек и отягощенным по ССЗ наследственным анамнезом, т.е. присутствие у них факторов риска ремоделирования миокарда.
Несмотря на активное исследование полиморфного маркера С(-344)Т гена CYP11B2, сведения о его функциональном значении и вкладе в формирование клинических симптомов остаются противоречивыми. По данным одних авторов, у носителей аллеля С связывание со стероидогенным фактором транскрипции (SF-1) происходит в 4 раза быстрее, чем у носителей аллеля Т [17], и ассоциировано с более активным синтезом и более высокой концентрацией альдостерона в плазме крови [5]. Тогда как в работах других авторов показано, что с более высокой экспрессией гена [18] и большей экскрецией альдостерона [19, 20] ассоциирован аллель Т; в ряде работ ассоциация между полиморфным маркером С (-344)Т и уровнем альдостерона в плазме крови отсутствует [21, 22]. Данные о значении данного полиморфного маркера при ремоделировании миокарда также неоднозначны. Имеются сообщения об ассоциации аллеля С с ремоделированием левого предсердия у больных АГ [12], с большей массой миокарда ЛЖ, индексом ММЛЖ и высоким процентом концентрической гипертрофии у больных ХБП 5-й ст., получающих программный гемодиализ [23]. Мы не выявили ассоциации данного полиморфного маркера с ГЛЖ, но обнаружили взаимосвязь между носительством аллеля Т и нарушением функции диастолического расслабления миокарда, а также большим значением КДР.
Еще менее изучена роль полиморфного маркера 4a/4b гена NOS3 в развитии ремоделирования миокарда. В работе отечественных авторов продемонстрирована ассоциация аллеля 4а с тенденцией к более выраженной диастолической дисфункции ЛЖ, а также тенденцией к более частому развитию ГЛЖ у больных АГ [24]. По нашим данным, частота ГЛЖ у носителей аллеля 4а и гомозигот 4b/4b была сопоставимой, но наблюдались достоверные различия в частоте нарушения функции диастолического расслабления миокарда, причем последняя чаще встречалась у больных с генотипом 4b/4b.
Таким образом, полученные нами результаты отличаются от ожидаемых: ассоциации между ремоделированием миокарда и носительством «неблагоприятных» аллелей генов РААС не обнаружено. Так, различия в частоте ГЛЖ в группах гомозигот DD и носителей аллеля I не достигали статистически значимой величины, отсутствовала ассоциация данного полиморфного маркера и с другими эхографическими показателями. Напротив, наиболее выраженные изменения обнаружены у носителей аллелей, по данным наших предыдущих исследований, считавшихся «благоприятными» (т.е. ассоциированными с более благоприятным течением и прогнозом ХГН). В определенной степени это, по-видимому, обусловлено дизайном исследования (ретроспективное с участием относительно небольшого числа больных); условиями выполнения ЭХО-КГ в рамках клинического обследования (показанием служило наличие АГ), в связи с чем у носителей неблагоприятных аллелей, у которых наблюдалась более яркая клиническая симптоматика в начале заболевания, ЭХО-КГ проводили на ранних стадиях ХБП, когда выраженные изменения еще не успевали развиться, тогда как у остальных пациентов по мере прогрессирования заболевания появлялись признаки ремоделирования сердца.
Кроме того, необходимо учитывать, что однонуклеотидные полиморфные маркеры, как правило, обусловливают не развитие патологии per se (в данном случае ремоделирования сердца), а только предрасположенность к ней, причем немаловажную роль в этом играет воздействие факторов окружающей среды, что клиническая картина зависит от кумулятивного эффекта генетических факторов и факторов окружающей среды, а также, что одно и то же заболевание у разных пациентов может провоцироваться разными факторами.
В заключение хотелось бы подчеркнуть, что изучение генетических основ имеет большие перспективы, т.к. позволит индивидуализировать подход к диагностике, лечению и профилактике ССЗ. В то же время имеются трудности, обусловленные как полигенностью и многофакторностью, так и необходимостью рассматривать генетические особенности в контексте взаимодействия с окружающей средой. Это заставляет с осторожностью интерпретировать полученные данные и требует продолжения исследований в крупных однородных выборках.



