Последние десятилетия ознаменованы широким внедрением технологий масс-спектрометрии в научные исследования в области нефрологии [1]. Детально изучаются различные формы нефритов и вторичных нефропатий. В большинстве случаев ученые сконцентрированы на исследованиях в области интерактомики, т.е. применении масс-спектрометрии для расшифровки особенностей функционирования тех или иных биохимических каскадов при патологии почек [2]. В частности, большой интерес представляют исследования в области синтеза рецепторов, белков-регуляторов и эпигенетического контроля этих процессов [1, 3]. Поскольку белковые субстанции играют ключевую роль в биологических процессах, протеомика занимает ведущую роль в биологии нефропатий.
Исследования нашего научного коллектива в области протеомики нефропатий проводятся с 2009 г. Первая публикация в РФ по данной проблеме появилась в 2010 г. [4]. В настоящее время проведенные нами исследования позволяют сформировать представления о возможных белках – маркерах некоторых форм первичных гломерулонефритов (IgA-нефропатия, фокально-сегментарный гломерулосклероз), а также паранеопластической, диабетической нефропатии, нефропатии при хронической сердечной недостаточности [4–9]. При выборе биологического материала для исследований проанализирован мировой опыт, накопленный по данной проблеме, и оказалось, что чаще анализу подвергается кровь. Несколько меньше исследований по изучению протеомного паттерна мочи при нефропатиях [10, 11]. По нашему мнению, именно моча служит наиболее информативным материалом для исследования патологических процессов, протекающих в почечной паренхиме.
Протеомные исследования в медицине в целом и в нефрологии в частности призваны отвечать на три ключевых вопроса: есть ли болезнь (в случае использования масс-спектрометрии с диагностической целью, например при некоторых орфанных заболеваниях), каковы особенности патогенеза патологического процесса (возможно открытие новых деталей патогенеза), какова диагностическая значимость выявленных маркеров (возможности их диагностического применения в качестве альтернативы инвазивных методов)? Последнее особенно актуально в нефрологии, одним из ключевых методов диагностики которой остается пункционная нефробиопсия. При всех ее положительных сторонах инвазивность процедуры, невозможность с ее помощью регулярного мониторинга течения болезни и эффективности терапии заставляют вести поиск новых диагностических возможностей. Например, в исследовании нашей сотрудницы Н.А. Садовничей (Н.А. Броновицкой) было предложено рассматривать ряд ассоциирующихся с тубулоинтерстициальным фиброзом белков в моче в качестве маркеров – кандидатов этого процесса при IgA-нефропатии и фокально-сегментарном гломерулосклерозе (статья подана в печать). Однократно выполнив пункционную нефробиопсию и убедившись в отсутствии фиброзного процесса в тубулоинтерстиции, в дальнейшем можно мониторировать его возникновение в процессе ведения пациента, предполагая утяжеление прогноза прогрессирования почечной недостаточности в случае положительного результата.
К таким белкам при IgA-нефропатии относятся α-цепь коллагена и гепаран-сульфат, а при фокально-сегментарном гломерулосклерозе – трансформирующий фактор роста β, цистатин В. Белковые паттерны при IgA-нефропатии и фокально-сегментарном гломерулосклерозе различаются, также различаются они и при развитии тубулоинтерстициального фиброза. Вероятно, это обусловлено особенностями патогенеза этих двух форм нефритов, и несмотря на универсальность самого процесса фиброобразования, особенностями его течения при разных формах нефритов.
Безусловно протеомные исследования тубулоинтерстициального фиброза – лишь первый шаг на пути процесса формирования новой диагностической технологии. В частности, требуется более широкое изучение этих белков в моче больных с включением в анализ проспективного наблюдения и количественного определения уровня белков. Именно поэтому протеомные исследования обычно являются первым этапом, верифицирующим акцессы в протеомном паттерне. Последующее их детальное изучение позволяет подтвердить или опровергнуть значимость обнаружения того или иного белка и валидизировать метод.
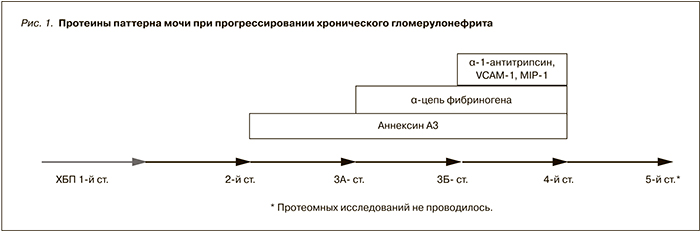
Помимо маркирования тубулоинтерстициального фиброза, являющегося фактором риска прогрессирования нефропатий, проведена оценка взаимосвязи прогрессирования почечной недостаточности (по снижению скорости клубочковой фильтрации) с компонентами протеомного паттерна мочи при IgA-нефропатии и фокально-сегментарном склерозе. По мере прогрессирования почечного повреждения в моче появляются аннексин А3, α-цепь фибриногена, α-1-антитрипсин, сосудистый белок клеточной адгезии (VCAM-1), молекула поражения почечной ткани 1 (MIP-1) (рис. 1).
Это безусловно не подменяет более доступных методов диагностики почечной дисфункции, но позволяет расширить представления о процессах, протекающих в почечной паренхиме при почечной недостаточности. Появление аннексина А3 в моче обычно ассоциируется с раком простаты [12]. Аннексин А3 относится к семейству кальций-зависимых фосфолипид-связывающих протеинов, обладающих свойствами ингибировать фосфолипазу А2. Аннексин А3 играет важную роль в регуляции процессов клеточного роста и сигнальных трунсдукционных путях, обладает антикоагулянтными свойствами. Его роль в процессах почечного ремоделирования изучена недостаточно, однако можно предположить, что высокая частота его обнаружения в моче определяется активацией процессов пролиферации при фиброзировании почечной ткани. Обнаружение на поздних стадиях почечной недостаточности в моче α-цепи фибриногена, вероятно, демонстрирует развитие гемореологических расстройств на уровне почечного микроциркуляторного русла. А появление сосудистого белка клеточной адгезии (VCAM-1), стимулирующего адгезию лейкоцитов на эндотелиальных клетках, и молекулы поражения почечной ткани 1 (MIP-1), являющейся гликопротеином, расположенным на мембранах, богатых муцином клеток проксимальных канальцев, на конечных стадиях почечного процесса свидетельствует о глубокой перестройке почечной ткани, в основе которой наряду с процессами фиброгенеза лежит активация компонентов врожденного иммунитета и явлений апоптоза нефротелия [13]. Альфа-1-антитрипсин является ингибитором сериновых протеаз, эластазы и акрозина. В исследованиях P.V. Rao и соавт. [14] и M. Navarro-Muñoz и соавт. [15] также было показано появление в моче высоких концентраций α-1-антитрипсина у больных хронической болезнью почек (ХБП). Вероятно, нарастание эндогенной интоксикации вследствие почечной недостаточности приводит к острофазной гиперпродукции α-1-антитрипсина гепатоцитами. Не исключено, что α-1-антитрипсин принимает непосредственное участие в процессах протеолиза, сопутствующих ремоделированию почечной паренхимы.
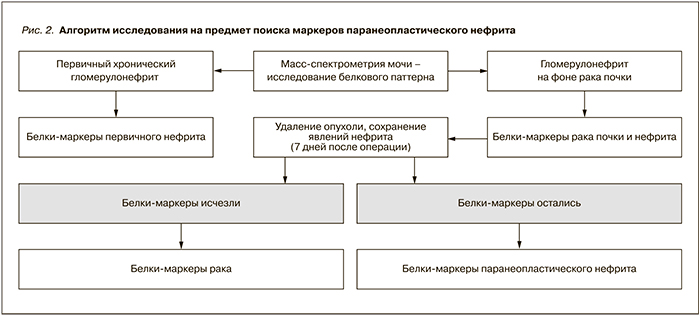
Применение масс-спектрометрии расширяет возможности дифференциальной диагностики нефропатий. В частности, в наших протеомных исследованиях [6–9] был сформирован дизайн, позволяющий проводить дифференциацию между паранеопластическим (по причине рака почки) и первичным гломерулонефритом. Исследование протеомного паттерна мочи больных первичным и паранеопластическим нефритом дало возможность определить разницу в выявляемости тех или иных белков. Однако в случае опухолевого процесса появление белков в моче могло быть связано как с самим опухолевым процессом, так и с паранеопластическим нефритом (рис. 2). Изучение протеомного паттерна до и после удаления опухоли позволило выделить группу белков, маркирующих опухолевый процесс (исчезающих после удаления опухоли) и маркирующих паранеопластический нефрит (сохраняющихся после удаления опухоли при наличии картины нефрита). Данный алгоритм широко используется в подобных исследованиях [16].
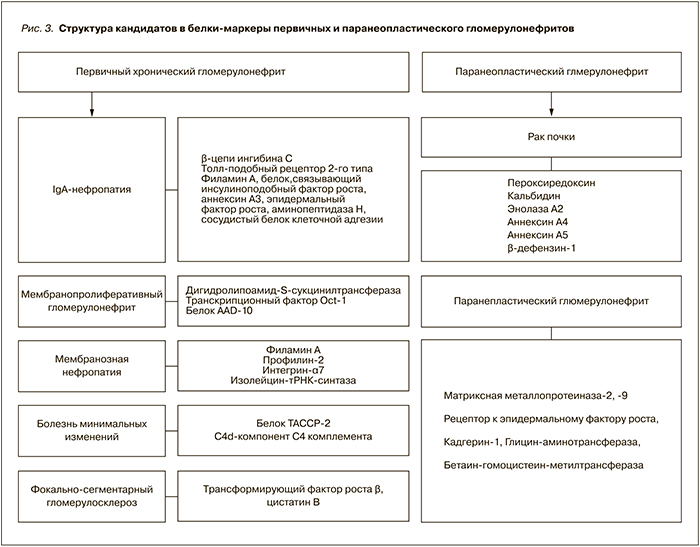
Проводя сравнительные исследования различных морфологических вариантов первичных хронических и паранеопластического гломерулонефритов, удалось идентифицировать белки в протеомном профиле мочи, являющиеся кандидатами в маркеры заболевания (рис. 3). При IgA-нефропатии было выявлено 2 таких белка-кандидата (Toll-подобный рецептор-2, рецептор к вазопрессину V1a); при болезни минимальных изменений – белок, связанный с центросомами и микротрубочками; при мембранозной нефропатии – Toll-добный рецептор-2, Т-клеточный рецептор дельта цепей Vd1.
Обнаружены белки-кандидаты, ассоциирующиеся только с раком почки и паранеопластическим гломерулонефритом. Выявлены белки, сохраняющиеся в моче после удаления опухоли, – матриксная металлопротеиназа-2, -9, рецептор к эпидермальному фактору роста, кадгерин-1, глицин-аминотрансферраза, бетаин-гомоцистеин-метилтрансфераза.
В перечне возможных маркеров паранеопластического нефрита присутствует ряд протеинов, сохранение высокой экспрессии которых после удаления опухоли вызывает ряд вопросов. В частности, высокая экспрессия рецептора к эпидермальному фактору роста (EGFR), являющегося достаточно хорошо изученным маркером опухолевого роста [17]. Вероятно, повышенная экспрессия этого фактора сохраняется в течение некоторого времени после энуклеации опухоли. Что касается глицин-аминотрансферазы и бетаин-гомоцистеин-метилтрансферазы, то повышение их экспрессии часто ассоциируется с интоксикационным синдромом, что не свойственно первичным гломерулонефритам и может быть использовано в качестве маркера паранеопластического процесса.
Как было отмечено ранее, вторым ключевым вопросом протеомных исследований является изучение особенностей патогенеза патологического процесса. В ходе исследований нам представлялось интересным изучить особенности протеомного зеркала при нефропатии, вызванной хронической сердечной недостаточностью. Очевидно, что изменения белкового состава мочи этих пациентов не носили исключительно почечное происхождение, а были результатом комплексных изменений, развивающихся по причине циркуляторной гипоксии вследствие патологии сердца. При данной патологии акцент исследования сместился в сторону изучения звеньев патогенеза почечного повреждения и анализа межклеточных контуров, активизирующихся в ответ на почечную гипоперфузию. В частности, было показано, что на фоне гипоксии возникает ряд процессов, приводящих к активации апоптоза, митохондриальной дисфункции и гибели нефротелия, а также нарушению почечной микроциркуляции (рис. 4).
Детальный анализ выявленных патогенетических контуров позволил предположить обоснованность применения в эксперименте препаратов, влияющих на состояние митохондрий, в частности митохондриального свободнорадикального окисления – молекул Скулачева. Мы располагаем опытом применения молекул Скулачева в экспериментальной модели НПВП-нефропатии, однако исследований в области их применения при ишемической или застойной нефропатии в настоящее время нет. Индукция процессов апоптоза нефротелия, начинающаяся с митохондрий и проявляющаяся активацией митохондриального свободно-радикального окисления, остается важным компонентом в понимании патогенеза почечного повреждения при хронической сердечной недостаточности.
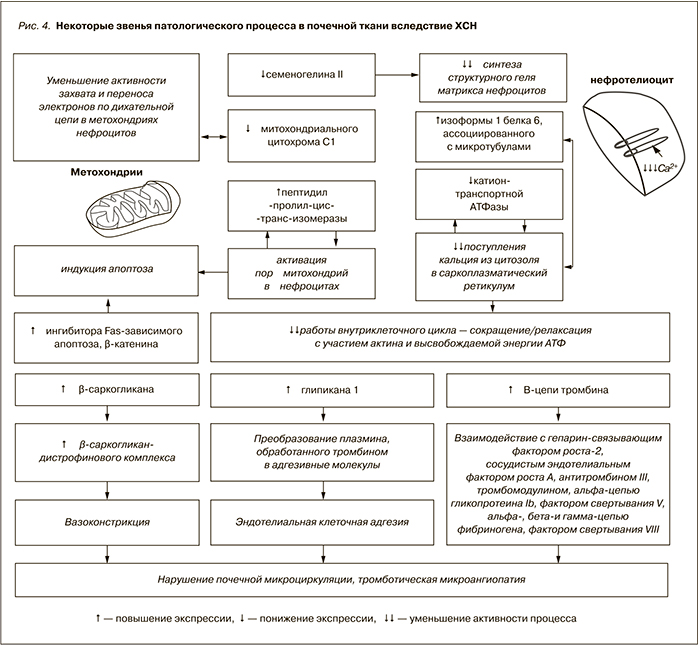
В разработке патогенетически обоснованных терапевтических подходов к ведению данной категории пациентов также необходима концентрация усилий вокруг региональных изменений гемостаза и микроциркуляции, существенно влияющих на состояние почечной функции при хронической сердечной недостаточности.
Широко протеомные исследования проводятся при диабетической нефропатии [18, 19]. В основном они направлены на поиск новых маркеров прогрессирования нефропатии, а также на анализ особенностей патогенетических процессов, происходящих в почечной ткани. В наших исследованиях при диабетической нефропатии в моче часто обнаруживались филамин А и люмикан. В отношении люмикана подобные результаты имели место и ранее [20]. Обнаружение в моче высоких концентраций люмикана, декорина, бигликана и других гликопротеинов экстрацеллюлярного матрикса семейства интерстициальных протеогликанов свидетельствует об активации синтетических процессов в матриксе. Люмикан взаимодействует с коллагеном и участвует в регуляции коллагенового фиброгенеза, ограничивая рост коллагеновых фибрилл в диаметре. Он также взаимодействует с матриксными металлопротеиназами (ММР-14), влияет на процессы клеточной пролиферации и адгезии макрофагов в зоне воспаления. Выявление люмикана не наблюдалось при гломерулонефритах даже на стадии тяжелой почечной недостаточности, несмотря на то что данный протеин можно рассматривать в качестве неспецифического маркера ремоделирования тубулоитнерстиция (гиперпродукции экстрацеллюлярного матрикса). Люмикан является маркером фибротических процессов именно при диабетической нефропатии. Однако практически нет протеомных исследований при хронических тубулоинтерстициальных нефритах различного генеза, что не дает возможности оценить частоту обнаружения люмикана в моче и его роль в гиперпродукции экстрацеллюларного матрикса при этой патологии.
Интересным представляется выявление филамина А – белка, сшивающего актиновые филаменты в ортогональные сети в цитоплазме и выполняющего функцию якоря для белков цитоскелета. Филамин А принимает непосредственное участие в ремоделировании цитоскелета в случае изменения формы или миграции клеток. Он взаимодействует с интегринами, трансмембранными рецепторными комплексами и вторичными мессенджерами. Важной представляется роль филамина в формировании нормальной структуры отростков подоцитов, поскольку подоцитопатия служит неотъемлемым компонентом диабетической нефропатии [21].
Таким образом, в современной нефрологии стала актуальной необходимость совершенствования неинвазивных диагностических технологий, основной целью которых является персонификация подходов к диагностике, лечению и прогнозированию течения, исходов нефропатий. Клиническая протеомика играет в этом механизме начальную роль, обеспечивая поиск белковых субстанций, участвующих в процессе почечного повреждения. Исследование протеомного паттерна мочи наиболее перспективно, поскольку данный биологический субстрат в большей степени отражает процессы, происходящие в почечной паренхиме, нежели кровь. Формирование сравнительных протеомных исследований при различных нефропатиях дает возможность оценивать различия в протеомном паттерне и закладывать основу для дальнейшего поиска маркеров, используемых в дифференциальной диагностике нефропатий.



