Поражение кожи по-прежнему нередко имеет определяющее значение в диагностике системной красной волчанки. Общепризнанно, что варианты кожного поражения при этом заболевании отличаются полиморфизмом – наряду с хорошо известной эритемой щек по типу “бабочки” возможны диффузная алопеция, образование очагов дискоидного типа, экссудативная эритема Роуэлла, сетчатое ливедо и ониходистрофия [1]. J.A. Yell et al. (1996) [2] проанализировали варианты поражения кожи при системной красной волчанке. К острым формам волчаночного кожного процесса были причислены отмеченные у 51 % больных эритематозные высыпания, телеангиэктазии, папулы и отек лица; к хроническим – дискоидные волчаночные кожные элементы, выявленные у 25 %. У 14 % пациентов была зарегистрирована алопеция, у 8 % – буллезные кожные элементы, у 11 % – кожный васкулит, у 4 % – livedo reticularis; 60 % обследованных демонстрировали синдром Рейно, 63 % – фотосенсибилизацию. Анализ репрезентативных выборок пациентов, страдающих системной
красной волчанкой [3], показывает, что частота отдельных вариантов кожного поражения зависит от формы течения заболевания: так, в отличие от хронической при подострой чаще регистрируют папулосквамозные и аннулярные кожные элементы, а также фотосенсибилизацию и феномен Рейно; при хронической, напротив, чаще выявляют дискоидную кожную волчанку и алопецию. Не вызывает сомнения, что поражение кожи отражает активность системной красной волчанки, четко ассоциируясь с другими ее маркерами, в т. ч. LE-клеточным феноменом [4].
Сочетание системной красной волчанки с поздней кожной порфирией описано [5–8], но, очевидно, является казуистически редким. Более того, в каждом конкретном наблюдении зачастую бывает крайне трудной дифференциация между внешне воспроизводящим порфирию вариантом поражения
кожи при системной красной волчанке и истинной поздней кожной порфирией, ассоциация которой с системной красной волчанкой носит, очевидно, случайный характер. Четкий дифференциальный диагноз в подобной ситуации, тем не менее, принципиально важен, поскольку волчаночное поражение кожи и поздняя кожная порфирия требуют различной лечебной тактики. Представляем наблюдение пациентки, у которой кожный процесс был первоначально интерпретирован как
поздняя кожная порфирия, но в дальнейшем формирование других клинических проявлений системной красной волчанки, прежде всего волчаночного нефрита, стало основанием для пересмотра диагноза и схемы ведения.
Больная П. 37 лет, инженер. Имеется врожденная аномалия развития I–IV пальцев обеих кистей, II пальца правой стопы, по поводу чего проводилось неоднократное оперативное лечение. С 10-летнего возраста отмечается выпадение зубов вплоть до их полной потери, с 17-летнего возраста постоянно пользуется зубными протезами, тогда же впервые отметила выпадение волос, к настоящему времени достигшее степени выраженной алопеции (вынуждена пользоваться париком).
Считает себя больной с 2007 г., когда отметила появление болей в коленных, плечевых, лучезапястных суставах. Амбулаторно по месту жительства проводилась терапия рексетином, мильгаммой с эффектом. В декабре 2009 г. в области щек и подбородка появились крупные красно-лиловые пятна с неровными краями, не зудящие и безболезненные. Самостоятельно лечилась антигистаминными препаратами,
в т. ч. местными. В марте 2010 г. после инсоляции (пребывания в Египте) в связи с сохраняющимися высыпаниями в области лица обратилась к дерматологу по месту жительства, рекомендован прием антигистаминных препаратов, проведен курс инъекций глюконата кальция без эффекта.
В июне 2010 г. после повторного пребывания на солнце появились эритематозные высыпания в области рук, декольте, бедер. В июле того же года отметила стойкое повышение температуры тела до фебрильных величин, появились эритематозные очаги на лице, папулы на руках, шее, спине, в области декольте, единичные на ногах. В дальнейшем на месте папулезных элементов образовывались буллы, часть из них изъязвлялась. В течение 4 суток применяла триметоприм/сульфометоксазол без эффекта. Тогда же была госпитализирована в областной дерматологический стационар, где при обследовании выявлены лейкопения (лейкоциты – 1,8 × 109/л) и анемия (Hb – 118,0 г/л). Проводилась терапия антигистаминными препаратами, преднизолоном 60 мг/сут внутривенно трижды, однократно – в
той же дозе внутримышечно, глюконатом кальция с незначительным эффектом. Пациентка была направлена на консультацию в МОНИКИ им. М.Ф. Владимирского. На основании клинической картины, а также впервые выявленных антител к нативной ДНК (24 ЕД/мл) диагностирована системная красная волчанка, рекомендован прием глюкокортикостероидов. Данные рекомендации больная не выполняла.
При повторном амбулаторном обследовании в августе 2010 г. сохранялись лейкопения (1,8 × 109/л), повышение уровня сывороточного уровня гамма-глобулинов до 17,8 г/л и С-реактивного белка до 13,6 мг/л. В сентябре 2010 г. больная консультирована амбулаторно: на основании особенностей кожного синдрома была диагностирована поздняя кожная порфирия, назначена терапия глюкозой 300 г/сут, делагилом 250–500 мг/сут с незначительным эффектом – отмечено уменьшение интенсивности окраски кожных высыпаний, однако сохранялось повышение температуры тела до фебрильных
цифр с ознобами – преимущественно в вечернее время.
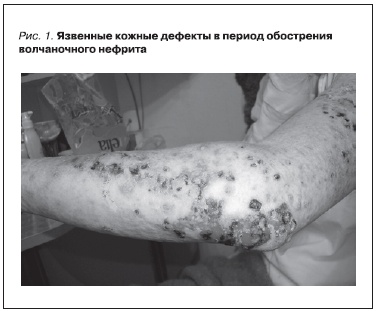
Пациентка была госпитализирована в Клинику нефрологии внутренних и профессиональных болезней им. Е.М. Тареева Университетской клинической больницы № 3 ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” 14 октября 2010 г. При поступлении состояние средней тяжести. Температура тела составляла 37,6 °С. Кожные покровы бледные, сухие. В области лица, рук, декольте – эритематозные высыпания, на коже кистей, предплечий – язвенные дефекты, части из них – в стадии эпителизации (рис. 1). Волосы редкие, алопеция лобно-теменной области. Подкожно-жировая клетчатка
развита умеренно, распределена равномерно. Врожденная аномалия развития IIV пальцев обеих кистей, II пальца правой стопы. Движения в суставах сохранены в полном объеме. Пастозность голеней. В легких дыхание везикулярное, хрипов и крепитации нет. Границы сердца в пределах нормы. Тоны сердца ясные, ритмичные, шумов нет. Частота сердечных сокращений – 80/мин, АД – 130/80 мм рт. ст. Живот при пальпации мягкий, безболезненный во всех отделах. Печень не увеличена. Селезенка не пальпируется. Очаговой неврологической симптоматики нет.
Выявлены анемия (Hb – 98,2 г/л, эритроциты – 3,2 × 1012/л), лейкопения (2,2 × 109/л), повышение сывороточного уровня гамма-глобулинов до 26,7 г/л, антител к нативной ДНК до 6,5 норм, антинуклеарные антитела (ANA) в титре 1 : 80 (гомогенное свечение), акомплементемия, единичные LE-клетки. Обращали на себя внимание изменения мочи (протеинурия – 1,78 г/сут, эритроцитурия), дополнявшиеся гипальбуминемией (29,8 г/л). Эти признаки наряду с алопецией, деталями анамнеза (связь нарастания тяжести заболевания с инсоляцией, эпизоды артрита), цитопенией позволили предположить наличие системной красной волчанки в большей степени, чем ранее обсуждавшейся первичной кожной порфирии. Тем не менее нельзя было полностью исключить сочетание двух заболеваний. В связи с этим был исследован уровень порфиринов в моче, величина которого оказалась в пределах нормы. Характер поражения кожи был интерпретирован как патогенетически связанный с системной красной волчанкой, но визуально сходный с наблюдающимся при поздней кожной порфирии.
Рентгенография органов грудной клетки, эхокардиография, ультразвуковое исследование органов брюшной полости не выявили отклонений от нормы. Однако в период госпитализации в клинику было констатировано нарастание периферических отеков и одновременно экскреции белка с мочой
(4,32 г/сут), эритроцитурии (до 46 тыс. в поле зрения), появление гипопротеинемии (общий белок – 48,8 г/л), усугубление гипальбуминемии (27,5 г/л). Впервые отмечено повышение АД до 160/90 мм рт. ст. Констатировано сочетание нефротического и остронефритического синдромов, происхождение
которых, очевидно, было связано с волчаночным нефритом, морфологический тип которого требовал уточнения с точки зрения определения дальнейшей тактики ведения.
Выполнена пункционная биопсия почки, при морфологическом исследовании ткани которой был выявлен мезангиокапиллярный гломерулонефрит с фибропластической трансформацией, признаками тромботической микроангиопатии. Последние стали аргументом в пользу обследования, направленного на исключение антифосфолипидного синдрома, лабораторные маркеры которого (антитела к кардиолипину, антитела к бета-гликопротеиду, волчаночный антикоагулянт) обнаружены не были.
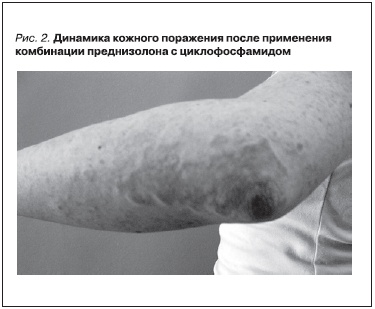
С целью купирования активности волчаночного нефрита и уменьшения выраженности кожного поражения начата активная иммуносупрессивная терапия: назначен преднизолон (50 мг/сут); проведена сочетанная “пульс”-терапия (циклофосфамид 500 мг и преднизолон 500 мг), назначена комбинация антагониста рецепторов ангиотензина II и недигидропиридинового антагониста кальция. В результате проведенного лечения отмечена положительная динамика клинико-лабораторных показателей: заметно уменьшились выраженность и распространенность кожных высыпаний (рис. 2), нормализовалась температура тела. Кроме того, было отмечено восстановление показателей
периферической крови (Hb – 131,0г/л, эритроциты – 4,21 ×1012/л, лейкоциты – 6,44 × 109/л), альбуминемии (33,3 г/л), исчезла гипопротеинемия (общий белок – 58,0 г/л). Заметно снизился титр антител к нативной ДНК, перестали обнаруживаться ANA, комплемента, уровень антител к нативной ДНК снизился. В пользу регресса остронефритического синдрома свидетельствовало достижение нормальных (130/80 мм рт. ст.) величин АД. В удовлетворительном состоянии пациентка была
выписана под амбулаторное наблюдение с рекомендациями продолжать прием преднизолона 50 мг/сут per os, повторять инфузии циклофосфамида 500 мг 1 раз в 2 недели в течение 3 месяцев. По-прежнему оправданным представлялся и прием комбинации антагониста рецепторов ангиотензина II с длительно действующим недигидропиридиновым антагонистом кальция. В последующем планируется перевод пациентки на прием микофеноловой кислоты.
Представленное наблюдение демонстрирует прежде всего трудности в дифференциальной диагностике поражения кожи между истинной поздней кожной порфирией и “порфириеподобным” вариантом кожного синдрома при системной красной волчанке. При этом необходимо иметь в виду, что системная красная волчанка и поздняя кожная порфирия могут сочетаться. Так, установлено, что при поздней кожной порфирии достоверно чаще, чем у представителей общей популяции, встречается артериальная гипертензия, в основе развития которой нередко лежит поражение почек, среди вариантов которого, особенно при ухудшении почечной функции, фигурирует волчаночный нефрит [9]. Зачастую при сочетании системной красной волчанки и поздней кожной порфирии удается обнаружить диагностические маркеры последней (например, повышение сывороточной концентрации порфиринов и/или увеличение их содержания в крови и каловых массах) [10, 11]. Среди факторов, обусловливающих развитие поздней кожной порфирии у пациентов, имеющих
установленный диагноз системной красной волчанки, называют наряду с HCV-инфекцией [10] и злоупотреблением алкоголем прием эстроген-содержащих препаратов или гидроксихлорохина, а также синдром перегрузки железом [12]. В свою очередь развитие системной красной волчанки у больного, страдающего ранее диагностированной кожной порфирией, можно распознать как ориентируясь на появление соответствующих признаков вовлечения внутренних органов, в частности почек, так и по соответствующим серологическим маркерам (более чем в 50 % случаев, по
данным S.A. Allard et al. (1990) [13], удается обнаружить антинуклеарные антитела). В диагностике волчаночного нефрита у больного поздней кожной порфирией, как и в представленном нами наблюдении, решающее значение имеет пункционная биопсия почки [14].
У отдельных больных течение системной красной волчанки и поздней кожной порфирии определяется общими провоцирующими факторами, в частности инсоляцией, при устранении которой активность обоих заболеваний уменьшается [15]. Тем не менее далеко не всегда констатация сочетания системной красной волчанки и поздней кожной порфирии основана на убедительных доказательствах, в т. ч. соответствующих диагностических критериях [16]. У представленной нами пациентки первоначально предполагали именно позднюю кожную порфирию, хотя часть обращавших на себя внимание проявлений, в частности цитопения, не вполне согласовывались с этим диагнозом. В большей степени в пользу системной красной волчанки указывали также наблюдавшиеся эпизоды артритов (боли в коленных, плечевых, лучезапястных суставах). Решающим аргументом в пользу диагноза системной красной волчанки стали изменения мочи, нараставшие и сочетавшиеся с артериальной гипертензией, что позволило говорить об ассоциации нефротического и остронефритического синдромов, субстратом которых, как показали результаты морфологического исследования ткани почки, полученной при биопсии, был волчаночный нефрит. Удалось выявить и характерные серологические маркеры системной красной волчанки, в частности ANA. Против наличия поздней кожной порфирии у пациентки четко свидетельствовало отсутствие повышения концентрации порфиринов в моче.
Общепризнанно, что различные варианты кожного поражения при системной красной волчанке могут сочетаться, в итоге формируя полиморфную картину кожного поражения, представленную у демонстрируемой пациентки (эритема, язвенные дефекты, алопеция) и первоначально ставшую аргументом в пользу исключения поздней кожной порфирии. Так, T. Watanabe et al. (1995) [17], проанализировав 191 больного системной красной волчанкой, у 68 % констатировали только один вариант поражения кожи, у 29 % – два, у 3 % – три его варианта. C. Cardinalli et al. (2000) [18] в течение 10 лет наблюдали 186 пациентов, имевших системную красную волчанку: только у
8 (4,3 %) из них вовлечение кожи отсутствовало. Чаще всего (96 % обследованных) наблюдали характерную эритему лица в виде бабочки. Заметное число пациентов демонстрировали синдром Рейно, кожный лейкоцитокластический васкулит, алопецию, ознобленную волчанку, сетчатое ливедо и геморрагические кожные элементы.
Течение и прогноз волчаночного кожного поражения, особенно редких его вариантов, мало изучены в связи с недостатком соответствующих клинических наблюдений [19]. Особенно актуальным является уточнение взаимосвязей вариантов кожного поражения с вовлечением внутренних органов, в т. ч. поражением почек, наличие которого всегда является основанием для перехода от только местного лечения к более агрессивным терапевтическим методам [20]. Мультицентровое исследование, включившее 296 пациентов с системной красной волчанкой [21], показало, что проявления поражения почек (протеинурия, гематурия), наблюдавшиеся у обсуждаемой нами пациентов, являются наиболее значимым признаком, позволяющим дифференцировать кожный и системный варианты красной волчанки; определенное значение имеют также артралгии и наличие антинуклеарных антител в диагностических титрах (эти клинические и лабораторные феномены также были выявлены у нашей больной).
Сочетание нефротического и остронефритического синдромов, констатированное у демонстрируемой нами пациентки, свидетельствовало в пользу обострения волчаночного нефрита (при морфологическом исследовании ткани почки, полученной при биопсии, констатирован мезангиокапиллярный вариант его), персистирование или рецидив которого всегда отражает
неблагоприятный прогноз [22] и в связи с этим требует активной иммуносупрессивной терапии [23]. При исследовании биоптата почки были также выявлены признаки тромботической микроангиопатии, требовавшие целенаправленного исключения антифосфолипидного синдрома, наличие которого обосновало бы применение антикоагулянтов (низкомолекулярные гепарины, варфарин) [24]. Тем не менее серологических маркеров антифосфолипидного синдрома обнаружить не удалось.
C точки зрения купирования активности почечного процесса и уменьшения выраженности кожного поражения оказалась эффективной комбинация преднизолона с циклофосфамидом, примененных в сверхвысоких дозах, которая сегодня рассматривается в качестве одной из общепринятых подходов к индукционной терапии волчаночного нефрита [23]. Возможность эффективного воздействия на кожное и почечное поражение при системной красной волчанке с помощью иммуносупрессивных терапевтических стратегий еще раз свидетельствуют в пользу существования единых механизмов поражения этих органов. У мышей линии NZB/NZW, являющихся генетически детерминированной моделью системной красной волчанки, почти всегда в процессе развития болезни вовлекаются почки
и кожа, а характерной патогенетической чертой является гиперэкспрессия Т-лимфоцитами селезеночной тирозинкиназы. В свою очередь применение селективных ингибиторов ее позволяет уменьшить выраженность поражения почек и кожи, способствует увеличению выживаемости животных [25, 26]. В связи с этим с точки лечения системной красной волчанки, протекающей с активным волчаночным нефритом и тяжелым поражением кожи, особенно редкими его вариантами, аналогичными наблюдаемым у нашей больной, особую привлекательность привлекает использование селективных иммуносупрессивных стратегий.
Микофеноловая кислота (микофенолат мофетил или микофенолат натрия) рассматривается в качестве препарата первого ряда для поддерживающей терапии пролиферативных форм волчаночного нефрита (один из его вариантов наблюдается у обсуждаемой нами больной) и характеризуется не только достаточной эффективностью, но и очень хорошей переносимостью [23, 27]. Так, мультицентровое исследование MMF in Induction Therapy for Active Lupus Nephritis in Mainland China Study Group [28], включившее 213 больных активным волчаночным нефритом (класса III, IV или V), показало, что 24-недельное применение комбинации микофенолата мофетила с преднизолоном
сопряжено с достижением ремиссии у 82,6 % пациентов, в т. ч. у 34,3 % полной и у 48,4 % частичной. Применение данной терапевтической схемы приводило к достоверному снижению протеинурии, креатининемии, нарастанию альбуминемии и клиренса эндогенного креатинина, одновременно уменьшилась активность системной красной волчанки по шкале SLEDAI. Результаты клинических исследований, опубликованные в последние годы, свидетельствуют о том, что микофенолат мофетил и циклофосфамид по эффективности одинаковы с точки зрения влияния на протеинурию и креатининемию при применении в качестве индукционной терапии волчаночного нефрита V класса [29]. Cистематизированный обзор с мета-анализом, выполненный Z. Touma et al. (2010) [30] и
включивший 4 клинических исследования (суммарно – 618 больных), показал, что микофенолата мофетил не уступает циклофосфамиду с точки зрения способности индуцировать и поддерживать почечную ремиссию, но заметно превосходит его по переносимости, достоверно реже приводя к алопеции и аменорее.
Крупное контролируемое клиническое исследование [31], в которое были включены 370 пациентов с активным волчаночным нефритом III, IV или V классов, рандомизированных к приему микофенолата мофетила (таргетная доза – 3 мг/сут) или циклофосфамида (0,5–1,0 мг/м2/мес.) в сочетании с преднизолоном в течение 24 недель, продемонстрировало, что данные терапевтические схемы позволяют добиваться не только снижения активности почечного процесса, но и поражения кожи, слизистых, а также сердечно-сосудистой системы. Постепенно накапливается опыт лечения с помощью
микофеноловой кислоты и волчаночного поражения кожи. S. Schanz et al. (2002) [32] добились ремиссии распространенного кожного процесса у двух больных, у которых оказались неэффективными ранее примененные преднизолон, азатиоприн и препараты 4-аминохинолинового ряда. Открытое
пилотное клиническое исследование, в котором микофенолат натрия (1440 мг/сут) применяли в течение 3 месяцев при волчаночном кожном поражении, показало, что с его помощью можно достичь существенного снижения характеризующего тяжесть кожного процесса индекса СLASI (индекс площади и тяжести волчаночного кожного поражения). Применение микофеноловой кислоты у представленной нами больной в качестве поддерживающей терапии, таким образом, представляется перспективным как с точки зрения контроля активности почечного процесса, так и для управления кожным поражением (необходимо подчеркнуть, что альтернативные терапевтические стратегии, в т. ч. ингибиторы кальцинейрина, сами по себе могут приводить к эрозивному поражению кожи и слизистых оболочек).
Обсуждаемое нами наблюдение призвано продемонстрировать полифорфизм кожных проявлений системной красной волчанки, на протяжении определенного периода способных оставаться клинически ведущими и обусловливать ошибочную диагностику других заболеваний, в т. ч. поздней кожной порфирии. Своевременное выявление признаков вовлечения внутренних органов, прежде всего почек, и расшифровка их конкретных вариантов с помощью биопсии необходимы прежде всего потому, что, подтверждая наличие системной красной волчанки, они тем самым обусловливают отказ от терапевтических схем, используемых при поздней кожной порфирии, в пользу заведомо более эффективных иммуносупрессивных стратегий.



