Введение
В настоящее время во всех странах мира наблюдается стремительный рост популяции с избыточной массой тела, ожирением, сахарным диабетом 2 типа (СД2). Диабетическая нефропатия (ДН), как и сердечно-сосудистые осложнения, является наиболее частым, тяжелым и прогностически неблагоприятным осложнением СД. Результаты крупных популяционных исследований свидетельствуют о том, что у лиц с заболеваниями почек и особенно имеющих почечную недостаточность, риск сердечно-сосудистых заболеваний с формированием кардиоренального синдрома гораздо выше, чем в общей популяции [1]. Наиболее отчетливо это проявляется у больных, получающих заместительную почечную терапию. Концепция кардиоренального синдрома подразумевает общность механизмов развития
сердечно-сосудистых и почечных осложнений [2–5]. Вклад почечной патологии в развитие кардиоренального синдрома наиболее изучен при СД 1 типа [6]. Проблема формирования кардиоренального синдрома при СД2 остается не до конца решенной. Так, в настоящий момент не вызывает сомнений влияние ожирения на течение нефропатий разного генеза и процессы ремоделирования миокарда левого желудочка (МЛЖ)
[7, 8]. Требуют уточнения взаимосвязи развития ранних стадий ДН, ремоделирования миокарда и ожирения при СД2. Не уточнены значение гормональной активности жировой ткани, роль метаболических и гемодинамических расстройств, ассоциированных с ожирением в формировании кардиоренального синдрома у больных СД2. Целью настоящего исследования явилось изучение взаимосвязи процессов ремоделирования МЛЖ с ожирением и развитием ДН у больных СД2 в рамках
кардиоренального синдрома.
Материал и методы
В исследование включены 84 больных СД2, наблюдавшихся в ФГУ “Эндокринологический научный центр” Минздравсоцразвития России, из них 38 мужчин и 46 женщин в возрасте от 39 до 70 лет.
Диагноз СД2 устанавливали в соответствии с рекомендациями ВОЗ (1998). В исследование не включили больных с выраженными стадиями ДН (со скоростью клубочковой фильтрации [СКФ] < 60 мл/мин/м2, протеинурией более 2 г/сут), с выраженными стадиями хронической сердечной недостаточности (III, IV ФК – в соответствии с рекомендациями ВНОК и ОССН по диагностике и лечению хронической сердечной недостаточности), больных с единственной почкой, гемодинамически значимыми стенозами сосудов почек, первичным поражением почек в рамках системных заболеваний соединительной ткани, хроническим гломерулонефритом, онкологическими заболеваниями.
Всем больным определены индекс массы тела (ИМТ), окружность талии (ОТ), окружность бедер (ОБ), соотношение ОТ/ОБ. В сыворотке крови, взятой натощак после 14-часового голодания, оценен уровень общего холестерина (ОХС), триглицеридов (ТГ), холестерина липопротеидов высокой (ЛПВП)
и низкой плотности (ЛПНП), креатинина, мочевой кислоты. Гликированный гемоглобин (НbА1с) определен методом высокоэффективной жидкостной хроматографии.
Таблица 1. Характеристика исследованных групп больных без ожирения (ИМТ < 30 кг/м2)
и с ожирением (ИМТ ≥ 30 кг/м2) при длительности СД2 менее и более 5 лет.
Уровень гормонов жировой ткани в сыворотке крови определен иммуноферментным методом: лептин – наборами фирмы Diagnostics Biochem (Канада), адипонектин – наборами фирмы Bio Vendor (Чехия).
Поражение почек оценено по уровню СКФ и альбуминурии. Расчет СКФ осуществлен по формуле Кокрофта–Голта с коррекцией на стандартную поверхность тела (1,73 м2). Определение уровня экскреции альбумина с мочой за сутки проведено методом иммунотурбидиметрии. В зависимости от уровня альбуминурии выделены нормоальбуминурия, микроальбуминурия и протеинурия. Нормоальбуминурия диагностирована при уровне альбумина < 30 мг в суточной моче, микроальбуминурия – при экскреции 30–299 мг альбумина за сутки, макроальбуминурия – при уровне альбуминурии ≥ 300 мг/сут.
Для оценки параметров геометрии МЛЖ и установления типа ремоделирования использовано эхокардиографическое исследование. Масса МЛЖ (ММЛЖ) рассчитана по формуле, рекомендованной Американским обществом эхокардиографии:
ММЛЖ (г) = 0,8 × [1,04 х (ТМЖП + ТЗСЛЖ + КДР) 3 – (КДР) 3] + 0,6; где
ТМЖП (мм) – толщина межжелудочковой перегородки,
ТЗСЛЖ (мм) – толщина задней стенки ЛЖ, КДР (мм) – конечный диастолический размер.
Индекс ММЛЖ (ИММЛЖ) определен по формуле: ИММЛЖ (г/м2) = ММЛЖ/площадь поверхности тела (BSA). Для расчета BSA использована формула Дюбуа: BSA (м2) = 0,007184 × вес 0,425 × рост 0,725, где вес в кг, рост в см.
Индекс относительной толщины стенки (ИОТ) ЛЖ рассчитан по формуле: ИОТ = (ТМЖП+ТЗСЛЖ)/КДР.
Гипертрофия МЛД диагностирована при ИММЛЖ > 125 г/м2 у мужчин и > 110 г/м2 у женщин. В зависимости от величины ИММЛЖ и ИОТ были выделены следующие модели геометрии ЛЖ сердца: нормальная геометрия (ИОТ < 0,42; нормальный ИММЛЖ); концентрическое ремоделирование (ИОТ
≥ 0,42; нормальный ИММЛЖ); концентрическая гипертрофия (ИОТ ≥ 0,42; ИММЛЖ больше нормы); эксцентрическая гипертрофия (ИОТ < 0,42; ИММЛЖ больше нормы).
Статистический анализ проведен с использованием пакета программ SPSS for Windows, версия 9. Результаты представлены в виде средних значений ± стандартное отклонение исследуемых показателей в группе, медиан, 25 и 75 процентилей. Для изучения взаимосвязи между показателями применен метод корреляции Спирмена. При оценке достоверности различий двух групп использован метод Манна–Уитни. При сравнении частотных показателей для оценки достоверности различий
применен критерий χ2-квадрат по Пирсону. Достоверным считался уровень р < 0,05, при 0,05 ≤ р < 0,10 говорили о наличии тенденции.
Результаты и обсуждение
В настоящем исследовании была оценена взаимосвязь эхокардиографических признаков поражения МЛЖ (проявляющихся на начальных стадиях концентрическим ремоделированием миокарда с последующим развитием гипертрофии) с наличием ожирения и частотой поражения почек у больных СД2. Поскольку точное начало развития СД2 установить, как правило, не удается и длительность СД является мощным фактором развития осложнений СД, мы отдельно анализировали группы больных с длительностью СД менее и более 5 лет. В зависимости от ИМТ выделены группы больных без ожирения (с ИМТ < 30 кг/м2) и с ожирением (с ИМТ ≥ 30 кг/м2). Исследуемые группы с ожирением и без ожирения при длительности СД как менее 5, так и более 5 лет были сопоставимыми по возрасту, длительности СД и степени компенсации углеводного обмена. Характеристика групп представлена в табл. 1.
При сравнении групп больных СД2 с ожирением (ИМТ ≥ 30 кг/м2) и без ожирения (ИМТ < 30 кг/м2) при длительности СД более 5 лет признаки гипертрофии миокарда чаще присутствовали в группе больных с ожирением: 53 и 32 % соответственно (рис. 1). При длительности СД менее 5 лет различия не определялись.
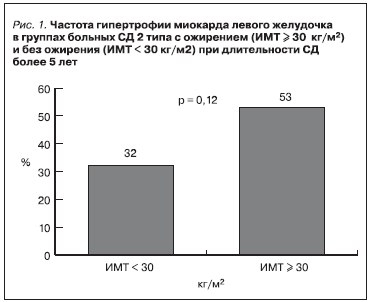
Данные корреляционного анализа свидетельствовали о наличии взаимосвязи гипертрофии миокарда с ожирением: положительные корреляционные взаимосвязи ИММЛЖ с ИМТ (r = 0,304, р = 0,025), ОТ (r = 0,360, р = 0,007), ОБ (r = 0,304, р = 0,025).
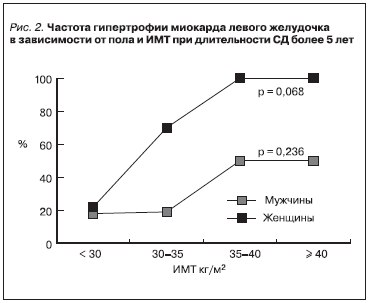
Частота гипертрофии ЛЖ при длительности СД более 5 лет зависела от степени ожирения, причем выявлены различия у мужчин и женщин: у женщин гипертрофия миокарда развивалась чаще (рис. 2).
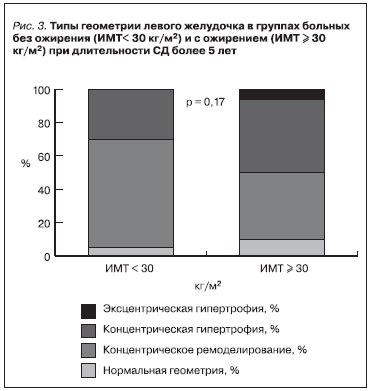
При оценке типа геометрии сердца в группе больных СД2 с ожирением наиболее часто отмечалось формирование концентрической гипертрофии миокарда – порядка 50 % и в 3 % случаев – эксцентрической гипертрофии. В группе больных без ожирения преимущественно развивалось концентрическое ремоделирование миокарда – в 63 % случаев (рис. 3). При определении взаимосвязи процессов ремоделирования МЛЖ с развитием поражения почек при длительности СД2 более 5 лет по мере нарастания тяжести ДН увеличивалась частота концентрической гипертрофии миокарда, при этом уменьшалась частота концентрического ремоделирования. Так, в группе больных с НАУ частота концентрического ремоделирования составляла 55 %, концентрической гипертрофии – 37 %,
при появлении МАУ частота концентрического ремоделирования составляла 45 %, концентрической гипертрофии – 44 %, при появлении ПУ частота концентрического ремоделирования 33 % и гипертрофии – 50 % (рис. 4).
Данные корреляционного анализа также свидетельствуют о взаимосвязи гипертрофии миокарда с развитием ДН: установлена взаимосвязь индекса массы миокарда с уровнем альбуминурии (r = 0,455 p = 0,009).
 30 кг/м2) при длительности СД более 5 лет" width="369" height="391" />
30 кг/м2) при длительности СД более 5 лет" width="369" height="391" />
При оценке факторов, связанных с развитием гипертрофии миокарда помимо антропометрических показателей значимыми оказались уровень мочевой кислоты в сыворотке крови и НАb1с, что отражает тесную взаимосвязь расстройств пуринового и углеводного обменов с ожирением и процессами ремоделирования миокарда. Учитывая данные экспериментальных исследований, свидетельствующих о влиянии гормональной активности жировой ткани, в частности уровней лептина и адипонектина, на процессы ремоделирования миокарда, мы также анализировали данные показатели. Однако достоверных взаимосвязей уровней лептина и адипонектина с выраженностью гипертрофии миокарда не установлено (табл. 2).
Таким образом, нами выяснено, что в группе больных СД2 с ожирением (ИМТ ≥ 30 кг/м2) при длительности СД более 5 лет чаще развивается гипертрофия миокарда – в 53 % случаев, тогда
как в группе больных без ожирения (ИМТ < 30 кг/м2) частота гипертрофии миокарда составляет 32 %. В пользу взаимосвязи ожирения и выраженности гипертрофии миокарда при длительности СД более 5 лет также свидетельствуют данные корреляционного анализа: положительные корреляционные взаимосвязи ИММЛЖ с ИМТ (r = 0,304, р = 0,025), ОТ (r = 0,360, р = 0,007), ОБ (r = 0,304, р = 0,025). Наши результаты подтверждаются данными крупных популяционных исследований (Framingham Heart
Study, Tromso Study), где было продемонстрировано, что ИМТ является независимым предиктором гипертрофии ЛЖ [8–10]. Механизмы формирования гипертрофии ЛЖ при ожирении в настоящее время активно изучаются [11–13].
Рисунок 4. Типы геометрии левого желудочка в зависимости от уровня альбуминурии при длительности СД более 5 лет.
Таблица 2. Взаимосвязь факторов риска ДН и ИММЛЖ при длительности СД более 5 лет.
При оценке возможных факторов развития гипертрофии миокарда по данным корреляционного анализа нами установлена положительная корреляционная взаимосвязь ИММЛЖ и уровня мочевой кислоты (r = 0,446, р = 0,01). Вопрос о кардиотоксичности гиперурикемии до сих пор остается открытым, поскольку в литературе имеются противоречивые данные о взаимосвязи уровня мочевой кислоты и сердечно-сосудистого риска. Так, по данным исследований Framingham Heart Study, ARIC, SHEP, связь между гиперурикемией, сердечно-сосудистой заболеваемостью и смертностью не была достоверной, в других исследованиях, NHANES I, Honolulu Heart Program, обнаружена достоверная
взаимосвязь между уровнем мочевой кислоты и коронарной смертностью. В этих работах показано, что повышение уровня мочевой кислоты на 1 мг% (60 мкмоль/л) увеличивает частоту сердечно-сосудистых осложнений в среднем на 10 % [11]. В ряде работ выявлена достоверная прямая связь между уровнем урикемии и гипертрофии ЛЖ [14–16]. Механизмы кардиотоксичности гиперурикемии в настоящее время остаются невыясненными. Обсуждается наличие ускоренного атерогенеза при гиперурикемии, связанного с усилением окисления ЛПНП и перекисного окисления липидов, стимуляцией синтеза цитокинов, активацией процессов агрегации тромбоцитов. Среди гуморальных факторов, стимулирующих рост кардиомиоциов и миокардиальных фибробластов при ожирении, наибольшее значение придается симпатической нервной, ренин-ангиотензин-альдостероновой системам,
а также инсулину и инсулиноподобным факторам роста [17–20]. Кроме того, в условиях эксперимента исследователями доказано прямое влияние лептина на процессы роста кардиомиоцитов, формирование гипертрофии и обратное действие адипонектина [21, 22]. Адипонектин ингибировал
ряд ферментов, тем самым препятствуя воздействию факторов роста на кардиомиоциты. Для оценки влияния адипонектина на формирование гипертрофии миокарда в Японии проведено эпидемиологическое исследование, куда были включены 2839 мужчин, не получавших антигипертензивную терапию регулярно. Гипертрофия миокарда была диагностирована в 16,7 % случаев с помощью электрокардиографических критериев Соколова–Лайона. По данным регрессионного анализа снижение адипонектина было ассоциировано с развитием гипертрофии миокарда [23]. В исследованиях, проведенных на здоровых добровольцах, выявлена также обратная взаимосвязь уровней общего адипонектина и высокомолекулярного адипонектина с ММЛЖ; снижение адипонектина являлось независимым фактором риска увеличения массы миокарда [24, 25]. Однако в группе обследуемых нами больных СД2 взаимосвязей индекса массы миокарда с уровнями лептина
и адипонектина не обнаружено, что, возможно, объясняется малой выборкой больных и обусловливает необходимость проведения дополнительных исследований.
По данным нашего исследования, имелись различия в частоте развития гипертрофии ЛЖ у мужчин и женщин: гипертрофия у женщин развивалась достоверно чаще и при ИМТ более 35 кг/м2, составляла 100 %, тогда как у мужчин – около 50 %. В большинстве крупных исследованиях получены аналогичные данные, свидетельствующие о более высокой частоте развития
гипертрофии ЛЖ у женщин. Причины подобных различий в настоящее время остаются не вполне ясными [8, 26].
При оценке взаимосвязи процессов ремоделирования МЛЖ с развитием поражения почек при С2 по мере нарастания тяжести ДН увеличивалась частота концентрической гипертрофии миокарда, при этом уменьшалась частота концентрического ремоделирования. Так, в группе больных с НАУ
частота концентрического ремоделирования составляла 55 %, концентрической гипертрофии – 37 %; при появлении МАУ частота концентрического ремоделирования составляла 45 %, концентрической гипертрофии – 44 %; при появлении ПУ частота концентрического ремоделирования – 33 % и гипертрофии – 50 %. Аналогичные результаты, указывающие на существование тесной взаимосвязи ММЛЖ и альбуминурии были получены A. Salmasi et al. (2003), при этом в данном исследовании был исключен фактор артериальной гипертензии (АГ) [27]. Кроме того, в популяционном исследовании Strong Heart
Study, куда были включены 1299 больных СД2 без признаков ишемической болезни сердца, доказана взаимосвязь между выраженностью гипертрофии ЛЖ, уровнем альбуминурии и фибриногена [28].
В настоящее время ведущую роль в развитии кардиоренального синдрома придают генерализованной эндотелиальной дисфункции, характерной для ожирения. В частности, доказано, что адипоциты активно продуцируют ингибитор активатора плазминогена типа 1 (PAI-1) [29]. Кроме того,
локально в почке при ожирении также происходят процессы дисфункции эндотелия за счет формирования гломеруломегалии, повышения внутриклубочкового давления, развития гиперфильтрации, что сопровождается выработкой различных молекулярных медиаторов, обладающих системными эффектами [30]. Вероятно, именно развитие генерализованной эндотелиальной дисфункции при ожирении способствует раннему развитию кардиоренального синдрома у больных СД2. Однако необходимы дополнительные исследования для уточнения патогенетических механизмов развития кардиоренального синдрома в этой группе больных. Таким
образом, можно констатировать, что при СД2 ожирение способствует развитию ремоделирования миокарда и раннему формированию кардиоренального синдрома, что обусловлено общностью факторов риска развития ДН и ремоделирования миокарда. В основе развития кардиоренального синдрома при СД2 и ожирении лежит генерализованная эндотелиальная дисфункция.



