В 1869 г. F. Jaccоud описал развитие деформирующего артроза суставов кистей у больного, страдавшего повторными атаками ревматизма и пороком сердца. В последующем деформирующую
артропатию (ДА), получившую название “артропатия Жаку” (АЖ), наблюдали не только среди больных хронической ревматической лихорадкой [1–6], но и среди пациентов с системной красной волчанкой (СКВ) [7], дерматомиозитом, синдромом Элерса–Данло [8], синдромом Шарпа [9], при некоторых других
наследственных и приобретенных патологиях [10, 11].
E. Bywaters (1950, 1975), проанализировав опубликованные описания АЖ и 4 собственных наблюдения (одно вероятное и 3 возможных) выделил основные черты постревматической ДА: последняя встречается среди больных с рецидивирующими ревматическими атаками, наличием хореи, поражением сердца, ответом на салицилаты; выздоровление обычно медленное, сохраняется тугоподвижность метакарпофаланговых суставов, которые в ряде случаев подвергаются деформации,
обусловленной не артритом, а периартикулярными и фасциальными изменениями; заболевание протекает торпидно с нормальной СОЭ, нерезко выраженными болями в суставах и на ранней стадии с нормальной их функцией [6, 13]. На основании сформулированных и частично модифицированных критериев A. Weintraub (1962) [14] и N. Zvaifler (1963) [15] описали несколько случаев АЖ. В России ДА при ревматизме и других системных заболеваниях наблюдали А.И. Нестеров, И.Е. Сперанская, А. Орлов-Морозов, Ю.И. Новиков и И.М. Чипигина, а также А.В. Пилипенко и Г.П. Слободняк, Н.А. Шостак и др. [4, 15–19].
При АЖ, поражающей главным образом суставы кистей и существенно реже стоп, развивающиеся изменения напоминают кисть при ревматоидном артрите с типичной ульнарной девиацией, деформацией пальцев по типу “шеи лебедя”, подвывихами межфаланговых и пястнофаланговых суставов и межкостной мышечной атрофией, характерной Z-образной деформацией большого пальца. В отличие от ревматоидного артрита при АЖ практически не наблюдается эрозивного повреждения суставного хряща.
Среди больных СКВ АЖ имеет место в 5–15 % случаев [7, 20–22], однако в литературе чаще всего приводятся описания отдельных случаев суставных изменений, что свидетельствует о недостаточном знакомстве врачей с этой патологией.
Приводим наше наблюдение молодой женщины, страдавшей более 10 лет СКВ, у которой АЖ развилась в дебюте заболевания, но была диагностирована лишь практически одновременно с началом заместительной почечной терапии.
У больной Р. – жительницы Подмосковья 1983 года рождения в возрасте 19 лет (2003) появились высокая лихорадка, боли в суставах, эритема на лице в виде бабочки. Первоначально была диагностирована левосторонняя пневмония, однако после дополнительного обследования установлен диагноз СКВ и начато лечение преднизолоном (60 мг/сут) с последующим снижением дозы. От предложенной терапии циклофосфамидом и азатиоприном больная отказалась. Выписана на поддерживающей дозе преднизолона (20 мг/сут), который нерегулярно принимала в течение 3 лет в отсутствие врачебного контроля. Периодически при усилении болей в суставах и появлении мышечной слабости самостоятельно повышала дозу преднизолона до 45 мг/сут. В тот период обратила внимание на деформацию кистей, однако в целом оценивала свое состояние как удовлетворительное, продолжала работать, изменения в анализах мочи, по словам больной, отсутствовали. Через 3 года
после начала заболевания впервые появились отеки, одышка, протеинурия (0,99 г/л). Была госпитализирована в Институт ревматологии и в дальнейшем переведена в отделение нефрологии ГКБ им. С.П. Боткина Департамента здравоохранения г. Москвы.
В стационаре активность СКВ подтверждена данными иммунологического обследования (положительные LE-клетки, титр анти-ДНК-антител 1 : 50, АФН – 1/165). На основании обнаружения антител к фосфолипидам диагностирован антифосфолипидный синдром (АФС), при биопсии почки выявлен очаговый фибропластический гломерулонефрит, протекавший без нарушения азотовыделительной функции почек. Обращено внимание на деформацию кистей рук.
Проведено три сеанса “пульс”-терапии циклофосфамидом и пять – метилпреднизолоном, при этом доза перорально принимаемого преднизолона из-за признаков гиперкортицизма была снижена до 20 мг/сут. В дальнейшем к лечению добавлены селлсепт (2,0 г/сут) и варфарин, однако полной клинической и
иммунологической ремиссии добиться не удалось и через год (2007) впервые выявлено повышение креатинина сыворотки до 148 мкмоль/л при небольшой протеинурии (до 0,6 г/л). При денситометрии зарегистирировано развитие остеопороза. Еще через полтора года на фоне нерегулярной иммуносупрессивной терапии отмечено повышение АД до 200/100 мм рт. ст. и при очередной (третьей) госпитализации в ГКБ им. С.П. Боткина креатинин сыворотки был уже 459 мкмоль/л. При повторной
биопсии почки выявлена картина диффузного склерозирующего гломерулонефрита в сочетании с тромботической микроангиопатией (ТМА), что наряду с нефросклерозом, по-видимому, явилось основной причиной ухудшения функции почек. На фоне антикоагулянтной терапии креатинин снизился до 416 мкмоль/л, однако при усугублении артериальной гипертензии и в связи с операцией по поводу гнойного гайморита вновь возрос до 940 мкмоль/л. Больной на левом предплечье была
сформирована артериовенозная фистула и начато лечение программным гемодиализом.
Суставной синдром сопровождал больную с самого начала заболевания, и его интенсивность лишь частично уменьшалась на фоне терапии преднизолоном. Помимо болей в суставах кистей больную постоянно беспокоила утренняя и вечерняя скованность (приходилось “разминать” кисти). Постепенно
нарастающая деформация привела к образованию ревматоидоподной кисти (рис. 1), в то время как эрозивных изменений суставов не обнаружено (рис. 2). Боли и деформация кистей прогрессировали в первые 6 лет заболевания, а последние 3 года суставы больную не беспокоили и деформация не усугублялась. Таким образом, ДА развилась у больной в первые несколько лет заболевания на фоне сохраняющейся, несмотря на лечение, активности СКВ. Суставной синдром является первым (у 40 %) и наиболее частым (в 97 %) проявлением СКВ [3, 7, 23–25]. Боль и скованность в суставах у больных СКВ встречаются чаще, чем артриты, которые, как правило, носят мигрирующий характер и являются обратимыми, но в ряде случаев хронический воспалительный процесс в суставах приводит к развитию
тендинитов и тендовагинитов с формированием первоначально вправляемых подвывихов межфаланговых и пястнофаланговых суставов, ульнарной девиации. В дальнейшем сгибательные
контрактуры пальцев становятся необратимыми, являясь причиной нарушения функции кисти [26].
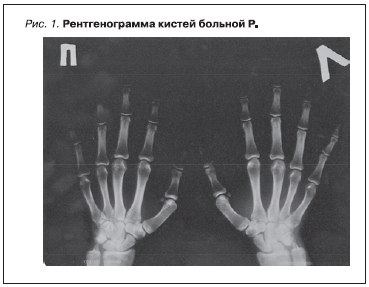
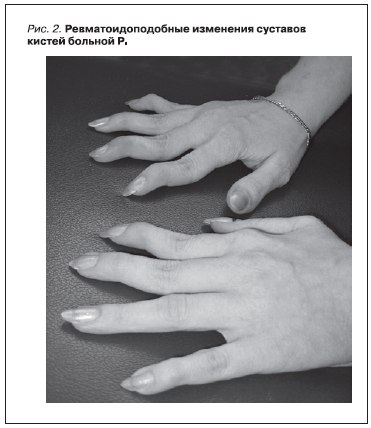
Из 300 больных СКВ, наблюдавшихся в Институте ревматологии, ДА выявлена в 20 % [23], причем у части пациентов вследствие фиброзирования крупных сухожилий наблюдались их разрывы. У всех больных АЖ отмечены стойкая ульнарная девиация, ограничение разгибания в пястнофаланговых суставах, деформация пальцев кисти.
При рентгенологическом обследовании суставов у больных СКВ не обнаруживается изменений, характерных для ревматоидного артрита [24, 25]. В большинстве случаев на рентгенограммах кистей выявляются околосуставной или распространенный остеопороз, умеренное сужение суставной щели, подвывихи межфаланговых и пястнофаланговых суставов. Только в 1–5 % случаев обнаружены немногочисленные мелкие поверхностные эрозии костей в дистальных межфаланговых суставах кистей, но костного анкилоза не выявлено ни разу [29–31].
При магнитно-резонансной томографии на фоне минимальных костных повреждений выявляются изменения мягких тканей: их набухание, отек, пролиферативный теносиновит и гипертрофия синовиальной оболочки [24]. Рецидивирующие синовиты не приводят к формированию паннуса, как при ревматоидном артрите [32]. При гистологическом исследовании в синовиальной оболочке при СКВ не отмечается заметной клеточной пролиферации, а обнаруживаются признаки подострого синовита – отложения фибрина, гематоксилиновые тельца, небольшая клеточная пролиферация, микрососудистые изменения [24]. Согласно J. Bleifeld и A. Inglis (1974), деформация кистей, как и у наблюдавшейся пациентки, намного быстрее возникает на фоне постоянной активности СКВ [26].
R. Derksken et al. (1993) [8] отметили зависимость между АФС и развитием ДА [24, 31]. Предполагается, что васкулопатия с преимущественным поражением мелких сосудов, присущая АФС, играет важную роль в патогенезе периартикулярного фиброза, однако роль АФС в развитии ДА признается далеко
не всеми исследователями. В сыворотке больной постоянно обнаруживались IgG и IgM к фосфолипидам, и она регулярно принимала аспирин.
Данные D. Alarcon-Segovia et al. (1988) [33] и M. Cohen et al. (1998) свидетельствуют, что у больных СКВ с ДА в крови нередко обнаруживается ревматоидный фактор [14, 34]. У пациентов с СКВ с повышенным титром ревматоидного фактора часто наблюдаются костные эрозии, что затрудняет дифференциальный диагноз между СКВ и ревматоидным артритом. М.М. Иванова и соавт. (1983) [35] приводят основные отличия ДА при СКВ от поражения суставов кистей при ревматоидном артрите (см. таблицу).
Таблица. Основные отличия деформирующей артропатии.
АЖ протекает обычно доброкачественно и не усугубляется при уменьшении дозы или отмене преднизолона, что нередко сопровождается существенным нарастанием активности СКВ. У наблюдавшейся больной основной причиной развития ДА, по-видимому, являлась персистирующая активность СКВ. Последние 3 года с развитием почечной недостаточности активность СКВ снизилась и больную перестали беспокоить боли в суставах. В настоящее время получает поддерживающую
терапию преднизолоном (10 мг/сут), регулярно проводятся процедуры гемодиализа. Несмотря на выраженную деформацию кистей, способна к самообслуживанию.



