Особенность нефротического синдрома у детей заключена в том, что НС с минимальными изменениями в 95 % случаев чувствителен к лечению кортикостероидами. При стероидчувствительном НС (СЧНС) биопсия почки не показана, т. к. очевидно, что у 80 % пациентов почечный процесс представлен болезнью минимальных изменений [1]. При наличии таких признаков, как гематурия, снижение функций почек, персистирование НС или протеинурии, после 6-недельного терапевтического курса глюкокортикостероидами устанавливается диагноз стероидрезистентного НС (СРНС) и тогда следует предполагать, более неблагоприятный вариант гломерулярного заболевания: при биопсии почки при этом нередко выяляется фокально-сегментарный гломерулосклероз (ФСГС) [2]. Результаты исследований последних лет свидетельствуют, что ФСГС остается ведущей причиной НС для взрослых и основной причиной СРНС для детей; ФСГС составляет до 15 % всех случаев НС у детей, при этом отмечается рост частоты ФСГС по всему миру [3, 4]. Один из важных компонентов патогенеза ФСГС – подоцитарная дисфункция. Известно, что подоциты могут повреждаться вследствие механического растяжения [3, 5, 6], воздействия вирусной инфекции, токсинов [7], иммунологических факторов, при митохондриопатиях [8, 9], мутациях генов, кодирующих белки подоцитов [3].
К настоящему моменту установлены мутации в следующих генах, кодирующих белки подоцитов: NPHS1 (нефрин), NPHS2 (подоцин), АСТ4 (α-актинин-4), PLCE1 (фосфолипаза C эпсилон), WT1, SMARCAL и др., клинически протекающие с врожденным или инфантильным СРНС [10, 11]. В 2004 г. нефропатологами принята Колумбийская классификация [4], при которой различают пять вариантов ФСГС: верхушечный
(tip-lesion), перихилярный, клеточный, коллабирующий (коллабирующая нефропатия) и типичный (not otherwise specified), которые различаются патогенезом, клиническими проявлениями и прогнозом.
Материал и методы
В исследование были включены 53 пациента с НС, для 46 (86,8 %) он был стероидрезистентным. Детям с СРНС была выполнена биопсия почки.
Исследования проводились на базе нефрологического отделения Республиканской детской клинической больницы “Аксай”. Биопсия почки проведена всем детям и подросткам в операционной
комнате под общим наркозом или местной анестезией в условиях асептики, в положении пациента лежа на животе с валиком под эпигастрием с целью выведения почки из-под реберной дуги. Обычно биопсировалась левая почка. С целью локализации нижнего полюса использовался УЗ-аппарат ALOKA SSD-500 с конвексным датчиком, на который был надет пунктурный адаптер, необходимый для направления биопсийной иглы. Применялся биопсийный пистолет GTA (Gallini, Италия) с иглами длиной
20–25 см и диаметром 16–18 gauge. В месте биопсии проведена анестезия лидокаином, после чего под острым углом вводилась биопсийная игла. По достижении иглой капсулы почки проведен небольшой прокол последней с последующим нажатием на затвор биопсийного пистолета. Обычно получали 2–3 столбика коркового слоя почки длиной 1–2 см, толщиной 1 мм, помещенных в растворы 4 %-ного забуференного формалина и 2,5 %-ного глютаральдегида. Морфологическое исследование почечного биоптата включало три необходимых исследования: световую, иммунофлюоресцентную и электронную микроскопии, проведенных нефропатологами А.В. Сухановым (Москва), О.А. Воробьевой (Санкт-Петербург).
Наиболее частой причиной НС для наших пациентов (19; 35,8 %) был ФСГС, реже встречались люпус-нефрит (ЛН) – у 13 (24,5 %), мембранопролиферативный гломерулонефрит (МПГН) – у 8 (15,1 %), болезнь минимальных изменений – у 7 (13,2 %), IgA-нефропатия – у 4 (7,6 %) и амилоидоз – у 1 (1,9 %). Все дети относились к казахской национальности.
Девятнадцати детям по результатам нефробиопсии диагностирован ФСГС. Мальчиков было 8, девочек – 11; возраст к моменту проведения биопсии почки – 10,9 года (1,4–17,0 лет). У 14 детей НС был
первично-резистентный, у 5 – вторично-резистентный. Основными клиническими параметрами, характеризующими тяжесть течения и прогноз при ФСГС, являются протеинурия и скорость клубочковой фильтрации (СКФ). У наших пациентов протеинурия в дебюте составила в среднем 7,8 ± 3,5 г/с (1,4–16,0 г/с), СКФ – 79,7 ± 22,6 мл/мин (31–110 мл/мин). НС у 11 (57,9 %) детей протекал в сочетании с персистирующей микрогематурией (у 5 детей в дебюте макрогематурия), у 5 (26,3 %) – с артериальной гипертензией. Среднее артериальное давление у детей составило 114/72 мм рт. ст. У остальных 7 (36,8%) детей наблюдался НС в чистом виде. Таким образом, у большинства пациентов с ФСГС и НС имели место микрогематурия и/или артериальная гипертензия, у 2 детей – вирусный гепатит В, фаза интеграции; у 1 ребенка – антитела к цитомегаловирусной инфекции.
Результаты и обсуждение. Варианты морфологических изменений при ФСГС у детей с НС представлены в табл. 1.
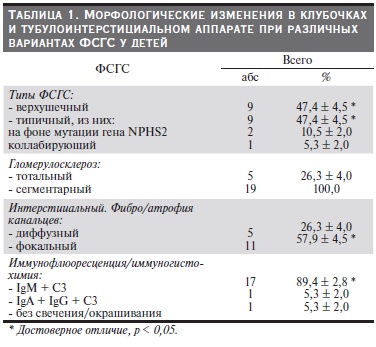
При морфологическом исследовании тотально склерозированные клубочки встречались у 5 (26,3 %) пациентов: у 1 – с коллабирующим вариантом (28 % клубочков), у 2 – с верхушечным вариантом (25 % клубочков) и 2 с типичным вариантом на фоне мутаций генов подоцитов (33 % клубочков). Сегментарный гломерулосклероз встречался у всех пациентов в среднем в 32 % клубочков, при этом у ребенка с коллабирующим вариантом ФСГС он встречался во всех сохранившихся помимо тотально
склерозированных 72 % клубочков.
С одинаковой частотой у наших пациентов встречались верхушечный и типичный варианты – по 9 детей (по 47,4 %, p < 0,05). Ни у одного из детей с верхушечным вариантом диффузных атрофии канальцев и интерстициального фиброза не отмечено, 5 детей страдали фокальным незначительным интерстициальным фиброзом с атрофией канальцев. По иммунофлюоресценции отмечено типичное свечение IgM + C3 в зонах склероза у всех детей, редко – в зоне мезангия, свободной от склероза. При электронномикроскопическом исследовании отмечены солидификация (сегментарный коллапс капиллярных петель клубочка) в зоне сегментарного склероза, фокальное расплавление ножек подоцитов, набухание цитоплазмы с их микровиллезной трансформацией. Интересен тот факт, что верхушечный вариант отмечен у всех 5 детей с вторично-резистентным НС. НС был “чистым” у восьми
детей, и только один ребенок страдал артериальной гипертензией и гематурией. Средняя СКФ у детей данной группы составила 73,8 ± 21,5 мл/мин, протеинурия в дебюте – 9,0 ± 4,5 г/с.
Типичный вариант, как показано выше, отмечен у 9 (47,4 %, p < 0,05) детей. При этом интерстициальный фиброз с атрофией канальцев диффузного характера был у 3 детей, фокального
характера – также у 3. По иммунофлюоресценции среди детей данной группы отмечено свечение IgM + C3 у 4 и отсутствие всякого свечения – у 2. Двое из данной подгруппы, как было установлено позже, имели мутации генов подоцитов WT1 (1 ребенок) и NPHS2 (1 ребенок). У этих детей отмечены распро-
страненный, диффузный интерстициальный фиброз и атрофия канальцев. При иммунофлюоресцентном исследовании свечения иммунных комплексов не отмечено. Электронная микроскопия не отличалась от таковой при других вариантах ФСГС. Как по морфологическим, так и по клиническим проявлениям типичный вариант ФСГС занимал среднее положение, т. е. был несколь-
ко тяжелее, чем верхушечный вариант ФСГС. У всех детей с типичным вариантом ФСГС НС протекал с микрогематурией без артериальной гипертензии; “чистого” НС не было. СКФ составила 88,9 ± 15,7 мл/мин, протеинурия в дебюте – 6,8 ± 3,2 г/с. Самый тяжелопротекающий (НС с артериальной гипертензией и почечной недостаточностью) и прогностически неблагоприятный коллабирующий вариант ФСГС имел место у 1 (5,3 %) ребенка.
Два других варианта ФСГС – клеточный и перихилярный – у наших пациентов не встречались. Это, вероятно, обусловлено редкостью и отсутствием четких критериев диагностики клеточного варианта, а также вторичностью перихилярного варианта, характерного для пациентов с длительной артериальной гипертензией, ожирением и диабетом, что среди детей встречается значительно реже, чем среди взрослых.
Таким образом, чаще всего при СРНС встречается ФСГС, который имеет несколько вариантов. Наиболее тяжелый – коллабирующий вариант, более легкий – верхушечный. Наблюдается корреляция между гломерулярным поражением и изменениями в тубулярном аппарате, а также клинико-морфологическая корреляция при разных вариантах ФСГС (табл. 2).
Таблица 2. Выраженность гломерулосклероза и тубулоинтерстициальных изменений при различных вариантах ФСГС.
Таблица 3. Клинико-функциональные показатели у больных НС с различными вариантами ФСГС.
Тотальный гломерулосклероз является исходом фокального и приводит к выпадению функции всего нефрона. Как видно из таблицы, распространенный тотальный гломерулосклероз наблюдался у всех больных НС на фоне мутаций генов подоцитов, единственного больного коллабирующим вариантом ФСГС с НС и у троих с типичным вариантом ФСГС с НС. Среди пациентов с верхушечным вариантом ФСГС с НС тотальный гломерулосклероз отмечен только у 1 с тотальным склерозом – 12 % клубочков. Аналогичная картина наблюдалась в отношении сегментарного гломерулосклероза. У всех детей с верхушечным вариантом отмечена позитивная иммунофлюоресценция на фракции комплемента С3 и IgМ, тогда как при типичном варианте такая картина наблюдалась у 2/3 пациентов, а при самых тяжелых вариантах – коллабирующем и генетически опосредованных – свечения не отмечено. Клиническая характеристика пациентов с ФСГС представлена в табл. 3.
Таким образом, наиболее частой причиной НС у обследованных нами пациентов был ФСГС – 19 (35,8%) человек, при этом верхушечный и типичный варианты встречались одинаково часто.
Прогностически неблагоприятный тотальный гломерулосклероз и диффузный интерстициальный фиброз встречались в основном при генетически обусловленном ФСГС. Следует отметить отсутствие у наших пациентов клеточного и перихилярного вариантов. Таким образом, ФСГС у детей казахской национальности чаще всего проявляется клинически в виде нефротического синдрома, морфологически – в виде верхушечного и типичного вариантов.
АГ и гематурия при НС являются предикторами неблагоприятного прогноза, свидетельствующими о более тяжелом поражении почек. Это четко демонстрировалось на детях с верхушечным вариантом ФСГС, у которых имел место чистый НС. Гематурия отмечена у всех детей с типичными вариантами ФСГС и НС, артериальная гипертензия с гематурией – у детей с коллабирующим вариантом и генетически обусловленными вариантами ФСГС, т. е. наиболее тяжелыми формами НС с ФСГС. Это подтверждено главным показателем тяжести заболевания – показателем СКФ, сохранной у более чем половины детей с верхушечным и типичным вариантами, и несколько сниженной у остальных, тогда как при коллабирующем и генетическом вариантах СКФ была значительно снижена у половины детей и умеренно снижена у остальных. Выраженность ПУ не являлась показателем плохого прогноза для детей с ФСГС, т. к. самой высокой она была как при самом благоприятном варианте – верхушечном, так и при неблагоприятном коллабирующем варианте; при генетически обусловленных
вариантах протеинурия, напротив, была не столь выражена.



